Similar presentations:
Фармакопея евразийского экономического союза: основные принципы и требования
1.
НАО «Медицинский университет Караганды»Школа фармации
ФАРМАКОПЕЯ ЕВРАЗИЙСКОГО ЭКОНОМИЧЕСКОГО СОЮЗА: ОСНОВНЫЕ
ПРИНЦИПЫ И ТРЕБОВАНИЯ
Лектор :
доктор фармацевтических наук
Итжанова Хорлан Искожиевна
Караганда 2023г.
2.
Основные принципы создания ФЕАЭС•Современность
• Гармонизация
•Прозрачность
•Непрерывность
3.
Фармакопеи государств-членов ЕАЭСРазработка ГФ РБ ведется на основе Европейской Фармакопеи (ЕФ), а
ее текст максимально гармонизирован с текстом ЕФ, при этом все
национальные требования отмечены определенным способом.
Первый том ГФ РБ был введен в действие 01 января 2007 года,
второй том ГФ РБ — 1 июня 2008 года, третий том — 22 декабря 2009
года.
В настоящее время действует второе издание ГФ РБ в двух томах.
4.
Государственная фармакопея РоссийскойФедерации XIV издание
Впервые в ГФ РФ XIV издания вводятся 164 ФС,
среди которых 40 ФС описывают
фармацевтические субстанции синтетического и
минерального происхождения, 75 –
лекарственные препараты на основе этих
субстанций, 8 – биологические лекарственные
препараты различного происхождения (в том
числе получаемые из крови и плазмы крови
человека), 41 – гомеопатические
фармацевтические субстанции растительного и
минерального происхождения.
В настоящее время действуют 4 тома.
5.
Европейская фармакопея разработана Европейским директоратом по качеству лекарственных средств для здравоохранения (ЕДКЛС — EDQM), являющимся частью Совета Европы, вСтрасбурге, Франция. В настоящее время в Комиссии Европейской фармакопеи состоят 38 членов: Австрия, Бельгия, Босния и Герцеговина, Болгария, Хорватия, Кипр, Чешская Республика, Дания,
Эстония, Финляндия, Франция, Германия, Греция, Венгрия, Исландия, Ирландия, Италия, Латвия, Литва, Люксембург, Мальта, Черногория, Голландия, Норвегия, Польша, Португалия, Румыния,
Сербия, Словацкая Республика, Словения, Испания, Швеция, Швейцария, Республика Македония, Турция, Украина, Великобритания и Европейский союз. ЕФ является официальной фармакопеей в
перечисленных странах и в Европейском союзе.
Она содержит:
•описание аппаратного оснащения для проведения
фармацевтического анализа,
•современное состояние химических, физико-химических, биологических
методов анализа, определения и испытания
лекарственных субстанций и препаратов,
•допустимые пределы примесей,
•методы качественного и количественного анализа,
•методы анализов в фармакогнозии,
•фармацевтические технические методики,
•методы исследования упаковки и контейнеров,
•общие сведения о стерильности и вакцинах,
•методы статистики и пр.,
•частные статьи. Фармакопейные статьи содержат стандарты качества для
всех основных лекарственных средств, применяемых в Европе. Все
лекарственные средства, продаваемые в 36 государствах-участниках
Европейской фармакопеи, должны соответствовать этим стандартам
качества для того, чтобы потребители имели гарантию на продукты,
продаваемые аптеками и другими законными поставщиками.
6.
Фармакопеи мираФармакопея США (USP) — это научная
неправительственная организация, устанавливающая
государственные стандарты США для лекарственных
средств и фармацевтических продуктов. Данные
стандарты определяют требования по идентификации,
концентрации, качеству и чистоте веществ, которые
производятся, продаются и используются на территории
США. Стандарты Фармакопеи США (USP) действуют в
более чем 140 странах. В США соблюдение этих
стандартов контролируется Управлением по контролю
качества пищевых продуктов и лекарственных средств
США (FDA).
7.
Механизмы гармонизации• Гармонизированные фармакопейные тексты по :
- полному механизму
- селективному механизму.
Собственные фармакопейные тексты
- Инкорпорирование
- Разработка в полном объеме
8.
Применение фармакопей по степени приоритетности•I уровень Фармакопея ЕАЭС
•II уровень ГФ РБ, ГФ РК, ГФ РФ
•III уровень Ph. Eur. (базовая), BP,
USP-NF
9.
Эффективность гармонизации• Интегрирование ФЕАЭС в глобальную систему регулирования
обращения ЛС .
• Устранение барьеров и ограничений для обращения ЛС на общем
рынке.
• Конкурентоспособность фармацевтической продукции
производителей ЕАЭС и ее выход на мировой рынок.
• Обеспечение качества проведения экспертизы ЛС при регистрации в
рамках ЕАЭС
10.
Определение ФЕАЭС• Свод региональных
требований и положений,
устанавливающих предельный
допустимый уровень качества
ЛС на фармацевтическом
рынке ЕАЭС . 1 часть I тома
ФЕАЭС утверждена Решением
Коллегии ЕЭК 11.08.2020 №
100 и введена в действие с
01.03.2021
Создание фармакопеи Союза осуществляется в целях
охраны здоровья населения государств-членов Союза и
обеспечения
его
качественными,
безопасными
и
эффективными лекарственными средствами.
Фармакопея Союза является главным инструментом
регулирования качества лекарственных средств на
фармацевтическом рынке Союза, и наряду с нормативными
правовыми актами Союза призвана служить фактором
развития конкурентоспособной и экспортоориентированной
фармацевтической промышленности стран-членов Союза.
Фармакопея ЕАЭС – это основополагающий документ,
необходимый для регистрации лекарственных средств в
рамках Союза. Она также устанавливает критерии доступа
лекарственных средств по качеству на единый рынок.
Документ несет и важную образовательную функцию,
обеспечивая гармонизацию стандартов государств ЕАЭС в
области подготовки фармацевтических кадров.
11.
Функционирование ФЕАЭСРаспространяется на ЛС для медицинского и ветеринарного
применения, обращающиеся на общем рынке.
Регламентирует требования к качеству и упаковке ЛС,
вспомогательных веществ и материалов, испытаниям и
методам/методикам их проведения, а также используемым
реактивам.
Устанавливает критерии доступа по качеству ЛС на общий рынок.
Является основой регистрации и экспертизы ЛС в рамках ЕАЭС.
Выполняет роль главного инструмента регулирования качества ЛС
на общем рынке.
12.
Утверждение и введение в действие ФЕАЭС• Обязывает заявителей и (или) производителей,
зарегистрировавших ЛП по правилам ЕАЭС, внести изменения в
регистрационные досье до 01.01.2026 .
• Все вновь подаваемые заявления на регистрацию с 01.03.2021
должны содержать в спецификациях модуля 3 регистрационного
досье и в НД по качеству ЛП ссылки на ФЕАЭС.
• Изменения касаются общих требований к испытаниям,
методам/методикам их проведения и применяемым реактивам
13.
Новая парадигма качества ЛС (НПКЛС) как основа ФЕАЭС• Качество как воплощение безопасности и
эффективности ЛП в его характеристиках в
установленном диапазоне .
• «Встраивание» качества на всех этапах жизненного
цикла ЛП.
• Внедрение GXP в процесс разработки,
производства и реализации ЛП.
• Реализация концепции «Качество через
разработку» (QbyD).
14.
ФЕАЭС и системы качества (GMP, ISO)• ФЕАЭС как основополагающий документ устанавливает
стандарты качества ЛС, ВВ и материалов.
• Стандарты качества ФЕАЭС применимы лишь при
условии производства в соответствии с требованиями
систем качества.
• Системы качества как эффективный инструмент должны
обеспечивать постоянное соответствие качества ЛС, ВВ
и материалов стандартам ФЕАЭС.
15.
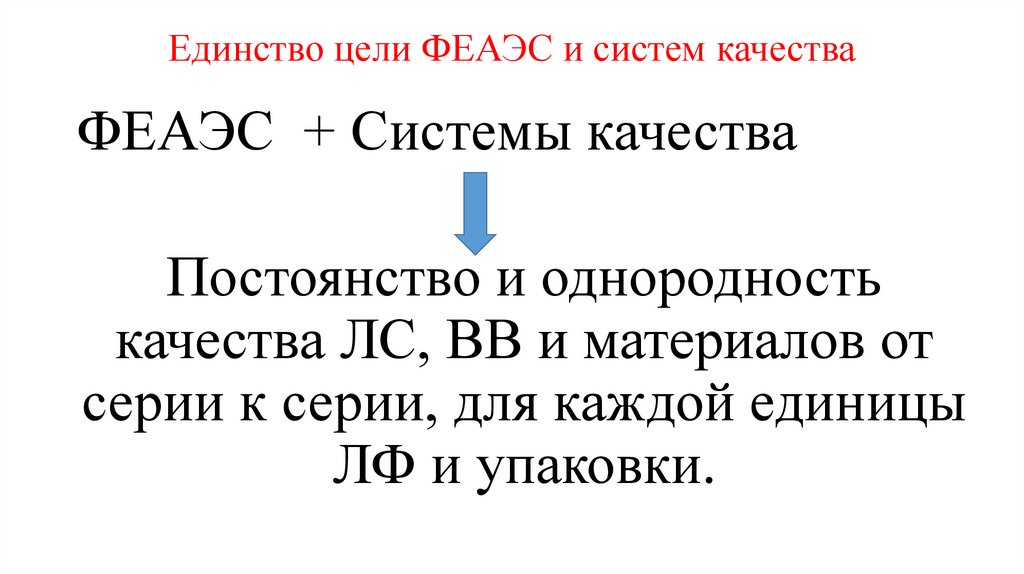
Единство цели ФЕАЭС и систем качестваФЕАЭС + Системы качества
Постоянство и однородность
качества ЛС, ВВ и материалов от
серии к серии, для каждой единицы
ЛФ и упаковки.
16.
Структура ФЕАЭС• Том I (части 1-4) Общие сведения ОФС.
• Том II ЧФС на фармацевтические субстанции
и лекарственные препараты.
• Дополнения.
• Фармакопейные статьи на ветеринарные ЛС.
17.
Структура ЧФС: разделы• Определение
• Производство
• Свойства
• Идентификация
• Испытания на чистоту и функциональность
• КО/Активность
• Хранение
• Маркировка
• Примеси (для СФП)
18.
Характер фармакопейных требований и положений• Обязательный (требования):
-ОФС (большинство)
-ЧФС (полностью)
- Раздел «Производство» ОФС/ЧФС
Рекомендательный (рекомендации) ОФС (отдельные).
Информационный (положения) ОФС (отдельные) • Приложения
(полностью) • Раздел «Свойства» ЧФС • Пределы содержания
примесей (метод нормализации площадей пиков).
19.
Характер ОФС (для примера)• Обязательный (требования)
Однородность дозированных единиц • Остаточные растворители
• Контроль примесей в СФП.
Рекомендательный (рекомендации)
Рекомендации по проведению испытания на растворение
• Верификация ФМ • Трансфер аналитических методик.
Информационный (положения)
Кристалличность • Раздел «Свойства» в ЧФС на СФП
Функциональные характеристики вспомогательных веществ.
20.
Область распространения фармакопейных требованийКатегории: Стерильно • Апирогенно
Формы:• Полиморфные • Лекарственные
Классы:• Физические • Химические
Марки:По степени чистоты реактивов .
21.
Фармакопейные указания• При отсутствии других указаний в ЧФС :
• Требования ОФС должны быть выполнены, если только в эти
требования не внесены изменения или исключения, указанные в ЧФС.
• При отсутствии другого обоснования и разрешения уполномоченного
органа
• Требования ОФС и ЧФС должны быть выполнены, если только по
разрешению уполномоченного органа в эти требования не внесены
изменения или исключения, обоснованные для конкретного случая
(НД).
• Подходящий или пригодный (реактив, методика, микроорганизм и др.)
• Пригодность должна быть подтверждена перед уполномоченным
органом при отсутствии критериев пригодности в ОФС и ЧФС .
22.
Статус «Фармакопейное качество»• СФП, ЛП и упаковочный материал считаются
фармакопейного качества лишь при их соответствии всем
требованиям ОФС и ЧФС
• Статус не требует выполнения производителем всех
испытаний, описанных в ЧФС, при оценке соответствия
фармакопее до выпуска ЛС в обращение .
• Уверенность производителя в фармакопейном качестве
ЛС основана: - на данных разработки - на стратегии
контроля качества, основанной на оценке рисков - на
данных валидации процесса производства - на ежегодных
обзорах качества ЛС .
23.
Методы идентификации• Метод испытания
• Физические константы
• Качественные реакции
(окрашивания и осаждения)
Оптические методы
Хроматография,
Электрофорез
Определяемые показатели
Температура плавления, температура
затвердевания, температура кипения, удельное
оптическое вращение, угол оптического
вращения, показатель преломления,
относительная плотность, вязкость и др.
Ионы, функциональные группы.
Спектры (ИК, УФ, ЯМР)
Хроматограммы (ТСХ, ЖХ, ГХ),
электрофореграммы
24.
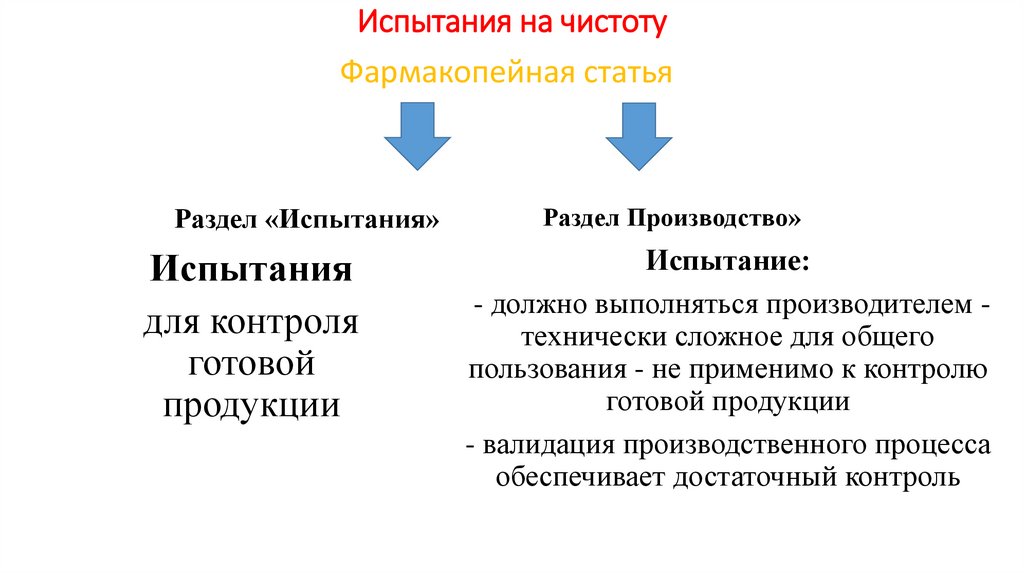
Испытания на чистотуФармакопейная статья
Раздел «Испытания»
Испытания
для контроля
готовой
продукции
Раздел Производство»
Испытание:
- должно выполняться производителем технически сложное для общего
пользования - не применимо к контролю
готовой продукции
- валидация производственного процесса
обеспечивает достаточный контроль
25.
Методы испытаний на чистоту (1)• Испытание
• Родственные примеси
Метод испытания
Жидкостная (ЖХ) и тонкослойная (ТСХ)
хроматография
• Остаточные растворители
• Потеря в массе при
высушивании
• Вода
Газовая хроматография (ГХ)
• Оптическое вращение
• рН
Поляриметрия
Потенциометрия
• Сульфатная зола
• Примеси элементов
Гравиметрия
Полумикро- и микрометод (метод К. Фишера)
Гравиметрия
Атомно-абсорбционный или атомно-эмиссионный
методы
26.
Методы испытаний на чистоту (2)Испытание
Метод испытания
Цветность раствора
Визуальный метод с использованием растворов сравнения
Прозрачность раствора
Визуальный метод с использованием суспензий сравнения,
турбидиметрия, нефелометрия, Ratio-турбидиметрия
МБЧ/Стерильность
Бактериальные эндотоксины (БЭ)
Пирогенность
Микробиологический метод
Испытания с использованием ЛАЛи ТАЛ-реактивов
Биологический метод (на кроликах)
27.
Испытания на функциональность (для примера)Распадаемость
• Растворение
Устойчивость к раздавливанию
Истираемость
Извлекаемый объем
Время полной деформации
• Однородность массы Однородность дозированных единиц
Размер частиц
28.
Типы фармакопейных методик (ФМ) испытаний•Общие ФМ
•Альтернативные ФМ
•Гибкие ФМ
29.
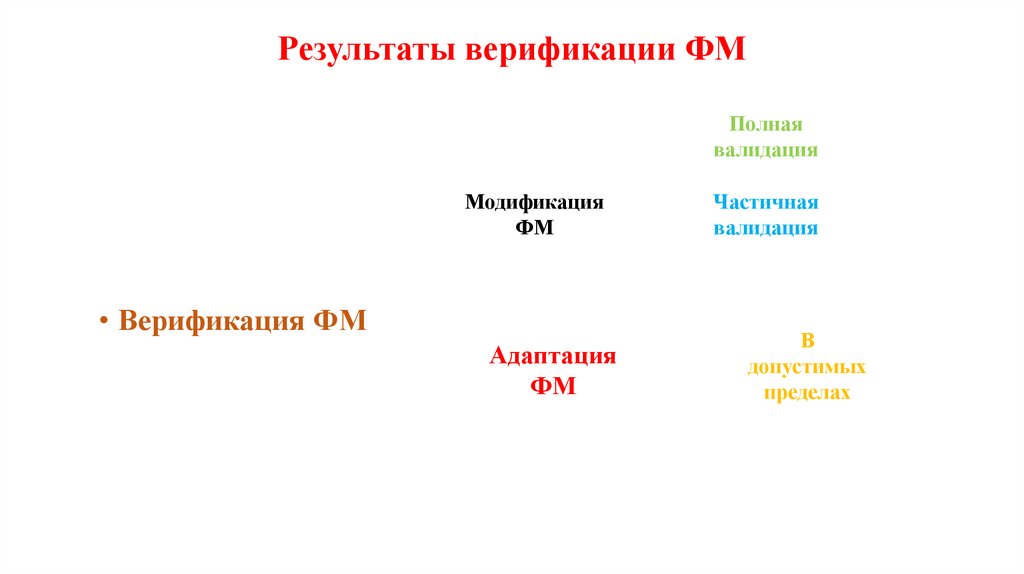
Результаты верификации ФМПолная
валидация
Модификация
ФМ
• Верификация ФМ
Адаптация
ФМ
Частичная
валидация
В
допустимых
пределах
30.
Фармакопейные критерии приемлемости• Основаны на требованиях безопасности и эффективности. Учитывают
диапазоны вариабельности:
- аналитической методики (погрешности) - вариабельности процесса
производства ЛС.
Устанавливаются на основе: - результатов испытаний серийной
продукции, предоставленных производителями, - данных, полученных
при разработке ЧФС испытательными лабораториями.
Может использоваться эмпирическое правило «3-сигма» для ряда
испытаний (например, потеря в массе при высушивании, вода).
31.
Критерии приемлемости производителяСпецификация качества ЛС производителя
•Критерии приемлемости
•Допустимые пределы
Должны быть не ниже
фармакопейных!
32.
Термины и определенияВид СО
Определение
• Стандартный образец (СО) Материал, достаточно однородный и
стабильный в отношении определенных свойств для использования
его в их количественной или качественной оценке в соответствии с
предполагаемым назначением.
• Фармакопейный стандартный образец (ФСО) СО, предназначенный
для использования в соответствии с указаниями ФС.
• Фармакопейный стандартный ИК-спектр Графическое отображение
зависимости пропускания ИК-излучения (%) от волнового числа
(см-1 ), записанное с использованием СО вещества в условиях,
указанных в ЧФС.
33.
Фармакопейные стандартные образцы (ФСО)•Назначение .
Разработка и контроль качества ЛС
•Пригодность к применению
Проверяется согласно предписанной
программе испытаний.
•Необходимость применения.
• Указывается в ОФС и ЧФС,
спецификациях и НД по качеству ЛП.
34.
Назначение ФСО•Идентификация
•Количественное определение
•Испытания на чистоту
•Квалификация оборудования
35.
Классификация ФСО(признак классификации – происхождение)
•Химические СО
•Растительные СО
•Биологические СО
36.
Фармакопейные тексты по СО Фармакопеи ЕАЭС•Разработана ОФС «Стандартные
образцы», предусматриваемая к
включению в часть 2 тома I
Фармакопеи ЕАЭС.
• Ведется перечень СО, применяемых в
ФС Фармакопеи ЕАЭС, который
включается в виде приложения к
каждому выпуску Фармакопеи ЕАЭС.

































 medicine
medicine








