Similar presentations:
Современное состояние и пути совершенствования стандартизации лекарственных средств
1.
Современное состояние ипути совершенствования
стандартизации
лекарственных средств
2. План:
• Значение контроля качествалекарственных средств
• Государственный надзор за качеством
лекарственных средств в РК
• Понятие стандарта. Виды стандартов.
• Основные направления стандартизации.
• Стандартные образцы. Классификация
стандартных образцов
3. В Республике Казахстан функционирует:
«Система допуска на рынокРеспублики Казахстан безопасных,
эффективных и качественных
лекарственных средств»
4. Государственный надзор за качеством ЛС в РК
Основная специфика фарм.службыи фарм. деятельности:
•обеспечение эффективности,
•безопасности,
•конкурентоспособности ЛП.
5. Государственный надзор за качеством ЛС
•основная функция государственного регулирования,•государственная монополия
6. Государственная система контроля качества, эффективности, безопасности ЛС
Постановление Правительства РК №1606 от14 декабря 2012 года «Об утверждении
Правил проведения оценки безопасности и
качества лекарственных средств и изделий
медицинского назначения,
зарегистрированных в Республике
Казахстан»
7. Система стандартизации в здравоохранении Республике Казахстан
Цель стандартизации в здравоохранении:повышение качества медицинских и
фармацевтических услуг, направленных
улучшение здоровья населения.
8. Деятельность по стандартизации в Республике Казахстан регулируется: - Законом Республики Казахстан «О техническом регулировании» от 9 н
Деятельность по стандартизации вРеспублике Казахстан
регулируется:
- Законом Республики Казахстан
«О техническом регулировании» от
9 ноября 2004 года № 603-II ЗРК
- государственными стандартами
по стандартизации
9. Направления стандартизации в здравоохранении:
стандартизация медицинских и фармацевтическихуслуг;
стандартизация технологий, используемых в
процессе осуществления медицинской и
фармацевтической деятельности;
стандартизация лекарственного обеспечения,
стандартизация профессиональной деятельности
(квалификация медицинских и фармацевтических
работников);
стандартизация информационных технологий.
10.
Важнейший объект стандартизациив здравоохранении:
ЛЕКАРСТВЕННЫЕ СРЕДСТВА:
производство;
качество (безопасность,
эффективность);
условия реализации.
11. Основная задача стандартизации лекарственных средств
определение единой системыпоказателей качества
продукции, методов и средств
ее испытание и контроля
12. СТАНДАРТИЗАЦИЯ ЛС
Процесс установления единой системыпоказателей качества ЛС, методов, средств ее
испытания и контроля, обеспечивающий
безопасность и эффективность ЛС.
Стандартизация ЛС проводится в
соответствии с нормативно-технической
документацией, регламентирующей их
качество.
13. Категории нормативных документов
межгосударственные стандарты(ГОСТ);
- государственные стандарты
Республики Казахстан (СТ РК);
- технические условия.
В случае ЛС нормативными
документами являются ФС, ВФС,
АНД, ВАНД.
-
14. Государственная фармакопея Республики Казахстан (ГФ РК)
ГФ РК создана при государственной поддержке ифинансировании Министерством
Здравоохранения Республики Казахстан (20052008 г.г.)
Современное развитие ГФ РК осуществляется в
рамках Государственной программы «Саламатты
Казахстан» (2012-2015 г.г.)
ГФ РК и ее законодательный статус регламентированы Кодексом Республики Казахстан
«О здоровье народа и системе здравоохранения»
15. Миссия ГФ РК
Охрана общественного здоровья путемсоздания государственных стандартов
качества лекарственных средств,
способствующих обеспечению населения безопасными, эффективными и
качественными лекарственными
средствами
16. Приобретение опыта разработки фармакопейных стандартов
Вступление в Европейскую фармакопейнуюкомиссию в статусе официального
наблюдателя (06.2006 г.)
Вступление в Фармакопейную конвенцию
США в статусе официального наблюдателя
(07.2009 г.) и полноправного члена (11.2010
г.)
Участие в подготовке правил «Надлежащая
фармакопейная практика» (GPhP) под
эгидой ВОЗ (03.2012 г. - настоящее время)
17. Основные принципы создания и развития национальных фармакопейных стандартов
Официальное признание ведущихфармакопей мира на территории Республики
Казахстан (Приказ Комитета фармации МЗ
РК № 21 от 11.02.2004 г.)
Приобретение опыта разработки
национальных фармакопейных стандартов
Гармонизация ГФ РК с требованиями
Европейской фармакопеи, Британской
фармакопеи и Фармакопеи США
Участие в глобальной фармакопейной
деятельности
18. Первое издание ГФ РК
Выпущено в 2-х томах на государственном(казахском) и русском языках в 2008 году
Включает
общие
и
частные
статьи
(монографии):
на субстанции для фармацевтического
применения – 300
на лекарственные препараты (ГЛС) – 77
на лекарственное растительное сырье – 26
на медицинские иммунобиологические
препараты – 15
19. СТРУКТУРА МОНОГРАФИЙ ГФ РК
Общая (европейская) частьСодержит требования к ЛС,
произведенным в соответствии с
требованиями GMP
Сохраняет стиль ЕР
Характеризуется близостью перевода к
оригинальному тексту,
адаптированностью его к стилистике
государственного и русского языка, а
также национальной нормативной
документации
20. СТРУКТУРА МОНОГРАФИЙ ГФ РК
Национальная частьСодержит требования к ЛС, не
произведенным в соответствии с
требованиями GMP
Включает дополнительные требования
(как правило, более жесткие),
альтернативные методики,
информационные материалы
Не противоречит общей (европейской)
части, дополняя ее
21. ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ ГФ РК ОТ ЕВРОПЕЙСКОЙ ФАРМАКОПЕИ
Наличие национальной части в большинстверазделов и частных монографий
Разработка и включение 97 национальных
монографий:
на лекарственные субстанции - 3
на морфологические группы ЛРС - 9
на виды ЛРС, произрастающие в РК - 8
на лекарственные препараты (ГЛС) - 77
Легитимизация ГФ РК как национальной
фармакопеи, но не как ЕР, изданной на
казахском языке (аналогично 30 странам мира)
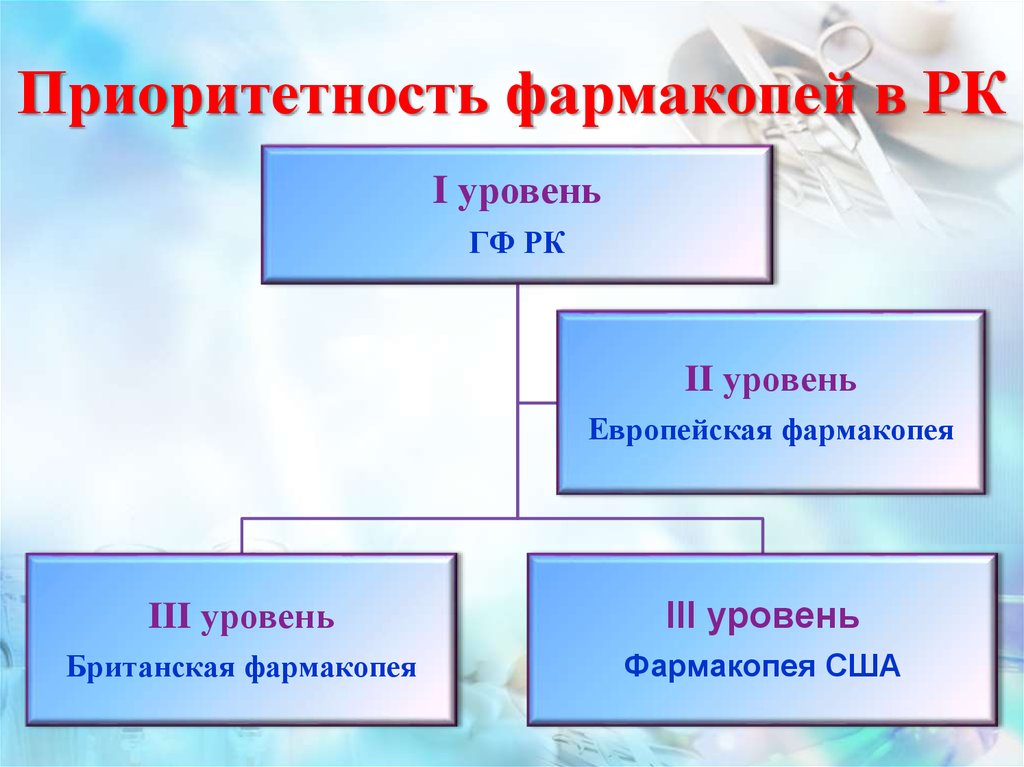
22. Приоритетность фармакопей в РК
I уровеньГФ РК
II уровень
Европейская фармакопея
III уровень
III уровень
Британская фармакопея
Фармакопея США
23. Гармонизация ГФ РК с ведущими фармакопеями мира
Получение официального разрешенияЕвропейского директората по качеству
лекарственных средств Совета Европы (EDQM) на
использование Европейской фармакопеи как
базовой для создания ГФ РК (Страсбург, 03.2007 г.)
Подписание Соглашения о возможности
использования Фармакопеи США для разработки
национальных фармакопейных стандартов РК
(Алматы, 25.10.2010 г.)
Подписание Соглашения о возможности
использования Британской фармакопеи для
разработки национальных фармакопейных
стандартов РК (Лондон, 08.04.2014 г.)
24. ЭТАПЫ РАЗВИТИЯ ФАРМАКОПЕЙНОЙ ГАРМОНИЗАЦИИ В КАЗАХСТАНЕ
1. Официальное признание Европейскойфармакопеи, Британской фармакопеи,
Фармакопеи США, Немецкой гомеопатической
фармакопеи (2004)
2. Вступление в Европейскую фармакопейную
комиссию Совета Европы в качестве странынаблюдателя (2006)
3. Разрешение Европейского директората по
качеству ЛС Совета Европы (EDQM) на
гармонизацию с Европейской фармакопеей (2007)
4. Публикация первого издания Государственной
фармакопеи Республики Казахстан (2008)
25. ЭТАПЫ РАЗВИТИЯ ФАРМАКОПЕЙНОЙ ГАРМОНИЗАЦИИ В КАЗАХСТАНЕ
1.Вступление в Фармакопейную конвенциюСША в качестве страны-наблюдателя (2009)
2.Заключение Договора о гармонизации с
Фармакопеей США между Фармакопейной
конвенцией США и Комитетом контроля
медицинской и фармацевтической
деятельности МЗ РК (2010)
3.Изменение статуса участия в Фармакопейной
конвенции США в качестве полноправного
члена (2010)
26. Принципы гармонизации с базовой фармакопеей (EP)
Признание терминологииЕвропейской фармакопеи
Использование полного механизма
гармонизации фармакопейных
монографий
Двухчастность монографий ГФ РК
(европейская и национальная части)
Своевременное обновление в
соответствии с текущим изданием
27. Условия гармонизации с Британской фармакопеей (BP) и Фармакопеей США (USP)
Использование полного и селективногомеханизмов гармонизации фармакопейных
монографий
Использование преимущественно валидированных методик испытаний лекарственных
препаратов
Маркировка заимствованного текста
специальным символом (BP, USP)
Объем заимствования - не более 2.5 % от
общего числа собственных монографий BP
28. III ТОМ ГФ РК
• Гармонизирован с текущими изданиями EPи USP/NF
• Включает 300 новых монографий
Содержит новые разделы:
- лекарственные растительные
препараты
- гомеопатические препараты
- радиофармацевтические препараты
- изделия медицинского назначения
- биоэквивалентность
- лекарственные препараты, изготовленные в аптеках
29. III ТОМ ГФ РК
Включает 304 новых раздела, текста и монографии:‒ 68 общих разделов, текстов и монографий
‒ 236 частных монографий, в том числе:
• 121 монография на субстанции для фармацевтического применения
• 51 монография на лекарственные препараты
(ГЛС)
• 41 монография на лекарственное растительное
сырье и лекарственные растительные препараты
• 12 монографий на радиофармацевтические
препараты
• 6 монографий на медицинские
иммунобиологические препараты (вакцины)
• 5 монографий на медицинские изделия
30. Национальная часть: принципы
Является отличительным признаком ГФ РК отфармакопей, с которыми осуществлена ее гармонизация
Учитывает особенности фармацевтического рынка в
Республике Казахстан
Содержит дополнительные требования к лекарственным
средствам, не произведенным в условиях GMP
Включает альтернативные методики, дополнительные
информационные материалы
Не противоречит общей (европейской части), а лишь
дополняет ее
Составляет 37 % от общего числа общих разделов, текстов
и монографий
Позволяет позиционировать ГФ РК как национальную
фармакопею (но не Европейскую фармакопею на
национальном языке)
31.
Отдел стандартизациилекарственных средств входит в
организационную структуру Органа по
подтверждению соответствия, является
структурным подразделением
Национального центра.
32. Стандартизация
процесс установления и применениястандартов.
Стандарт - эталон или образец,
принимаемый за исходный, для
сопоставления с ним других
аналогичных объектов.
Стандарт как НТД устанавливает
комплекс норм или требований к
объекту стандартизации.
33.
• Вид стандарта — характеристика,определяющаяся его содержанием в
зависимости от объекта стандартизации.
• ГОСТ Р 1.0 установил следующие основные
виды стандартов:
стандарты основополагающие;
стандарты на продукцию;
стандарты на услуги;
стандарты на процессы (работы);
стандарты на методы контроля;
стандарты на термины и определения.
34. Классификация стандартных образцов и эталоны
Стандартные образцы.Государственные
стандартные образцы
Рабочие стандартные
образцы.
Первичные эталоны
Вторичные эталоны.
35. Государственные стандартные образцы
Выпуск ГСО осуществляется всоответствии с фармакопейной
статьёй, на этикетке указывают
активность ГСО или процентное
содержание; при отсутствии этого
указания СО принимают за 100 %.
Каждая серия ГСО аттестуется в
лаборатории.
36. Общие подходы к оценке качества ГСО
• Субстанция, которую предполагается использовать в качествеГСО, должна подвергаться всесторонней проверке, для чего
необходимо использовать широкий спектр аналитических
методов. Исследование качества исходного материала
включает в себя следующее:
• - определение подлинности;
• - оценка чистоты;
• - оценка применимости субстанции для использования в
качестве ГСО;
• - определение значений физико-химических параметров,
важных для дальнейшего использования ГСО.
37. Методы оценки качества ГСО
• В Общих рекомендациях по разработке, производству ираспределению Государственных стандартных образцов,
применяемых для контроля качества лекарственных средств,
разработанных на основе соответствующих рекомендаций
ВОЗ, содержится исчерпывающая классификация методов
оценки качества ГСО. В нее включены не только те методы,
которые обычно применяются в фармакопейном анализе:
ИК- и УФ-спектрофотометрия, хроматография,
поляриметрия, определение воды методом Карла Фишера,
титриметрия. Для оценки качества ГСО предлагаются
различные, часто весьма дорогостоящие, методы анализа:
ЯМР-спектроскопия, масс-спектрометрия, рентгеновская
дифракционная кристаллография, элементный анализ,
капиллярный электрофорез, дифференциальная
сканирующая калориметрия, анализ фазовой растворимости.
38. Рабочие стандартные образцы (РСО)
образцы серийных лекарственныхвеществ, соответствующие
требованиям ФС. При расчете
количественного содержания
определяемого вещества в
лекарственной форме учитывают
фактическое содержание данного
вещества в РСО.
39. Стандартные образцы веществ-свидетелей (СОВС).
Стандартные образцы веществсвидетелей (СОВС).Используют для определения
специфических примесей или
установления компонентного состава
при проведении хроматографических
методов анализа.
В составе СОВС используют ГСО, РСО,
и вещества, специально изготовленные
и аттестованные в соответствии с
требованиями ФС.
40.
1.2.
3.
4.
5.
6.
Литература
основная:
Арыстанова Т.А. Общая фармацевтическая химия/Учебное
пособие.-Шымкент.-2008.-157 с.
Арзамасцев А.П.. Фармацевтическая химия: учебное пособие, 3-е
изд., испр.-М.:ГЭОТАР-Медиа.-2006.-640 с.
Беликов В.Г. Фармацевтическая химия. В 2-х ч: учебное пособие,
4-е изд., перераб. и доп.-М.: МЕДпресс-информ.-2007.-624 с.
Государственная фармакопея Республики Казахстан.-Алматы:
Издательский дом «Жибек жолы».-2008.-Том 1.-592 с.
Государственная фармакопея Республики Казахстан.- Алматы:
Издательский дом «Жибек жолы».-2009.-Том 2.-804 с.
Ордабаева С.К. Анализ лекарственных препаратов, производных
ароматических соединений.-2012.-270 с.
дополнительная:
1. Арыстанова Т.А., Арыстанов Ж.М. Инновационные технологии в
фармацевтическом образовании: обучение и контроль. Учебнометодическое пособие. – Шымкент.-2012.- 175с.
41.
• Государственная фармакопея Республики Казахстан. – Астана:Министерство здравоохранения Республики Казахстан, 2008. Т. 1, 2 (гос. и
рус. яз.).
• Тулегенова А.У. Гармонизация – уникальный путь развития
фармакопейных стандартов // Фармация Казахстана, 2009. – №5. – С. 9–
10.
• Тулегенова А.У. Создание Государственной фармакопеи Республики
Казахстан – насущное требование времени // Ремедиум, 2007. – №10. – С.
62–65.
• Тулегенова А.У. Государственная фармакопея Республики Казахстан –
главный стандарт качества лекарственных средств// Материалы III съезда
врачей и провизоров Казахстана. – Астана, 2007. Т. 2. – С. 319–321.
• Тулегенова А.У. Концепция эффективности и безопасности
лекарственных средств в Государственной фармакопее Республики
Казахстан// Материалы III съезда врачей и провизоров Казахстана. –
Астана, 2007. Т. 2. – С. 321–323.
• Тулегенова А.У. Концепция введения монографий на лекарственные
препараты в Государственную фармакопею Республики Казахстан //
Фармация Казахстана, 2008. – №10. – С. 8–12.









































 medicine
medicine








