Similar presentations:
Оценка документов, относящихся к разделу 1.10. «Информация по фармаконадзору в государстве-члене ЕАЭС»
1.
Оценка документов, относящихсяк разделу 1.10. «Информация по
фармаконадзору в государствечлене ЕАЭС» в рамках процедуры
регистрации: алгоритм работы
экспертов
Федеральное государственное бюджетное учреждение
«Научный центр экспертизы средств медицинского применения»
Министерства здравоохранения Российской Федерации
2.
Регистрация и экспертиза Гл. V; Гл. VIДокументооборот
Анкета ЛС
Работа с документами
Проект заключения комиссии
Архив
Модуль 1 РД
Раздел 1.10
Информация относительно фармаконадзора заявителя в государстве-члене
(проведение экспертной оценки соответствия документов требованиям
ПНФ ЕАЭС, утвержденных Решением Совета ЕЭК от 03.11.2016 № 87)
2
3.
3Раздел 1.10
Информация относительно фармаконадзора заявителя в государстве-члене
Раздел 1.10.1
Мастер-файл СФ ДРУ
Краткая характеристика СФ ДРУ
Документы СФ соответствует ДРУ, заявленному ДРУ в документе раздела 1.2.1
модуля 1
ДА
НЕТ
Формирование запроса о представлении документов о СФ ДРУ, заявленного
в документе раздела 1.2.1 модуля 1, и соответствии их структуры и
содержанию требованиями раздела III «Мастер-файл система
фармаконадзора» ПНФ ЕАЭС, утвержденных Решением Совета ЕЭК от
03.11.2016 № 87
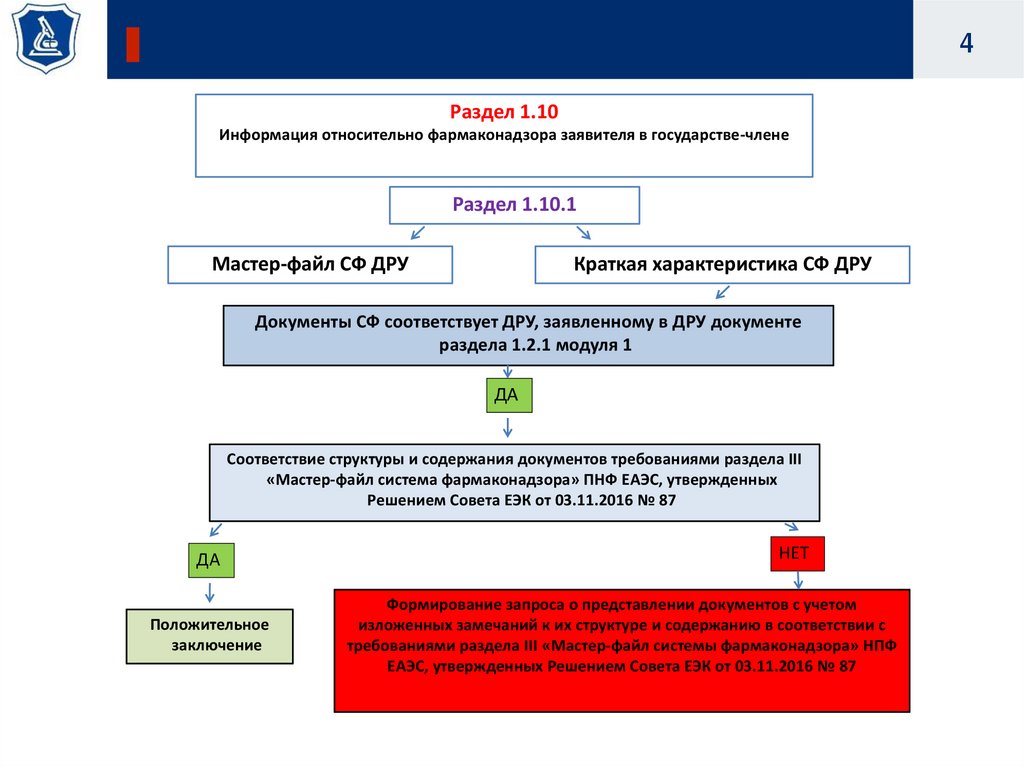
4.
4Раздел 1.10
Информация относительно фармаконадзора заявителя в государстве-члене
Раздел 1.10.1
Мастер-файл СФ ДРУ
Краткая характеристика СФ ДРУ
Документы СФ соответствует ДРУ, заявленному в ДРУ документе
раздела 1.2.1 модуля 1
ДА
Соответствие структуры и содержания документов требованиями раздела III
«Мастер-файл система фармаконадзора» ПНФ ЕАЭС, утвержденных
Решением Совета ЕЭК от 03.11.2016 № 87
ДА
Положительное
заключение
НЕТ
Формирование запроса о представлении документов с учетом
изложенных замечаний к их структуре и содержанию в соответствии с
требованиями раздела III «Мастер-файл системы фармаконадзора» НПФ
ЕАЭС, утвержденных Решением Совета ЕЭК от 03.11.2016 № 87
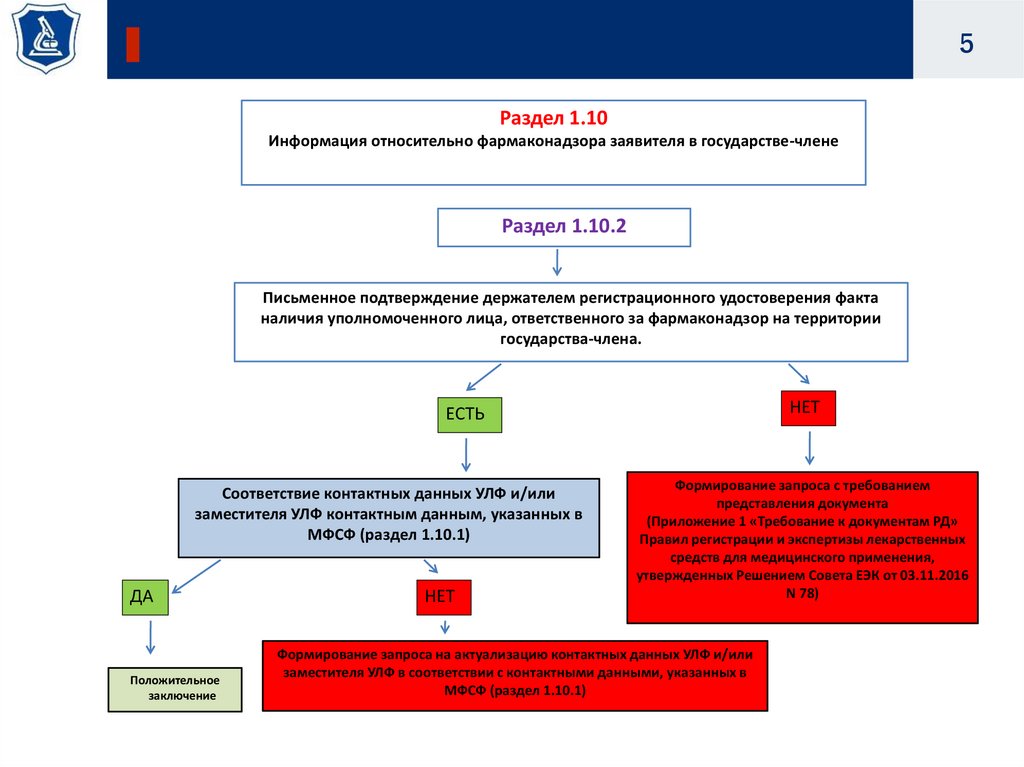
5.
5Раздел 1.10
Информация относительно фармаконадзора заявителя в государстве-члене
Раздел 1.10.2
Письменное подтверждение держателем регистрационного удостоверения факта
наличия уполномоченного лица, ответственного за фармаконадзор на территории
государства-члена.
НЕТ
ЕСТЬ
Соответствие контактных данных УЛФ и/или
заместителя УЛФ контактным данным, указанных в
МФСФ (раздел 1.10.1)
ДА
Положительное
заключение
НЕТ
Формирование запроса с требованием
представления документа
(Приложение 1 «Требование к документам РД»
Правил регистрации и экспертизы лекарственных
средств для медицинского применения,
утвержденных Решением Совета ЕЭК от 03.11.2016
N 78)
Формирование запроса на актуализацию контактных данных УЛФ и/или
заместителя УЛФ в соответствии с контактными данными, указанных в
МФСФ (раздел 1.10.1)
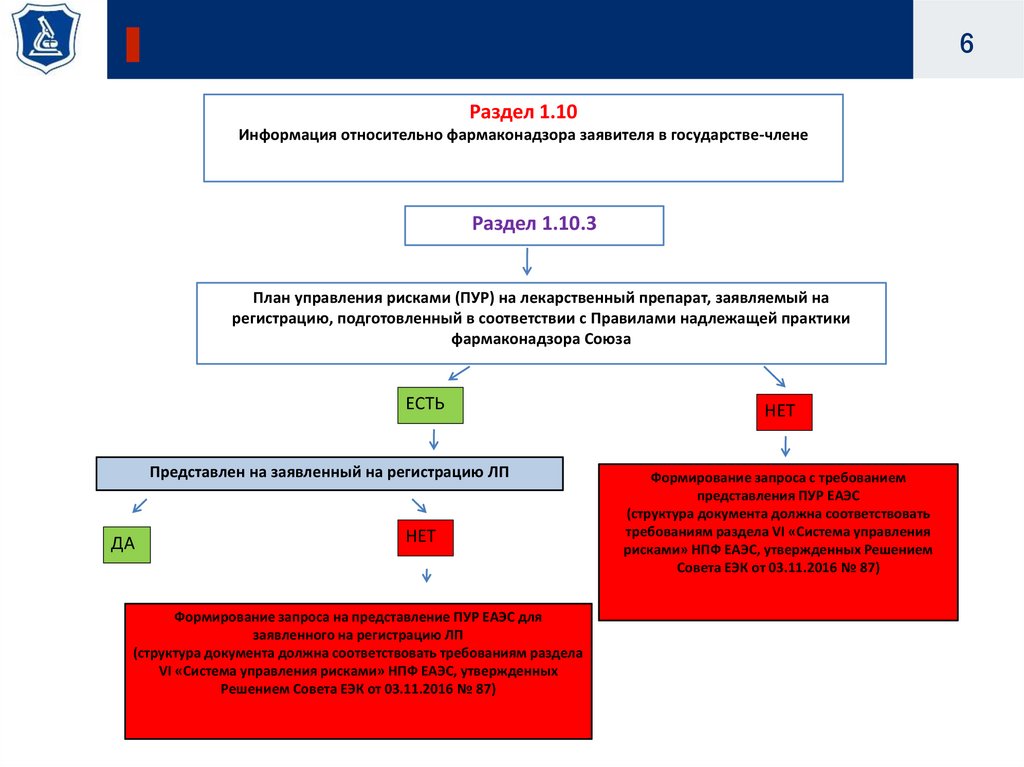
6.
6Раздел 1.10
Информация относительно фармаконадзора заявителя в государстве-члене
Раздел 1.10.3
План управления рисками (ПУР) на лекарственный препарат, заявляемый на
регистрацию, подготовленный в соответствии с Правилами надлежащей практики
фармаконадзора Союза
ЕСТЬ
Представлен на заявленный на регистрацию ЛП
ДА
НЕТ
Формирование запроса на представление ПУР ЕАЭС для
заявленного на регистрацию ЛП
(структура документа должна соответствовать требованиям раздела
VI «Система управления рисками» НПФ ЕАЭС, утвержденных
Решением Совета ЕЭК от 03.11.2016 № 87)
НЕТ
Формирование запроса с требованием
представления ПУР ЕАЭС
(структура документа должна соответствовать
требованиям раздела VI «Система управления
рисками» НПФ ЕАЭС, утвержденных Решением
Совета ЕЭК от 03.11.2016 № 87)
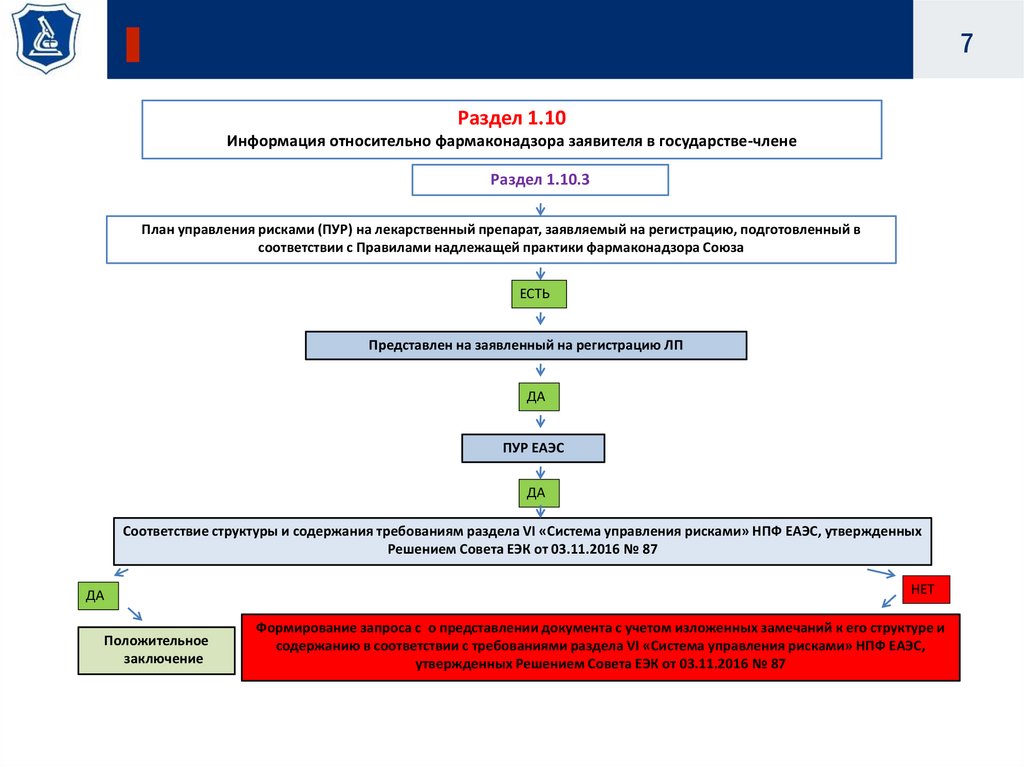
7.
7Раздел 1.10
Информация относительно фармаконадзора заявителя в государстве-члене
Раздел 1.10.3
План управления рисками (ПУР) на лекарственный препарат, заявляемый на регистрацию, подготовленный в
соответствии с Правилами надлежащей практики фармаконадзора Союза
ЕСТЬ
Представлен на заявленный на регистрацию ЛП
ДА
ПУР ЕАЭС
ДА
Соответствие структуры и содержания требованиям раздела VI «Система управления рисками» НПФ ЕАЭС, утвержденных
Решением Совета ЕЭК от 03.11.2016 № 87
ДА
Положительное
заключение
НЕТ
Формирование запроса с о представлении документа с учетом изложенных замечаний к его структуре и
содержанию в соответствии с требованиями раздела VI «Система управления рисками» НПФ ЕАЭС,
утвержденных Решением Совета ЕЭК от 03.11.2016 № 87
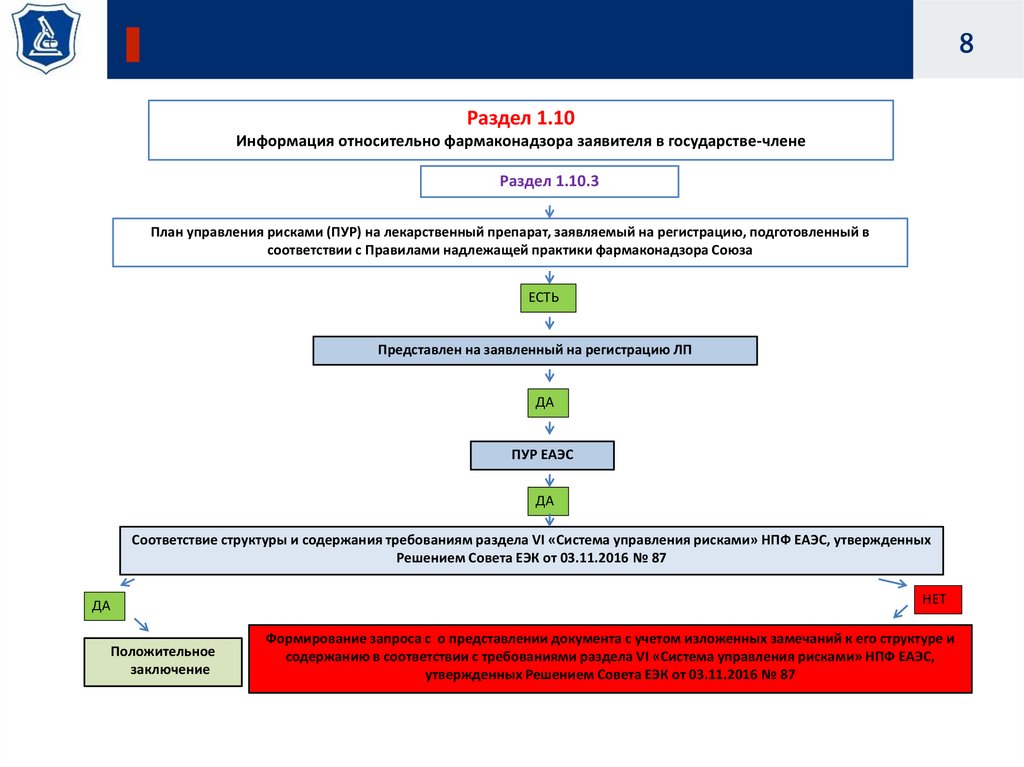
8.
8Раздел 1.10
Информация относительно фармаконадзора заявителя в государстве-члене
Раздел 1.10.3
План управления рисками (ПУР) на лекарственный препарат, заявляемый на регистрацию, подготовленный в
соответствии с Правилами надлежащей практики фармаконадзора Союза
ЕСТЬ
Представлен на заявленный на регистрацию ЛП
ДА
ПУР ЕАЭС
ДА
Соответствие структуры и содержания требованиям раздела VI «Система управления рисками» НПФ ЕАЭС, утвержденных
Решением Совета ЕЭК от 03.11.2016 № 87
НЕТ
ДА
Положительное
заключение
Формирование запроса с о представлении документа с учетом изложенных замечаний к его структуре и
содержанию в соответствии с требованиями раздела VI «Система управления рисками» НПФ ЕАЭС,
утвержденных Решением Совета ЕЭК от 03.11.2016 № 87
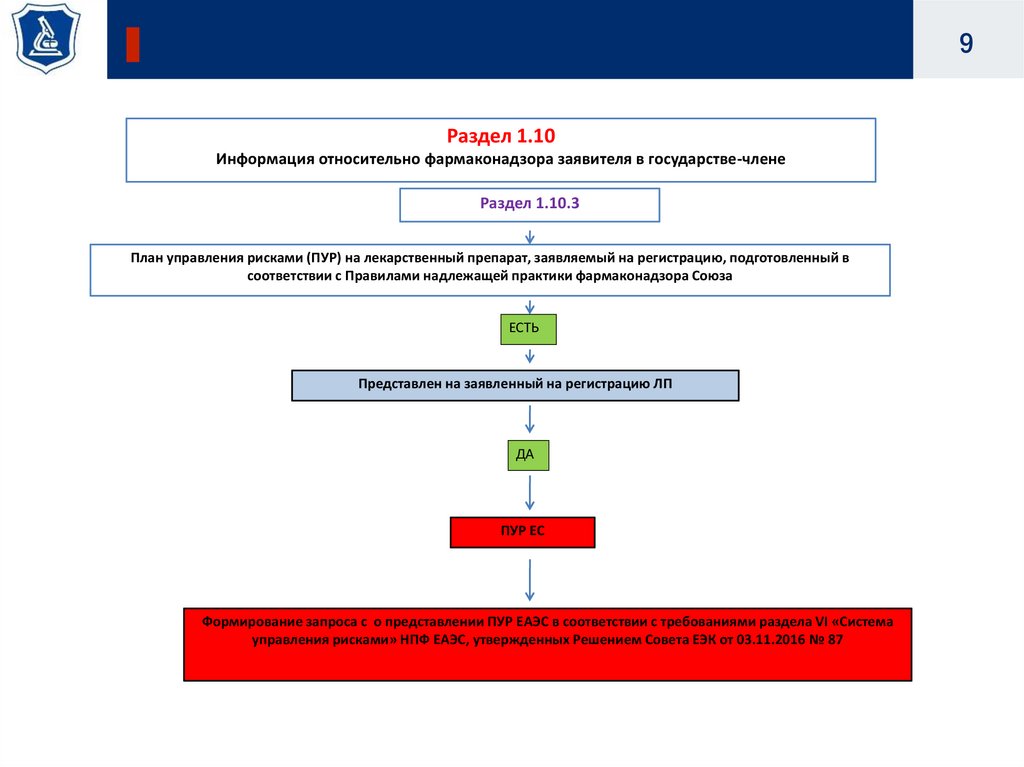
9.
9Раздел 1.10
Информация относительно фармаконадзора заявителя в государстве-члене
Раздел 1.10.3
План управления рисками (ПУР) на лекарственный препарат, заявляемый на регистрацию, подготовленный в
соответствии с Правилами надлежащей практики фармаконадзора Союза
ЕСТЬ
Представлен на заявленный на регистрацию ЛП
ДА
ПУР ЕС
Формирование запроса с о представлении ПУР ЕАЭС в соответствии с требованиями раздела VI «Система
управления рисками» НПФ ЕАЭС, утвержденных Решением Совета ЕЭК от 03.11.2016 № 87
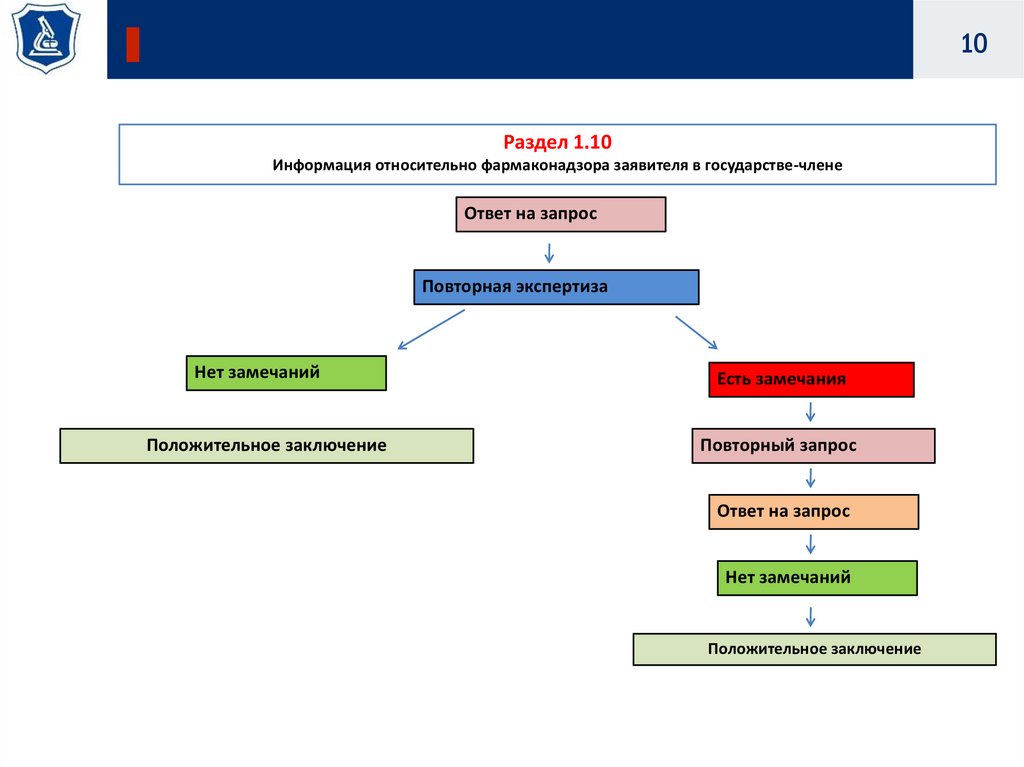
10.
10Раздел 1.10
Информация относительно фармаконадзора заявителя в государстве-члене
Ответ на запрос
Повторная экспертиза
Нет замечаний
Есть замечания
Положительное заключение
Повторный запрос
Ответ на запрос
Нет замечаний
Положительное заключение
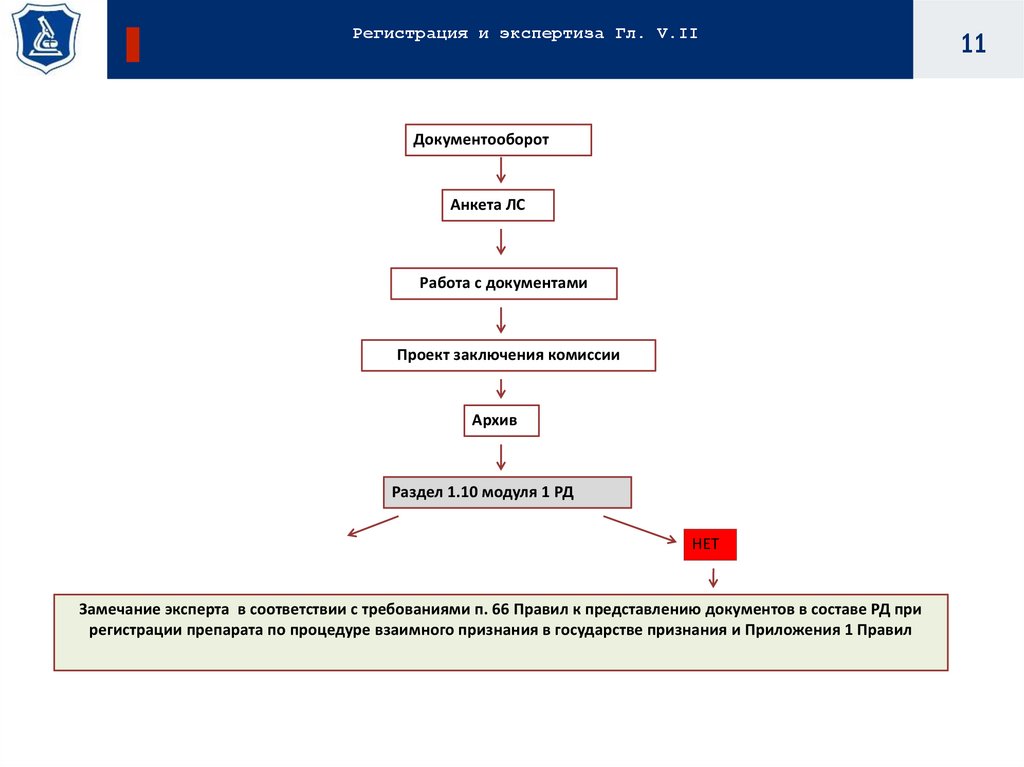
11.
Регистрация и экспертиза Гл. V.IIДокументооборот
Анкета ЛС
Работа с документами
Проект заключения комиссии
Архив
Раздел 1.10 модуля 1 РД
НЕТ
Замечание эксперта в соответствии с требованиями п. 66 Правил к представлению документов в составе РД при
регистрации препарата по процедуре взаимного признания в государстве признания и Приложения 1 Правил
11
12.
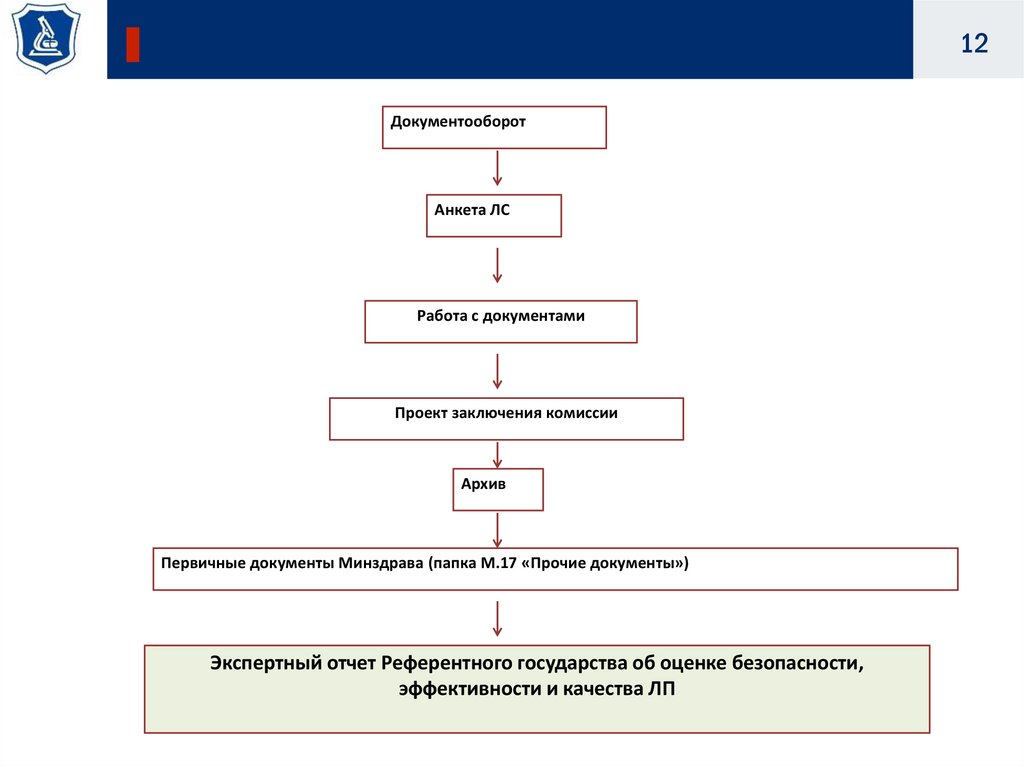
12Документооборот
Анкета ЛС
Работа с документами
Проект заключения комиссии
Архив
Первичные документы Минздрава (папка М.17 «Прочие документы»)
Экспертный отчет Референтного государства об оценке безопасности,
эффективности и качества ЛП
13.
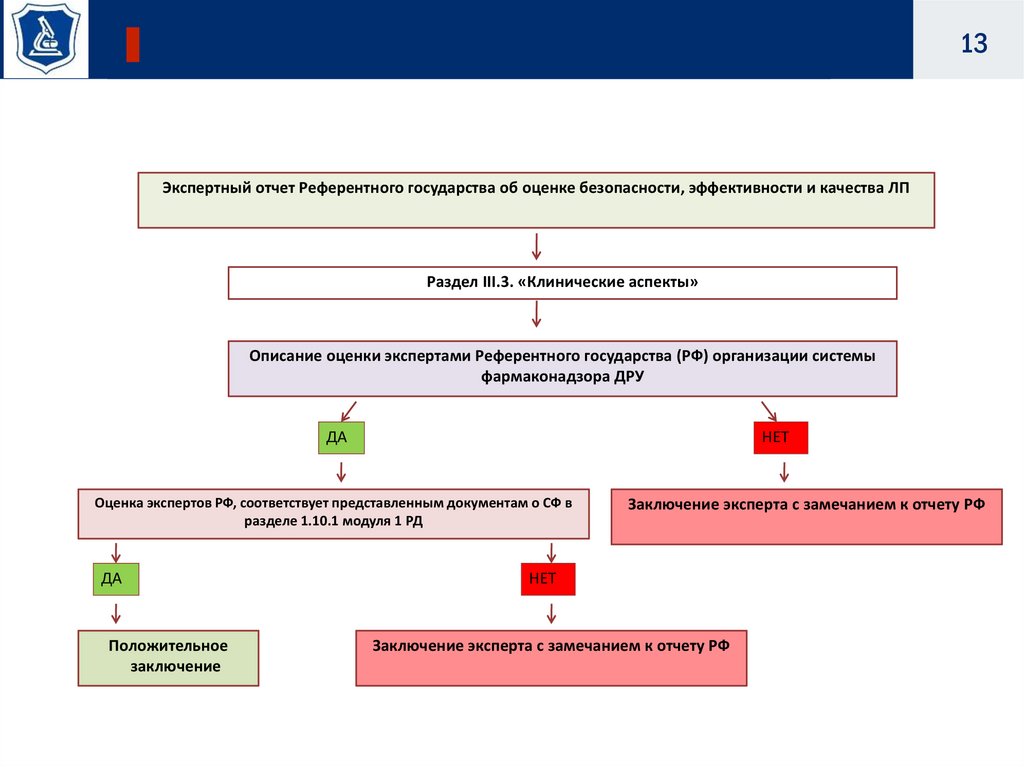
13Экспертный отчет Референтного государства об оценке безопасности, эффективности и качества ЛП
Раздел III.3. «Клинические аспекты»
Описание оценки экспертами Референтного государства (РФ) организации системы
фармаконадзора ДРУ
ДА
НЕТ
Оценка экспертов РФ, соответствует представленным документам о СФ в
разделе 1.10.1 модуля 1 РД
ДА
Положительное
заключение
Заключение эксперта с замечанием к отчету РФ
НЕТ
Заключение эксперта с замечанием к отчету РФ
14.
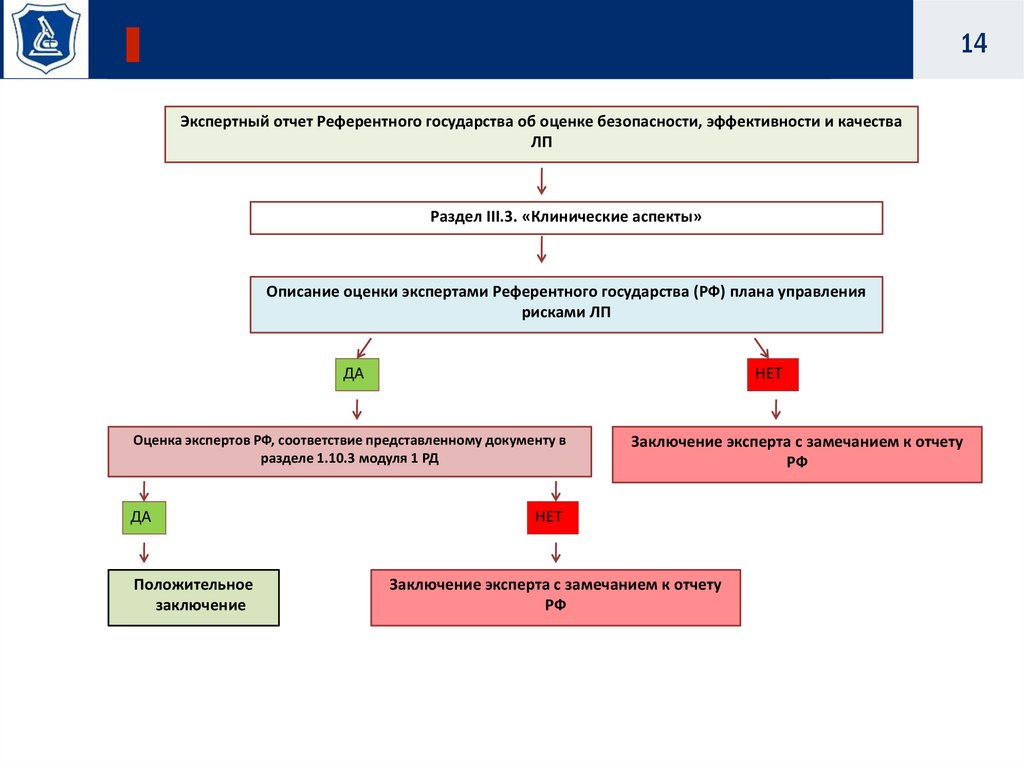
14Экспертный отчет Референтного государства об оценке безопасности, эффективности и качества
ЛП
Раздел III.3. «Клинические аспекты»
Описание оценки экспертами Референтного государства (РФ) плана управления
рисками ЛП
ДА
НЕТ
Оценка экспертов РФ, соответствие представленному документу в
разделе 1.10.3 модуля 1 РД
ДА
Положительное
заключение
Заключение эксперта с замечанием к отчету
РФ
НЕТ
Заключение эксперта с замечанием к отчету
РФ
15.
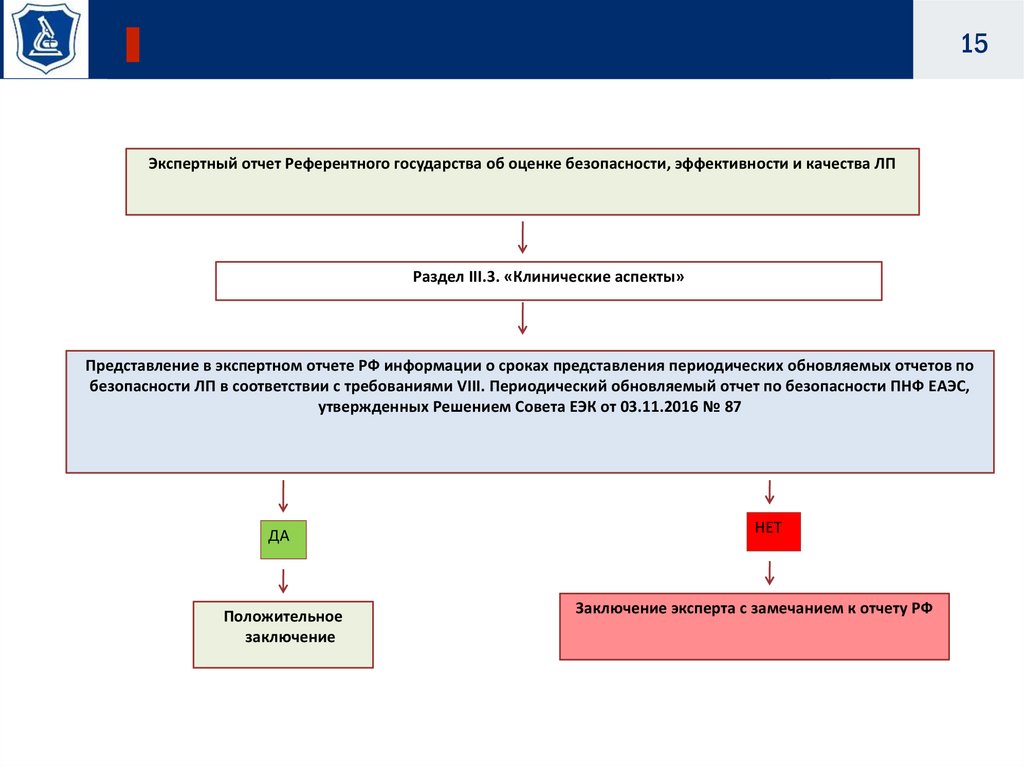
15Экспертный отчет Референтного государства об оценке безопасности, эффективности и качества ЛП
Раздел III.3. «Клинические аспекты»
Представление в экспертном отчете РФ информации о сроках представления периодических обновляемых отчетов по
безопасности ЛП в соответствии с требованиями VIII. Периодический обновляемый отчет по безопасности ПНФ ЕАЭС,
утвержденных Решением Совета ЕЭК от 03.11.2016 № 87
ДА
Положительное
заключение
НЕТ
Заключение эксперта с замечанием к отчету РФ



 law
law








