Similar presentations:
Скорость химических реакций, химическое равновесие
1. Практическая работа №1
Скорость химическихреакций, химическое
равновесие
2. 1. Скорость химических реакций
Опыты 1,2Влияние температуры и концентрации
реагирующих веществ на скорость
взаимодействия иодида калия с
пероксидом водорода в кислой среде:
2KI + H2O2 + H2SO4 = I2 + K2SO4+2H2O
О скорости реакции можно судить,
сравнивая интенсивность окраски
образующегося йода, которая зависит от
температуры и от концентрации
реагирующих веществ.
3. Опыт 1. Зависимость скорости химической реакции от температуры
В две пробирки прилейте по двекапли растворов иодида калия и
серной кислоты. В содержимое
первой пробирки добавьте 8
капель холодной воды, а во
вторую - нагретой до 90-100 С. В
каждую пробирку прибавьте по
одной капле пероксида водорода.
Что наблюдаете?
4.
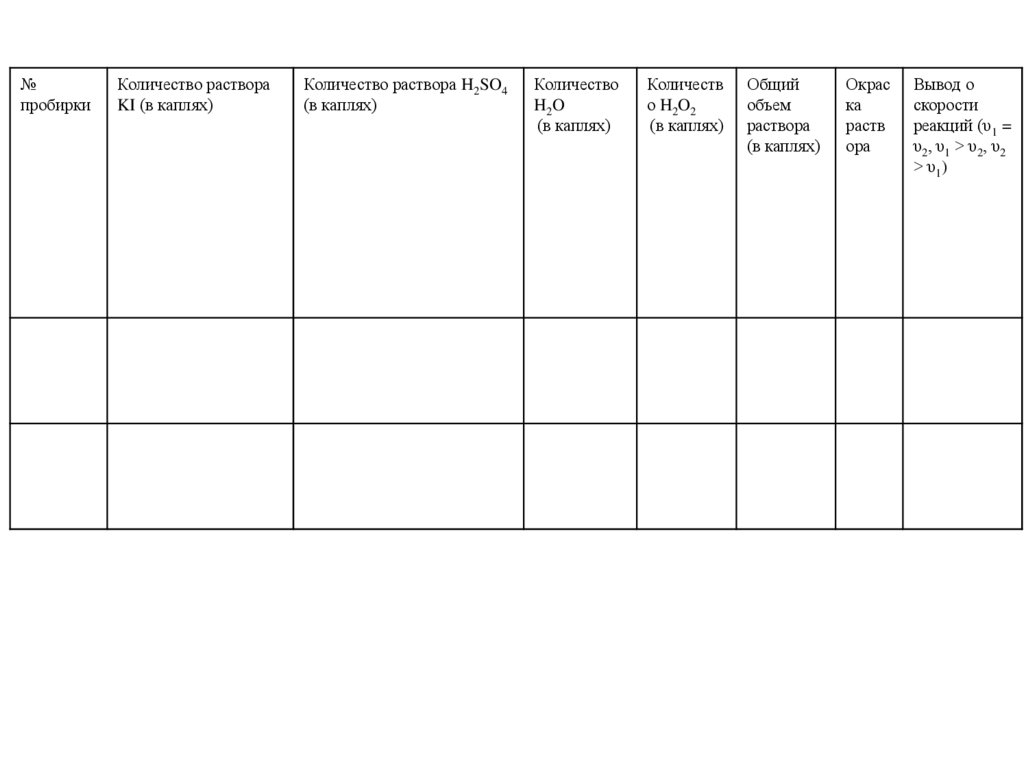
№пробирки
Количество раствора
KI (в каплях)
Количество раствора H2SO4
(в каплях)
Количество
H2O
(в каплях)
Количеств
о H2O2
(в каплях)
Общий
объем
раствора
(в каплях)
Окрас
ка
раств
ора
Вывод о
скорости
реакций (υ1 =
υ2, υ1 > υ2, υ2
> υ1)







 chemistry
chemistry








