Similar presentations:
Уравнение состояния идеального газа
1.
Уравнение состоянияидеального газа
Состояние газа данной массы
характеризуется тремя
параметрами:
р - Давлением
V - Объёмом
T - температурой
2.
Уравнение, связывающее все тримакроскопических параметра
р,V,Т,называют уравнением состояния
идеального газа
• p = nkT, учитывая, что N = NA
а концентрация молекул
• p=
n=
=
NA kT, <=> pV =
,
NA
NA kT
3.
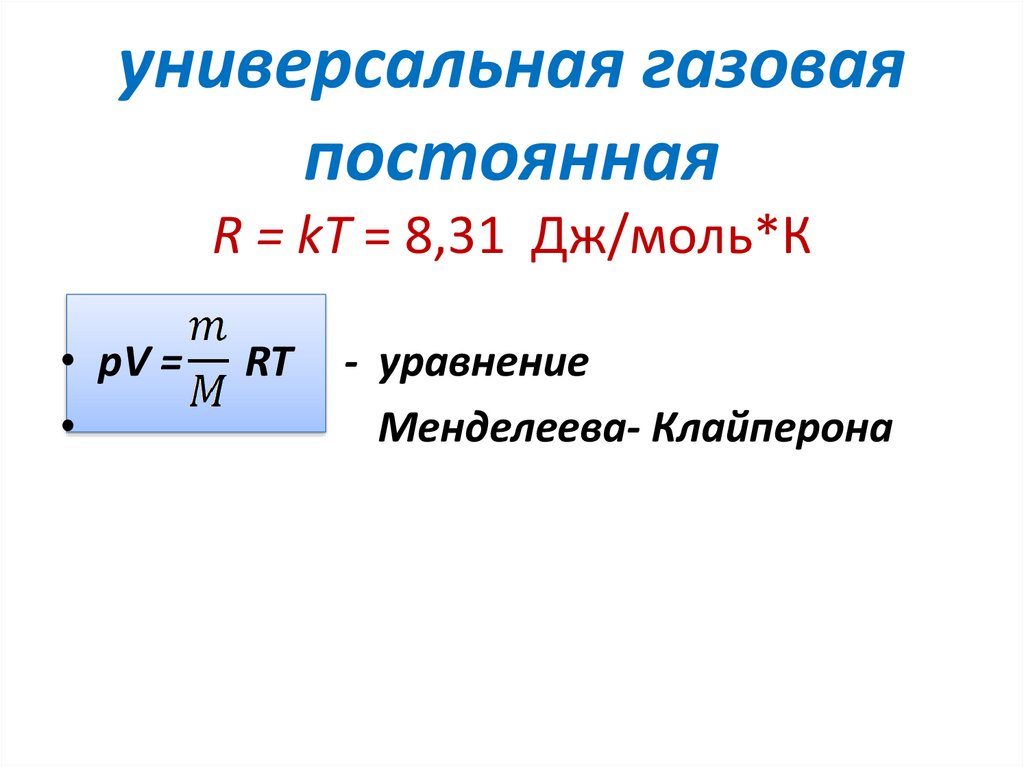
универсальная газоваяпостоянная
R = kT = 8,31 Дж/моль*К
• pV =
RT
- уравнение
Менделеева- Клайперона
4.
1 –ое состояние газа:= R
2- ое состояние газа:
=
Уравнение Клайперона
=
=const
R
5.
Знать уравнение состояниянеобходимо при исследовании
тепловых явлений.
Оно позволяет:
• Определить одну из величин(например:
температуру), если известны две другие.
• Это используется в термометрах.
• Определить, как будет меняться давление, если
увеличивать объём газа при неизменной
температуре.
• Определить как меняется состояние системы,
если она совершает работу или получает теплоту
от окружающих тел.
6.
Изопроцессы(процессы, протекающие при неизменном
значении одного из параметров).
• Изотермический – процесс изменения
состояния термодинамической системы при
постоянной температуре.
Р
T2˃ T1
• Закон Бойля- Мариотта: для газа
данной массы при постоянной
T2
температуре произведение давления T1
газа на его объём постоянно.
pV = const, при T - const
изотерма
V
7.
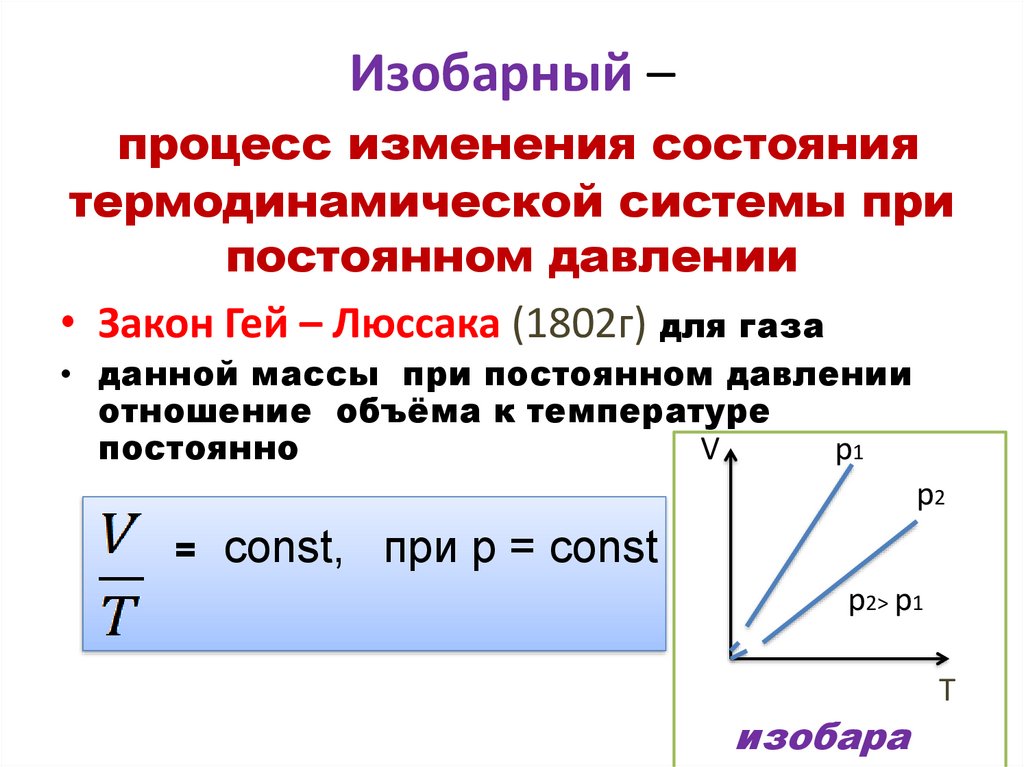
Изобарный –процесс изменения состояния
термодинамической системы при
постоянном давлении
• Закон Гей – Люссака (1802г) для газа
• данной массы при постоянном давлении
отношение объёма к температуре
постоянно
V
p1
p2
=
const, при р = const
p2˃ p1
изобара
T
8.
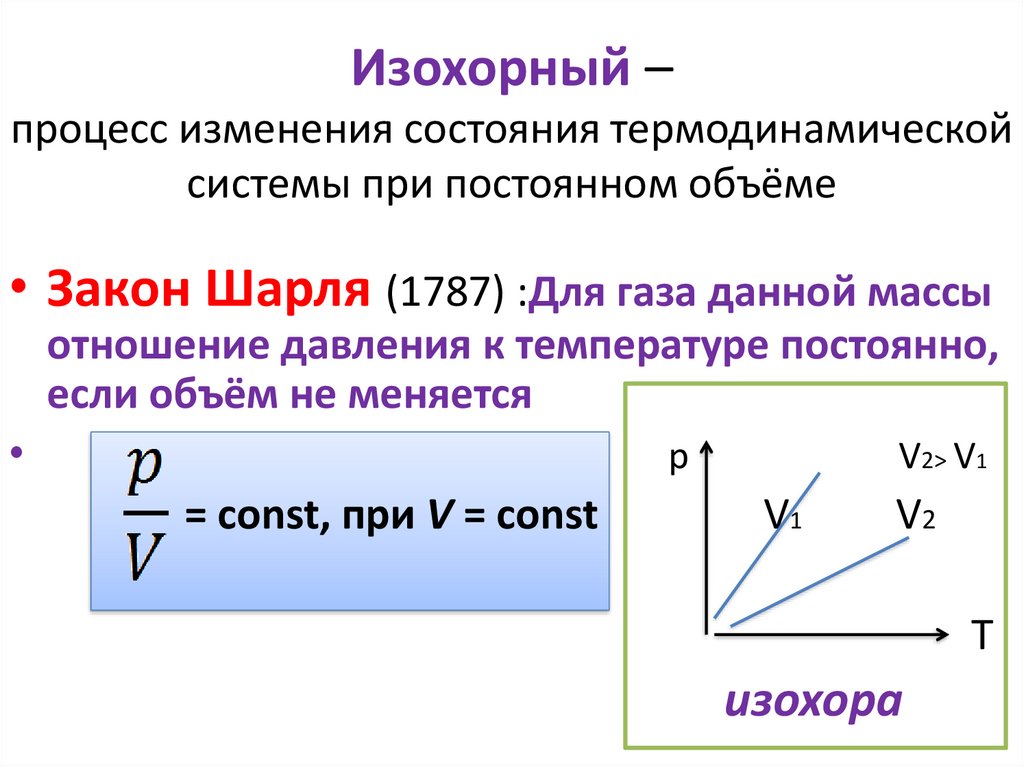
Изохорный –процесс изменения состояния термодинамической
системы при постоянном объёме
• Закон Шарля (1787) :Для газа данной массы
отношение давления к температуре постоянно,
если объём не меняется
р
= const, при V = const
V2˃ V1
V1
V2
T
изохора





 physics
physics








