Similar presentations:
Сера. Графический диктант
1.
Проверка Д/З:Графический диктант:
1.Элемент входит в состав воды.
2.Участвует в построении зубной эмали и костей.
3.В жидком состоянии имеет светло-голубую окраску, в
твердом – синюю.
4.Это газ без цвета, запаха.
5.Это самый легкий из газов.
6.Взаимодействует почти со всеми простыми веществами,
кроме галогенов, благородных газов, золота и платиновых
металлов.
7.Молекула образована ковалентной неполярной связью.
8.Не участвует в процессах дыхания и горения.
9.Распознают по характерному глухому хлопку-взрыву при
поднесении горящей спички к сосуду.
10.Используют для жизнеобеспечения на подводных и
космических кораблях, при работе водолазов, пожарных.
2.
«Возьмите первый слог названия «лунногоэлемента» и прибавьте к нему первый слог
радиоактивного металла, открытого супругами
Кюри 26 декабря 1898 года. Вы получите
название элемента, производного от
древнеиндийского слова, обозначающего
светло-желтый цвет».
Кто из вас догадался, что это за элемент?
3.
СЕРА4.
План урока:дать общую характеристику серы
рассмотреть аллотропные
модификации серы
Физические и химические свойства
нахождение в природе и
применение серы.
5.
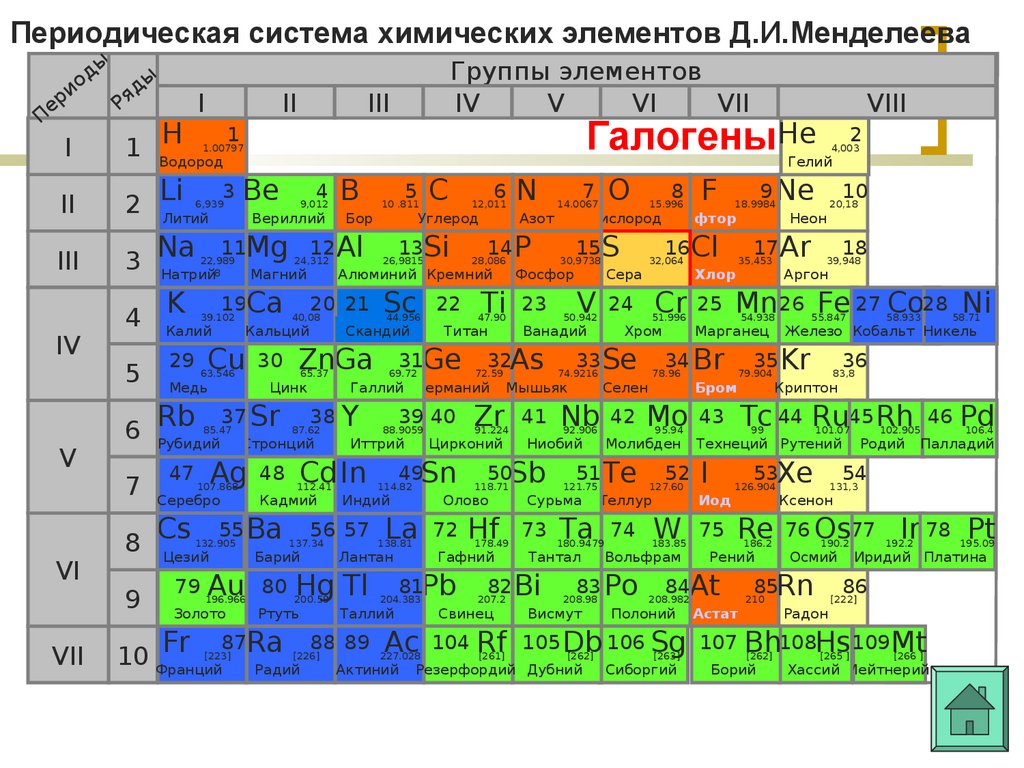
Периодическая система химических элементов Д.И.Менделееваер
П
д
ио
ы
ды
я
Р
H
I
II
Группы элементов
IV
V
VI
VII
III
ГалогеныHe
1
I
1
II
2
III
11Mg 12 Al
13Si
14 P
15S
3 Na
Натрий
Магний
Алюминий Кремний
Фосфор
Сера
IV
V
VI
VII
1.00797
Водород
Li
3
6,939
Be
Литий
5
6
7
8
9
K
Калий
Cu
Медь
Рубидий
47
Ag
Цезий
Fr
48
Au
196.966
Барий
80
Ртуть
87Ra
10 Франций
[223]
Y
Радий
44.956
Ti
22
47.90
Титан
72.59
Цирконий
Олово
La
138.81
Лантан
72
Hf
81Pb
Таллий
Ac
227.028
Актиний
178.49
Гафний
204.383
23
41
Rf
[261]
Cr
51.996
Хром
33 Se
74.9216
92.906
42
Ta
74
Висмут
52
127.60
W
183.85
Вольфрам
83 Po
208.98
95.94
Теллур
180.9479
Тантал
Mo
Молибден
51 Te
121.75
9 Ne
18.9984
фтор
Хлор
25
Полоний
Резерфордий Дубний
[263]
Сиборгий
18
39,948
Аргон
54.938
Марганец
55.847
Бром
58.933
36
83,8
Криптон
Tс 44 Ru45 Rh
43
99
101.07
102.905
Технеций Рутений
I
53Xe
Иод
75
126.904
Re
186.2
Рений
Астат
Родий
46
[262]
106.4
Палладий
54
Ксенон
76 Os77
190.2
Осмий
Ir 78 Pt
192.2
86
Радон
[222]
[265 ]
195.09
Иридий Платина
Bh108Hs 109Mt
Борий
Pd
131,3
85Rn
210
58.71
Железо Кобальт Никель
35 Kr
79.904
105 Db 106 Sg 107
[262]
20,18
Mn 26 Fe 27 Co28 Ni
84At
208.982
10
Неон
17 Ar
35,453
34 Br
78.96
Селен
Nb
Сурьма
73
32,064
24
Ниобий
82 Bi
207.2
Свинец
104
V
50.942
F
16 Cl
30,9738
50Sb
118.71
8
15.996
Кислород
Мышьяк
91.224
49Sn
O
7
14.0067
Ванадий
Zr
39 40
114.82
Азот
32As
31Ge
88.9059
N
28,086
69.72
Индий
88 89
[226]
Sс
Иттрий
Hg Tl
200.59
6
12,011
Галлий Германий
56 57
137.34
C
Углерод
Скандий
Cd In
112.41
Кадмий
55 Ba
132.905
Золото
38
87.62
Стронций
107.868
79
65.37
5
10 .811
26,9815
ZnGa
Цинк
Серебро
Cs
30
37 Sr
85.47
Бор
20 21
40,08
Кальций
63.546
Rb
В
24,312
19Ca
29
4
9,012
Вериллий
39.102
2
4,003
Гелий
22,989
8
4
VIII
[266 ]
Хассий Мейтнерий
6.
1.Сера, как химический элемент1)III малый период; VI(A) группаZ=16;
e=16; р=16; Аr=32; n=16
+16
2)S
2)8 ) 6)
2
1S
2
3s 3p4
0
3d
2S2 2p6
3)Степени окисления: -2; 0; +2; +4; +6
7.
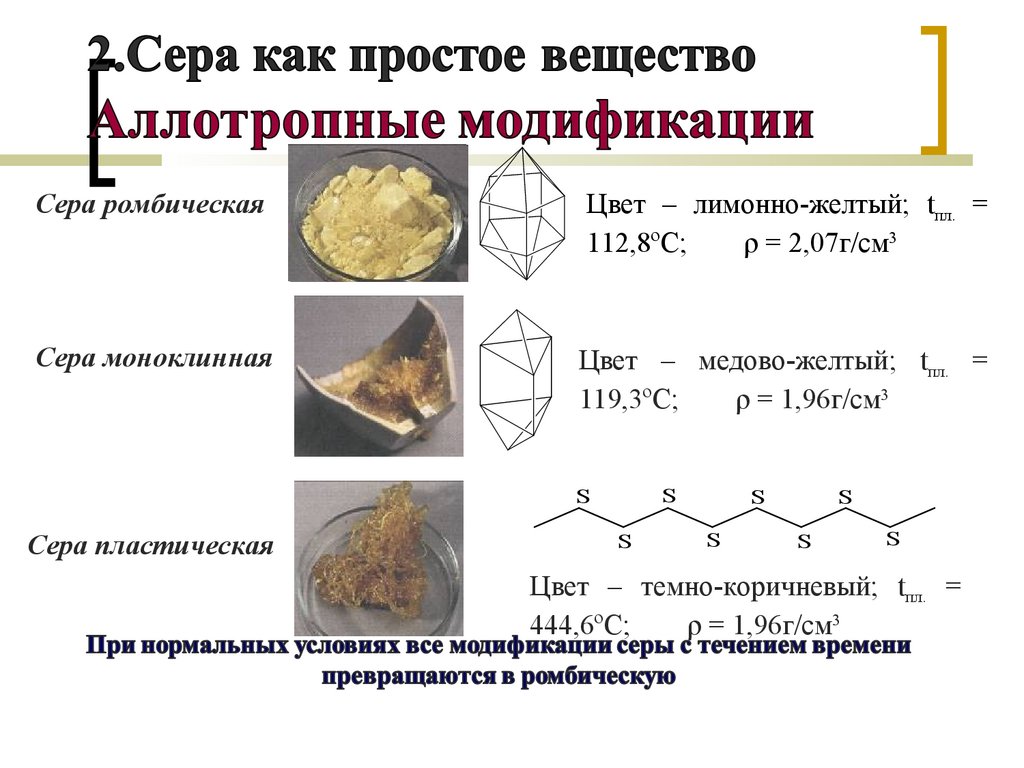
Сера ромбическаяЦвет – лимонно-желтый; tпл. =
112,8ºС;
ρ = 2,07г/смг/см3
Сера моноклинная
Цвет – медово-желтый; tпл. =
119,3ºС;
ρ = 1,96г/см3
S
S
Сера пластическая
S
S
S
S
S
S
Цвет – темно-коричневый; tпл. =
444,6ºС;
ρ = 1,96г/см3
8.
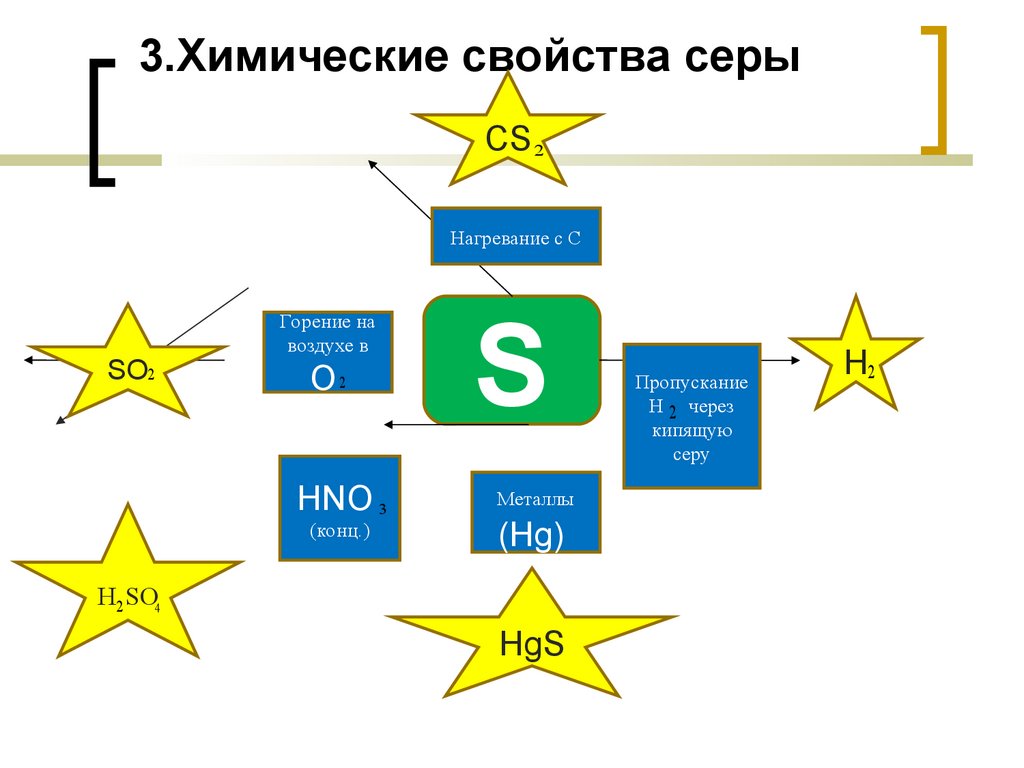
3.Химические свойства серыCS 2
Нагревание с С
SO2
Горение на
воздухе в
О2
HNO 3
(конц.)конц.)
S
Металлы
(Hg))
H2 SO4
Hg)S
Пропускание
Н 2 через
кипящую
серу
H2
9.
МикропаузаДЛЯ УЛУЧШЕНИЯ МОЗГОВОГО
КРОВООБРАЩЕНИЯ
Крепко зажмурьте глаза на 3-5 секунд, а
затем откройте их на такое же время.
Быстро моргайте в течение 10-12 секунд,
откройте глаза, отдыхайте 10-12 секунд.
1.Исходное положение – сидя на стуле.
2.Плавно наклоните голову назад,
наклоните голову вперед, не поднимая
плеч. 3.Поворот головы вправо. 4.
Исходное положение. 5. Поворот головы
влево. 6. Исходное положение. Темп
медленный.
Исходное положение – сидя, руки на поясе.
1–2. Взмахом левую руку занесите через
правое плечо, голову поверните влево. То
же повторите правой рукой.
10.
Сера - окислитель0
0
4 2
1. 2S + C = CS2
0 2 е
2
2 4 S S
в-ся; ок-ль
4
0
4е
1 2 С С
ок-ся; в-ль
1 2
0
0
2.S + H2 =H2 S
2
0
2 е
1 2 S S в-ся; ок-ль
1
1е
*
2
1 2 H2 2Н ок-ся; в-ль
11.
00
2
2
3.S + Hg) = Hg) S демеркуризация
0
2
2 е
12 S S в-ся; ок-ль
2е
0
2
12 Hg)
Hg) ок-ся; в-ль
12.
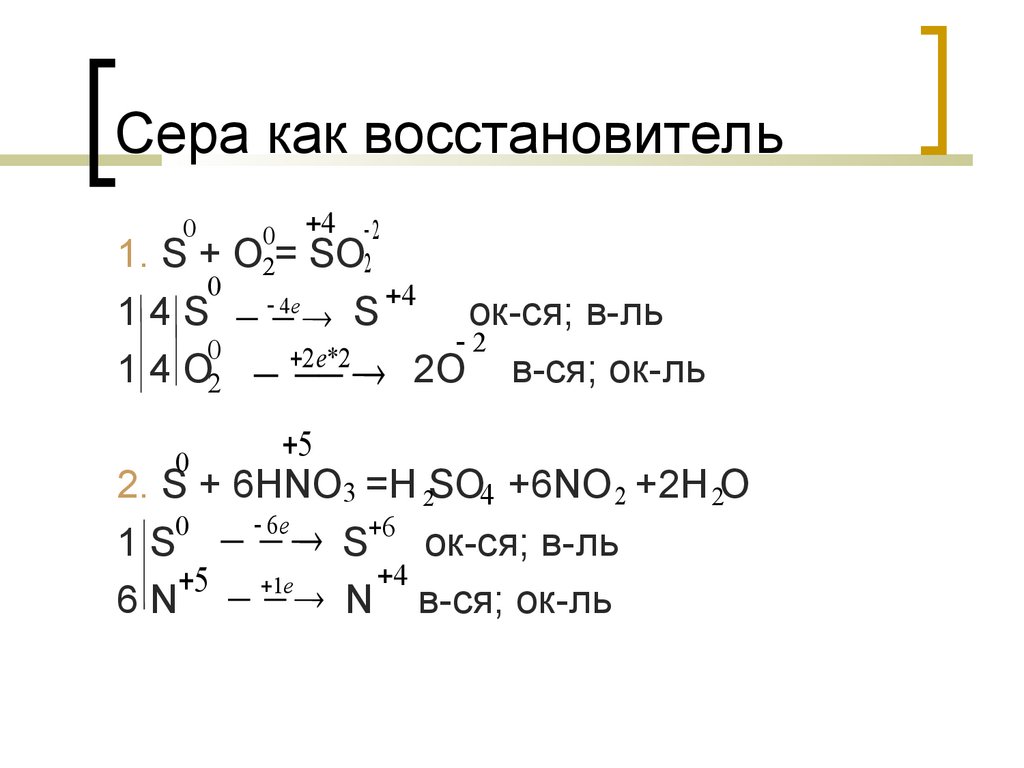
Сера как восстановитель0
0 4 2
O2= SO2
1. S +
0
4
4
е
1 4 S S
ок-ся; в-ль
2
0
2е*2
1 4 O2 2O в-ся; ок-ль
0
5
2. S + 6HNO3 =H 2SO4 +6NO 2 +2H 2O
6е
0
1 S S 6 ок-ся; в-ль
4
5 1е
6 N N в-ся; ок-ль
13.
ЗакреплениеТест на взаимопроверку.
1. Строение атома серы: а) +15)2)8)5; б)
+17)2)8)7; в) +16)2)8)6; г) +18)2)8)8
2. Для атома серы наиболее характерны
степени окисления: а) -2, +2, +4, +6; б) -2, +4,
+5, +6; в) -2, +1, +3, +6; г) -2, +2, +4.
3. Какой модификации серы не существует: а)
ромбической; б) тетраэдрической; в)
моноклинной; г) пластической?
4. Сера не растворяется в а) ацетоне; б) воде;
в) сероуглероде; г) толуоле.
5. При комнатной температуре без
первоначального нагревания сера реагирует с
металлом: а) железом; б) цинком; в)
алюминием; г) ртутью.
14.
Ответы: 1.- в; 2.- а; 3 – б; 4 – б; 5 – г.15.
Домашнее заданиеПрочитать §22.
Выполнить упражнения №1,2,3
стр.134.
Придумать по 5вопросов по
параграфу.











 chemistry
chemistry








