Similar presentations:
Свойства серы
1. СВОЙСТВА СЕРЫ
07.12.20231
2. Cера - химический элемент
•Положение в ПСХЭ:порядковый номер 16,
период 3,
VI группа, подгруппа главная
•Электронная формула: 1s22s22p63s23p6
•Валентные возможности: II, IV, VI
•Возможные степени окисления: -2, 0, +2, +4, +6.
07.12.2023
2
3. План урока
• Cера - химический элемент• ИСТОРИЯ СЕРЫ
• Сера – простое вещество
• ФИЗИЧЕСКИЕ СВОЙСТВА
• Химические свойства
• получение серы
• Проверь себя
07.12.2023
3
4.
Строение внешнего электронного слояатома серы выглядит вот так
S -2
3s
но образует соединения
со степенями окисления
+2, +4 и +6 – так как…
+2
S
3p
II
+4
S
IV
S+6
VI
3s
3p
3d
5. ИСТОРИЯ СЕРЫ
• Элементарную природу серы установилфранцуз Антуан Лоран Лавуазье (по
образованию юрист, а по призванию
химик) в своих опытах по сжиганию.
• Древнерусское название "сера"
употребляется очень давно. Оно
происходит от санскритского слова
"сира", что означает светло-желтый.
• Но есть и другое древнерусское название
серы - "жупел" (сера горючая).
07.12.2023
5
6.
Аллотропные модификации серыПриродная сера состоит из смесей четырех
устойчивых изотопов:
32
16S,
33
16S,
34
16S,
36
16S.
Сера ромбическая (кристаллы)
• цвет – лимонно-желтый
• tпл. = 112,8ºС; ρ = 2,07г/см3
Сера моноклинная ( иглы)
• цвет – медово-желтый
• tпл. = 119,3ºС; ρ = 1,96г/см3
Сера пластическая (полужидкость)
S S S S
• цвет – темно-коричневый
• tкип. = 444,6ºС; ρ = 1,96г/см3
S
S
S
S
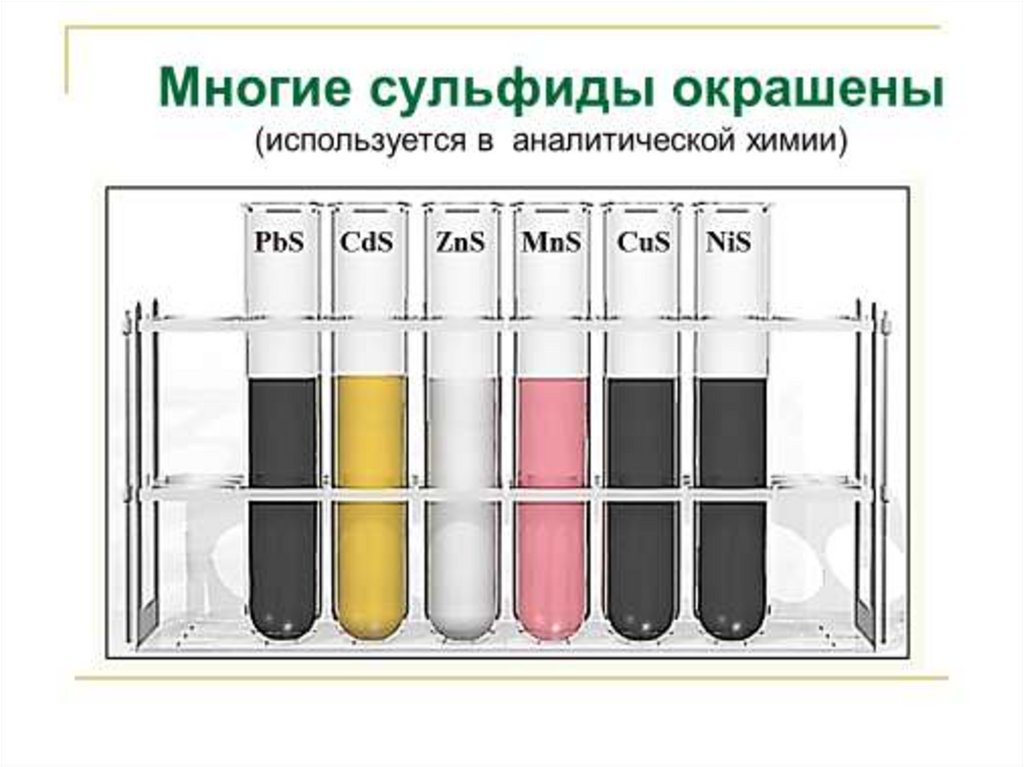
7. Химические свойства
С металлами1. При обычных условиях реагирует c
щелочными и щелочноземельными металлами (со всеми), медью,
серебром, ртутью образуя сульфиды:
Me + S MexSy:
Hg + S HgS
демеркуризация (обезвреживание ртути)
2. При нагревании сера реагирует с другими металлами (Zn, Al, Fe)
3. и только золото (Au) не взаимодействует с ней ни при каких условиях
8.
Химические свойстваС неметаллами
1.
Взаимодействие с водородом при нагревании
с образованием сероводорода:
H2 + S H2S
2.
Взаимодействие с кислородом:
S + O2 SO2 сернистый газ,
при его дальнейшем окислении:
SO2 + O2 SO3 серный газ
3.
из неметаллов с серой не реагируют
только азот (N), йод (I)и благородные газы
07.12.2023
8
9.
Химические свойстваСо сложными веществами
1. Сера с водой и разбавленными кислотами не
взаимодействует,
2. Со щелочами сера взаимодействуют с образованием сульфидов
и сульфитов (реакция обратимая):
3S + 6КОН = 2К2S + К2SО3+ ЗH2O
3. сильными кислотами взаимодействует только при длительном
нагревании*
2H2SO4(конц.) + S → 3SO2↑ + 2H2O
6HNO3(конц.)+ S→H2S↑+ 6NO2↑+ 2H2O
4. в реакции с бертолетовой солью (горение спички)
2KClO3+3S→2KCl+3SO2↑
07.12.2023
9
10.
Получение серыВ промышленных условиях серу получают:
1. без подъема руды на поверхность - путем плавления
серы нагретым водяным паром.
2. окислением сероводорода
2 H2S + O2 = 2 S + 2H2O
или его разложением:
H2S = H2 + S
3. восстановлением сернистого газа:
SO2 + C = S + CO2
07.12.2023
10
11. литература
• http://school-collection.edu.ru/• http://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%B0
• Химия. 9 класс; учеб.для общеобразоват. учреждений/
О.С.Габриелян,-11-е изд., испр. - М. : Дрофа, 2006. – 267,
с. : ил.
07.12.2023
11
12.
07.12.202312
13.
07.12.202313
14.
07.12.202314













 chemistry
chemistry








