Similar presentations:
Сера и её соединения. Степени окисления
1. СЕРА
SСЕРА
и её соединения
Учитель химии МКОУ СОШ
№3 с.Чикола РСО-Алания
Кадохова А.Г.
2. Девиз урока :
« Жить – значитузнавать»
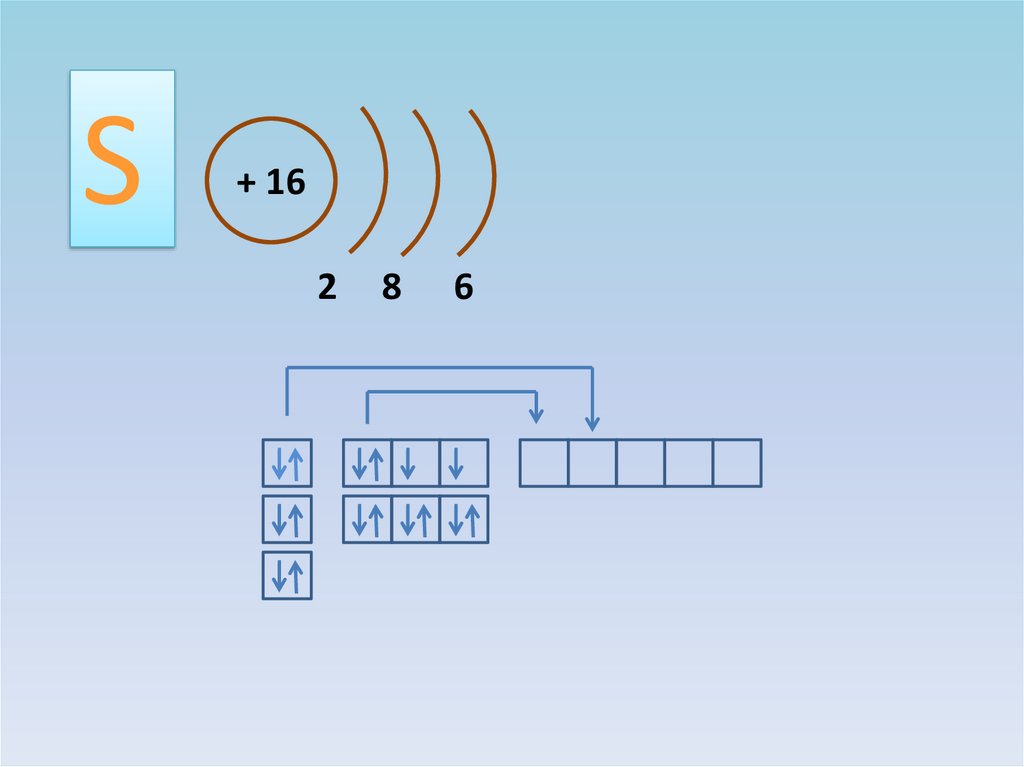
S
3.
S+ 16
2
8
6
4.
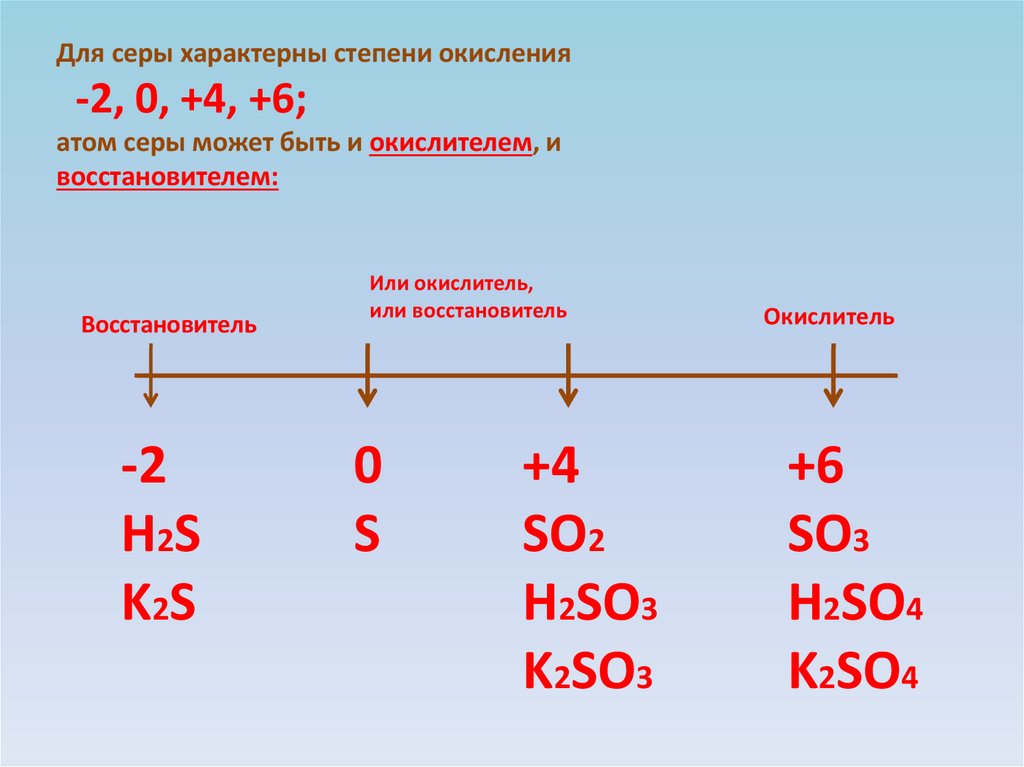
Для серы характерны степени окисления-2, 0, +4, +6;
атом серы может быть и окислителем, и
восстановителем:
Восстановитель
-2
H2S
K2S
Или окислитель,
или восстановитель
0
S
+4
SO2
H2SO3
K2SO3
Окислитель
+6
SO3
H2SO4
K2SO4
5.
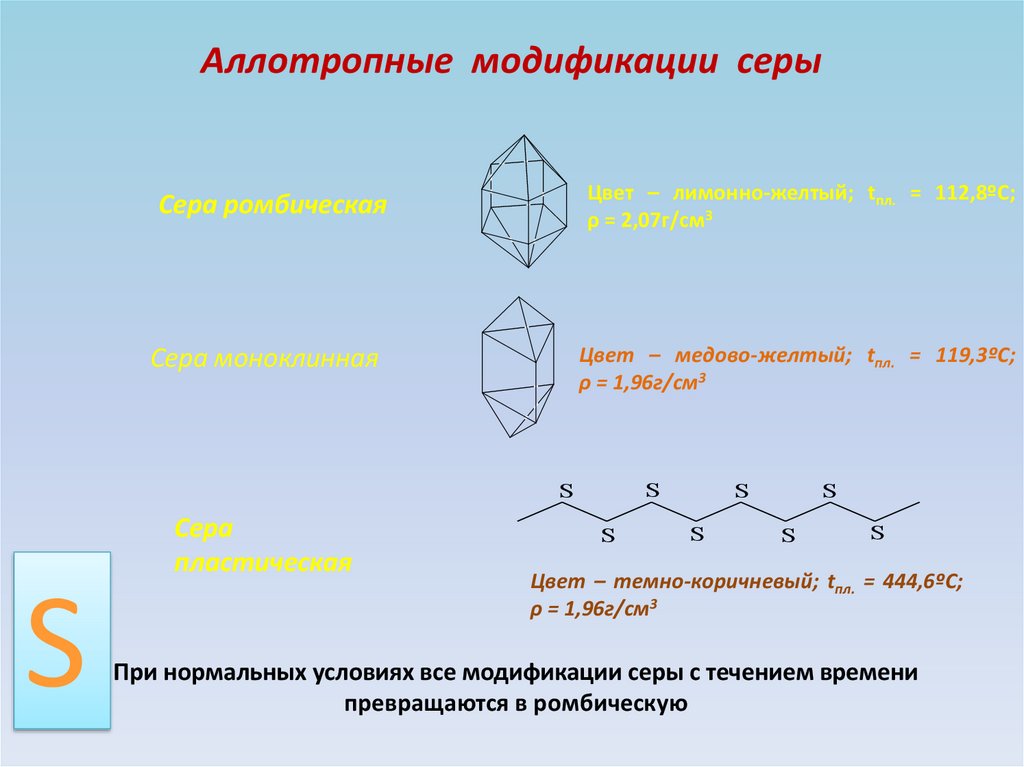
Аллотропные модификации серыЦвет – лимонно-желтый; tпл. = 112,8ºС;
ρ = 2,07г/см3
Сера ромбическая
Цвет – медово-желтый; tпл. = 119,3ºС;
ρ = 1,96г/см3
Сера моноклинная
S
S
Сера
пластическая
S
S
S
S
S
S
S
Цвет – темно-коричневый; tпл. = 444,6ºС;
ρ = 1,96г/см3
При нормальных условиях все модификации серы с течением времени
превращаются в ромбическую
6.
SУ жёлтой серы есть корона,
Но нет ни подданных, ни трона.
Корону сера надевает,
Когда устойчивой бывает.
Нагрев ведёт к кристаллам длинным
Бесцветной серы моноклинной.
7.
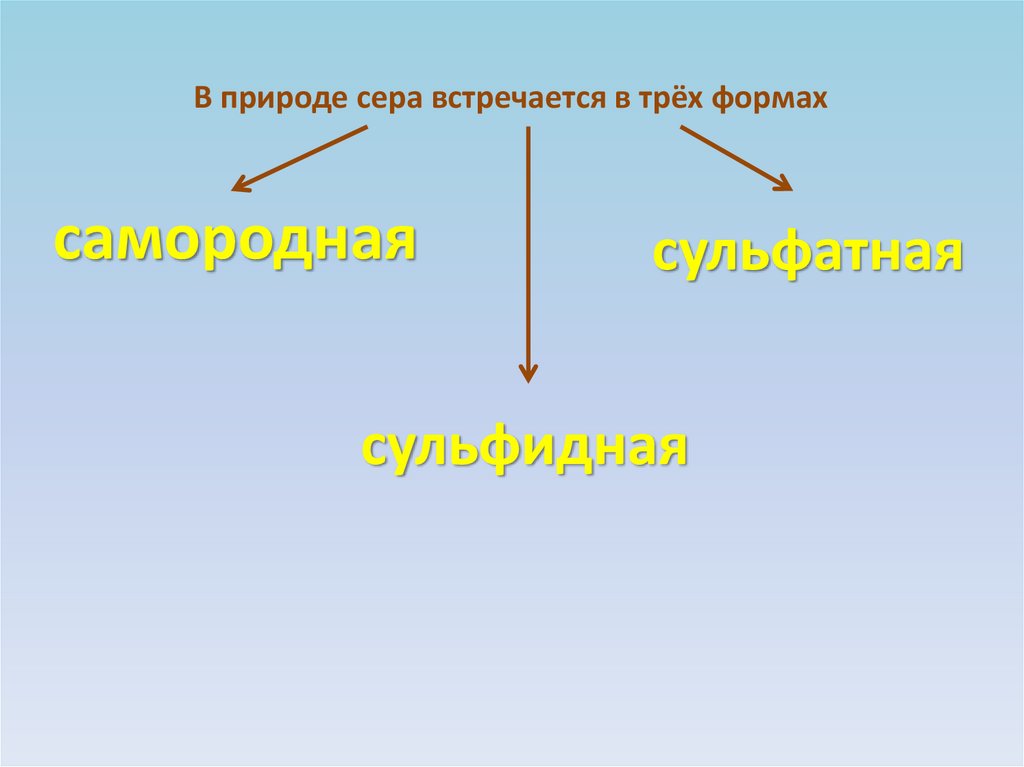
В природе сера встречается в трёх формахсамородная
сульфатная
сульфидная
8.
SО каких соединениях серы упоминал А.С.Пушкин в стихотворении,
написанном в 1832г.?
Тогда услышал я (о диво) запах скверный,
Как будто тухлое разбилося яйцо
Иль карантинный страж курил жаровней серной.
Я, нос себе зажав, отворотил лицо…
Ответ: о сероводороде H2S и диоксиде серы SO2, который
с глубокой древности использовали для дезинфекции
(окуривание горящей серой).
9. Химические свойства серы
SХимические свойства серы
1. Взаимодействие с металлами.
2
1
восстановитель
окислитель
10. Взаимодействие серы с натрием (видеоопыт)
http://files.schoolcollection.edu.ru/dlrstore/3e6b77cf-8fff882a-d3c3-c50221c6eba9/index.htm11.
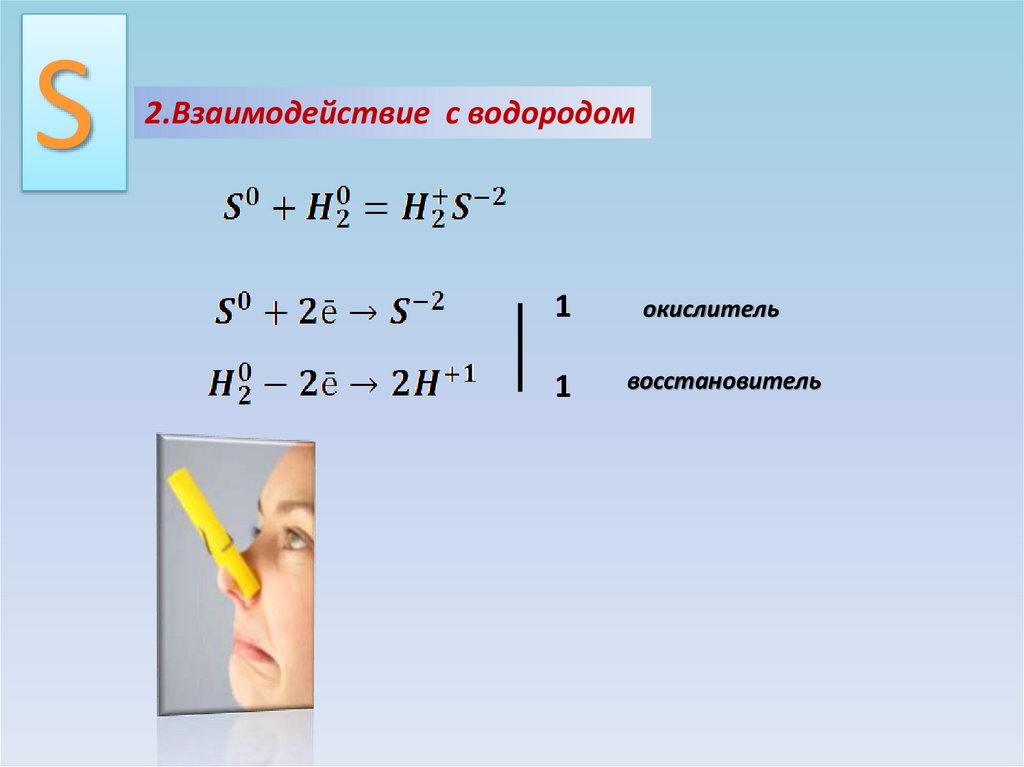
S2.Взаимодействие с водородом
1
1
окислитель
восстановитель
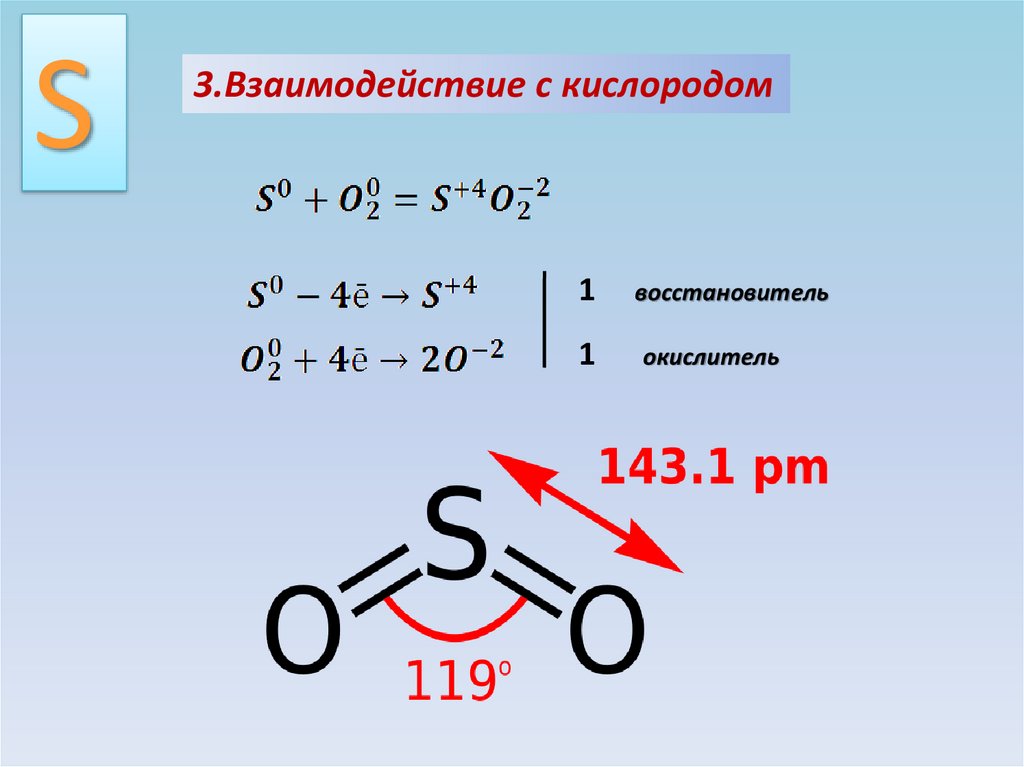
12.
S3.Взаимодействие с кислородом
1
1
восстановитель
окислитель
13.
Диоксид серы – загрязнитель атмосферы14.
S15.
•Уравнение реакции, в котором сера являетсяокислителем:
А. Zn + S → ZnS
Б. 2SO2 + O2 → 2SO3
В. S + Cl2 → SCl2
Г. SO3 + H2O → H2SO4
•Свойство, не характерное для серы:
А. Растворима в воде
Б. Не проводит электрический ток
В. твердое вещество желтого цвета
Г. Горит
•Сумма всех коэффициентов в уравнении реакции:
MgS + O2 → MgO + SO2
А. 4
Б. 6
В. 9
Г. 12









 chemistry
chemistry








