Similar presentations:
Многоатомные спирты
1.
Многоатомные спирты2.
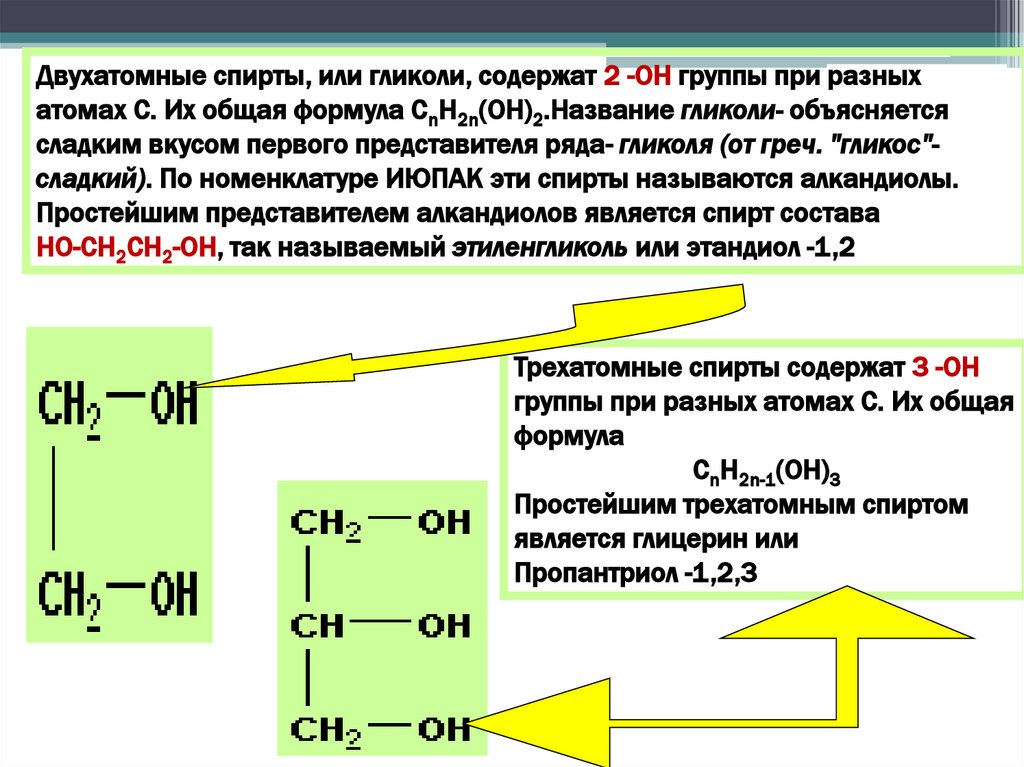
Двухатомные спирты, или гликоли, содержат 2 -ОН группы при разныхатомах С. Их общая формула CnH2n(OH)2.Название гликоли- объясняется
сладким вкусом первого представителя ряда- гликоля (от греч. "гликос"сладкий). По номенклатуре ИЮПАК эти спирты называются алкандиолы.
Простейшим представителем алкандиолов является спирт состава
HO-CH2CH2-OH, так называемый этиленгликоль или этандиол -1,2
Трехатомные спирты содержат 3 -ОН
группы при разных атомах С. Их общая
формула
CnH2n-1(OH)3
Простейшим трехатомным спиртом
является глицерин или
Пропантриол -1,2,3
3.
Получение многоатомных спиртовЭтиленгликоль
получают:1.Гидролизом дигалогенпроизводных
алканов
Cl-СН2-СН2-Cl + 2HOH → ОН-CH2-CH2-OH
+ 2HCl
2. Окислением этилена р-ром КМnO4
СН2=СН2 + О + НОН → ОН-СН2-СН2-ОН
Глицерин
получают:
Омылением жиров
4.
5.
6.
Физические свойства этиленгликоля• Этиленгликоль —
представитель предельных
двухатомных спиртов —
гликолей
• Название гликоли получили
вследствие сладкого вкуса
многих представителей ряда
(греч. «гликос» — сладкий)
• Этиленгликоль сиропообразная жидкость
сладкого вкуса, без запаха,
ядовит. Хорошо смешивается с
водой и спиртом,
гигроскопичен
7.
Применение этиленгликоля• Важным свойством
этиленгликоля является
способность понижать
температуру замерзания
воды, от чего вещество
нашло широкое
применения как
компонент автомобильных
антифризов и
незамерзающих
жидкостей
• Он применяется для
получения лавсана
(ценного синтетического
волокна)
8.
Этиленгликоль – яд !• Дозы вызывающие смертельное отравление
этиленгликолем варьируются в широких пределах - от
100 до 600 мл. Смертельной дозой для человека
является 50-150 мл. Смертность при поражении
этиленгликолем очень высока и составляет более 60%
всех случаев отравления
• Механизм токсического действия этиленгликоля до
настоящего времени изучен недостаточно.
Этиленгликоль быстро всасывается (в том числе через
поры кожи) и в течение нескольких часов циркулирует
в крови в неизмененном виде, достигая максимальной
концентрации через 2-5 часов. Затем его содержание
в крови постепенно снижается, и он фиксируется в
тканях
9.
Физические свойства глицерина• Глицерин – трехатомный
предельный спирт.
• Бесцветная, вязкая,
гигроскопичная, сладкая
на вкус жидкость.
• Смешивается с водой в
любых отношениях ,
неограниченно растворим
в воде.
• Реагирует с азотной
кислотой с образованием
нитроглицерина.
• С карбоновыми кислотами
образует жиры и масла.
• Глицерин в отличие от
этиленгликоля- не ядовит.
CH2 – CH – CH2
OH
OH OH
10.
Применение глицерина• В производстве взрывчатых веществ, в
частности тринитрата глицерина
• При обработке кожи, для
предотвращения от высыхания
• В текстильной промышленности для
придания тканям мягкости и
шелковистости
• Как компонент некоторых клеeв
• При производстве пластмасс в качестве
пластификатора – компонента,
придающего материалу гибкость и
эластичность
• В производстве кондитерских изделий
и напитков (как пищевая добавка E422)
• Широко используется в парфюмерной
промышленности: входит в состав
кремов, помад, зубных паст,
предотвращая их от высыхания и
способствуя увлажнению и смягчению
кожи
• Несмотря на взрывоопасность этого
вещества, в очень малых дозах его
применяют в медицине в качестве
сосудорасширяющего средства при
сердечно-сосудистых заболеваниях
11.
Химические свойства1.Взаимодействие с активными металлами
Na
+ H2 ↑
+ 2Na→
Na
Этиленгликолят натрия
2.Взаимодействие с галогеноводородами
Cl
+ 2HCl→
+ 2H2O
Cl
1,2-дихлорэтан
12.
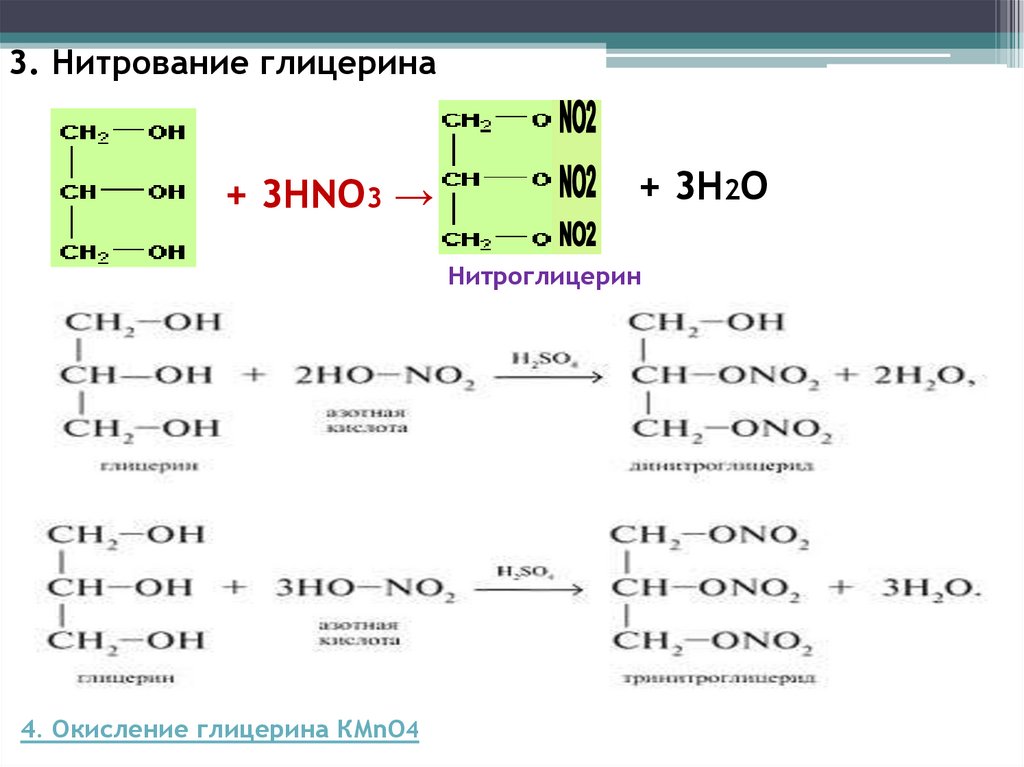
3. Нитрование глицерина+ 3НNО3 →
+ 3Н2О
Нитроглицерин
4. Окисление глицерина КMnO4
13.
Реакции окисления• Двухатомный спирт – этиленгликоль- при
нагревании в кислой среде с раствором
КМnO4или K2Cr2O7 легко окисляется до
щавелевой кислоты, а в нейтральной до
оксолата калия:
СН2(ОН) - СН2(ОН) + KMnO4 + H2SO4 HOOC - COOH + MnSO4 + K2SO4+ H2O
СН2(ОН) - СН2(ОН) + KMnO4 KOOC - COOK + MnO2 + KOH + H2O
• Расставьте коэффициенты!
14.
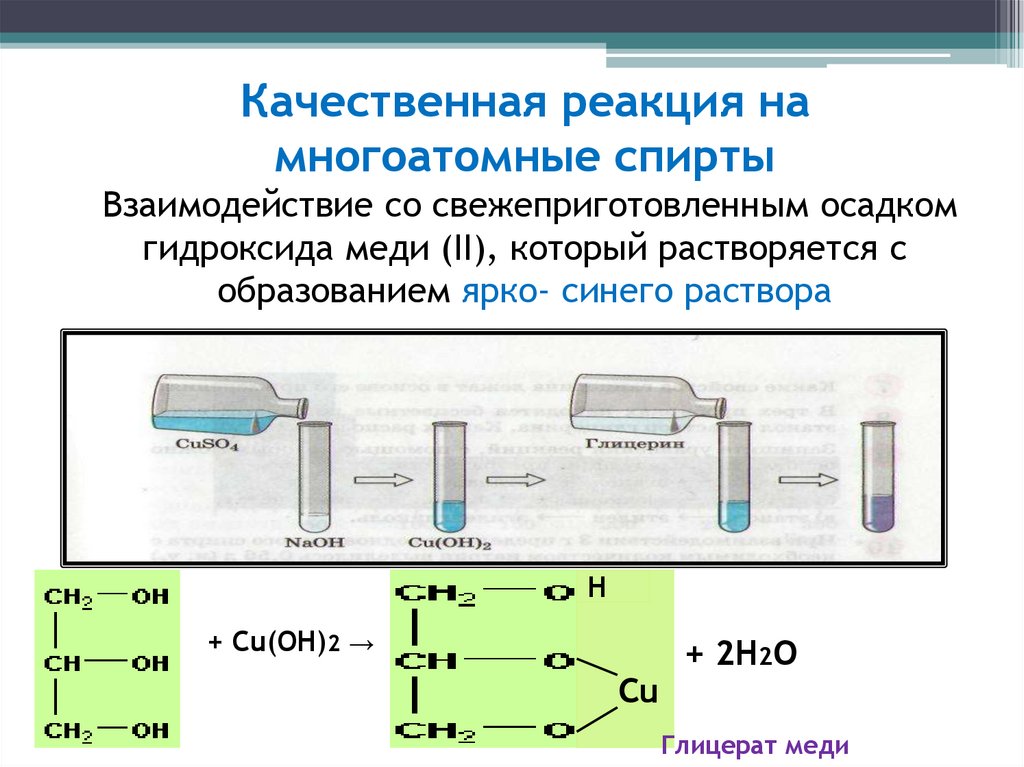
Качественная реакция намногоатомные спирты
Взаимодействие со свежеприготовленным осадком
гидроксида меди (II), который растворяется с
образованием ярко- синего раствора
Н
+ Cu(OH)2 →
Сu
+ 2Н2О
Глицерат меди
15.
1.Какова общая формула одноатомных спиртов ?а)CnH2n+2 ОН
б)CnH2n-2 О
в)CnH2n+1 О
г)CnH2n+1 ОН
2.Каково правильное название спирта со следующим структурным
строением ?
CH3-CH2-CH-CH2-OH
|
C2H5
а) 3-этилбутанол-1
б) 3-этилбутанол-4
в) 2-этилбутанол-1
г) 2-этанбутанол
3.Как называется группа -OH ?
а) гидрин
б) гидроксил
в) гидратол
г) гидротин
16.
4. Какие соединения образуются при дегидратации спиртов?а) алканы
в) алкадиены
г) алкины
б) алкены
5. Укажите Ме, с которым реагирует этанол
а) свинец в) медь
б) железо г)натрий
6. Молярная масса предельного одноатомного спирта,
содержащего 4ат.С, равна:
а) 46г/моль
б) 54г/моль
в) 60г/моль
г) 74г/моль
7. Массовая доля углерода в молекуле пропилового спирта равна
в %?
а)48 б)60 в)62 г)54
17.
8. Простой эфир, образованный при нагревании пропилового ибутилового спирта:
а) диэтиловый
б) этилпропиловый
в) этилбутиловый
г) пропилбутиловый
9.При гидролизе дихлорэтана массой 247г образуется
этиленгликоль массой (г):
а)155
б)162
в) 136
г)112
10. Качественной реакцией на многоатомные спирты является
взаимодействие их с:
а) серной кислотой
б) азотной кислотой
в) одноатомными спиртами
г) гидроксидом меди(II)















 chemistry
chemistry








