Similar presentations:
Многоатомные спирты
1.
2. Цели урока.
Закрепить полученные знания ободноатомных спиртах.
Сформировать представления о
многоатомных спиртах.
Найти в общем частное, в частном
общее.
Соблюдать правила ТБ при работе
с реактивами.
3. Вопросы для повторения
Какие соединения называютсяодноатомными предельными
спиртами? Приведите примеры.
Какими способами могут быть
получены спирты?
4. Вопросы для повторения
Где применяют метиловый иэтиловый спирты?
Какое физиологическое действие
оказывает этанол на организм
человека?
5.
Многоатомными спиртаминазывают производные предельных
углеводородов, в молекулах которых два или
несколько атомов водорода замещены на
гидроксильную группу.
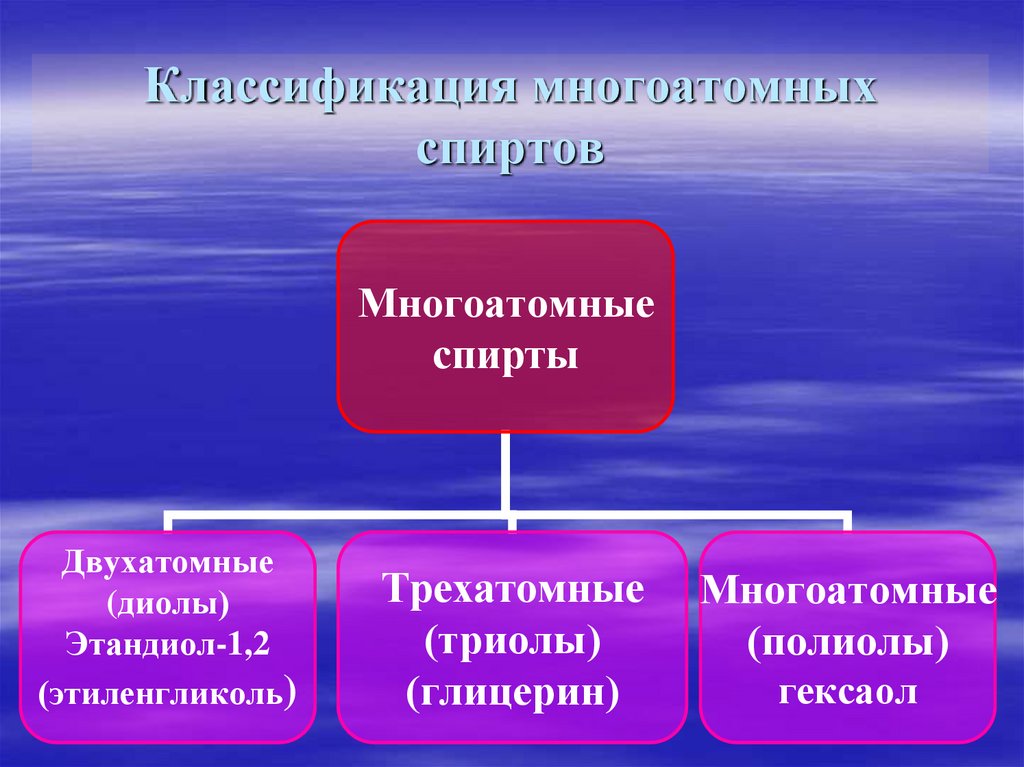
6. Классификация многоатомных спиртов
Многоатомныеспирты
Двухатомные
(диолы)
Этандиол-1,2
(этиленгликоль)
Трехатомные
(триолы)
(глицерин)
Многоатомные
(полиолы)
гексаол
7. Структурные формулы
СН2 – СН2ОН
ОН
Этандиол-1,2
(этиленгликоль)
СН2 – СН – СН2
ОН
ОН ОН
Пропантриол-1,2,3
(глицерин)
8. Физические свойства глицерина
Бесцветная, прозрачная, вязкая,сиропообразная жидкость,
сладкая на вкус.
не ядовит
t кип= 2900 С
Неограниченно растворим в воде,
очень гигроскопичен
9. Физические свойства этиленгликоля
Бесцветная вязкая жидкость сосвоеобразным запахом, сладкого
вкуса, ядовит.
t кип = 1980 С
С водой смешивается в любых
соотношениях, причем эти
растворы имеют очень низкую
температуру замерзания.
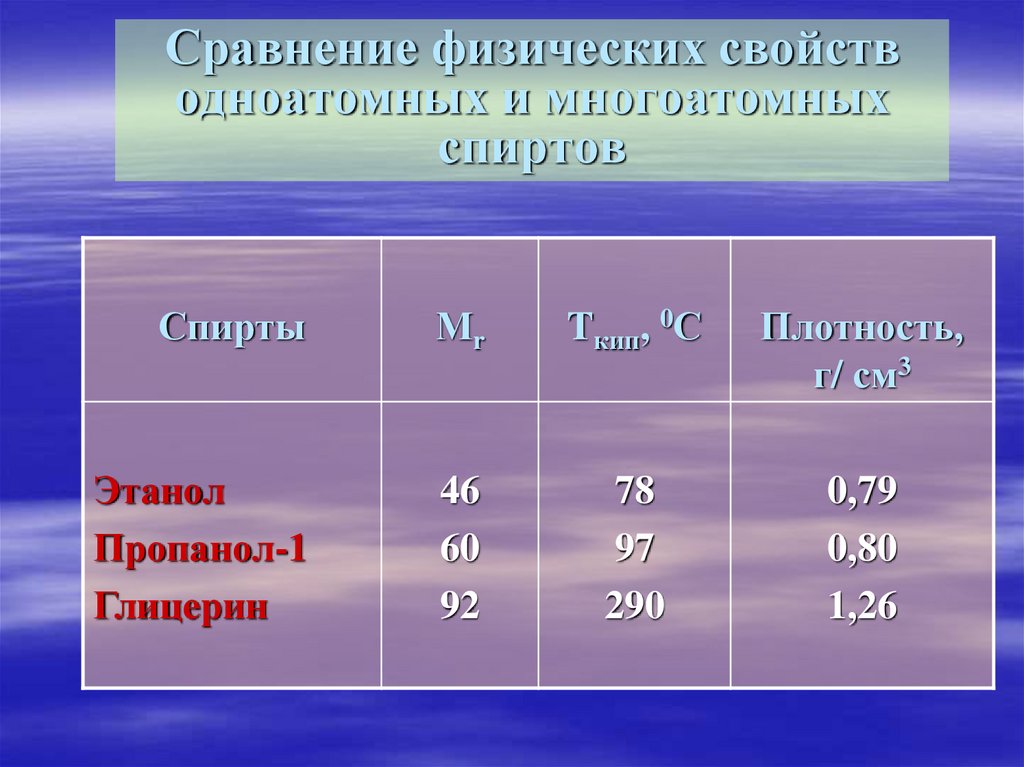
10. Сравнение физических свойств одноатомных и многоатомных спиртов
СпиртыМr
Tкип, 0С
Плотность,
г/ см3
Этанол
Пропанол-1
Глицерин
46
60
92
78
97
290
0,79
0,80
1,26
11. Получение
Этиленгликоль (этандиол-1,2) синтезируютиз этилена различными способами
3CH2=CH2 + 2KMnO4 + 4H2O 3HO–CH2–CH2–OH +
2MnO2 + 2KOH
Глицерин (пропантриол -1,2,3) получают
гидролизом
жиров или из пропилена
12.
Химические свойствамногоатомных спиртов
Химические
свойства
КИСЛОТНЫЕ
СВОЙСТВА
РЕАКЦИИ
ЗАМЕЩЕНИЯ
РЕАКЦИИ со :
щелочными
металлами
РЕАКЦИИ с :
галогеноводородами;
этерификации
РЕАКЦИИ
ОКИСЛЕНИЯ
РЕАКЦИИ:
горения,
окисления
КАЧЕСТВЕННАЯ
РЕАКЦИЯ
РЕАКЦИЯ с
Cu(OH)2
13.
1.Взаимодействие с активными металлами:СН2 –
СН2 – О Na
ОН
+ 2Na→
СН2 –
ОН
СН2 – О Na
+ H2↑
Этиленгликолят натрия
2.Взаимодействие с галогеноводородами:
СН2 –
СН2 – О Cl
ОН
+ 2H2O
+ 2HCl→
СН2 –
ОН
СН2 – О Cl
1,2-дихлорэтан
14.
Взаимодействие глицерина с азотной кислотойСН2 –
ОН
HONO2
СН –
ОН
+HONО2
СН2 –
ОН
HONO2
СН2– О -NO2
СН – О -NO2 + 3 H2O
СН2– О -NO2
нитроглицерин
15.
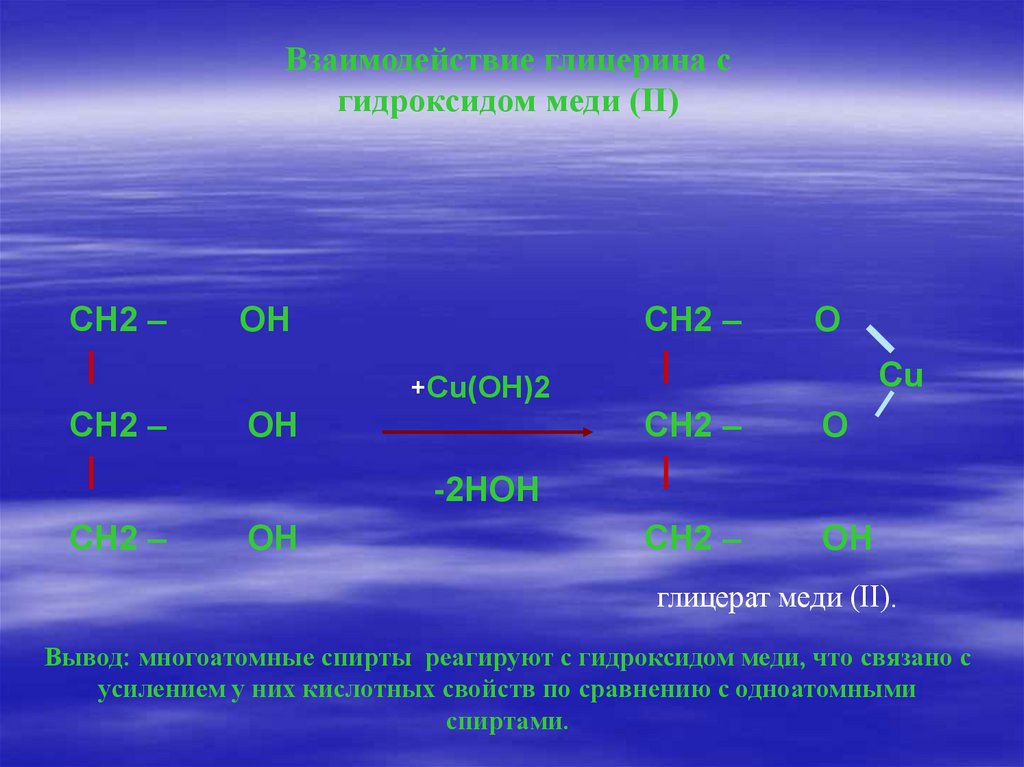
Взаимодействие глицерина сгидроксидом меди (II)
СН2 –
ОН
СН2 –
О
Cu
+Cu(OH)2
СН2 –
ОН
СН2 –
О
СН2 –
ОН
-2НOH
СН2 –
ОН
глицерат меди (II).
Вывод: многоатомные спирты реагируют с гидроксидом меди, что связано с
усилением у них кислотных свойств по сравнению с одноатомными
спиртами.
16.
Лабораторный опытКачественная реакция на многоатомные спирты
К свежеприготовленному
осадку гидроксида меди
приливаем раствор глицерина.
Осадок гидроксида меди
растворяется и образуется
темно-синий раствор
глицерата меди (II).
17. Применение этиленгликоля
Антифризы – незамерзающие жидкостиСинтетическое волокно лавсан
Пластиковые бутылки
18. Применение глицерина
КремаНитроглицерин
Изделия из кожи
Пластмассовые изделия
Мыло
Кондитерские изделия
19.
Ксилит – пятиатомный спирт20. Н. Н. Зинин Альфред Нобель
21. Выводы
Во всех многоатомных спиртах гидроксильныегруппы находятся при разных атомах углерода;
число гидроксогрупп влияет на физические
свойства спирта (за счет водородных связей);
свойства, общие с одноатомными спиртами,
объясняются наличием функциональной
группы ОН;
число гидроксильных групп в молекуле
обусловило, в результате их взаимного влияния,
появление у многоатомных спиртов новых
свойств по сравнению с одноатомными
спиртами (к примеру – взаимодействие с
нерастворимыми основаниями).



















 chemistry
chemistry








