Similar presentations:
Водородные соединения неметаллов
1.
Водородные соединениянеметаллов
2.
План урока• Опрос домашнего задания:
- фронтальная беседа по вопросам.
• Изучение нового материала:
- состав водородных соединений неметаллов;
- строение летучих соединений неметаллов;
- свойства водородных соединений;
- получение водородных соединений.
3.
Цель урока:• Обобщить и углубить знания о летучих
водородных соединениях неметаллов.
Задачи:
• Уметь определять состав и строение
водородных соединений неметаллов.
• Определять тип связи, вид
кристаллической решетки.
• Описывать свойства соединений и
способы получения.
4.
Вопросы фронтальной беседы.1.Какое место в ПС занимают НеМе?
2.Как изменяются свойства НеМе в ПС с точки зрения
электронного строения?
3.Как изменяется электроотрицательность НеМе в группе
и в периоде?
4.Какое строение имеют молекулы НеМе?
5.Какие соединения образуют НеМе?
6.Укажите как изменяются свойства оксидов и кислот в
периодах и группах.
7.Как изменяются свойства водородных соединений в
ПС?
5.
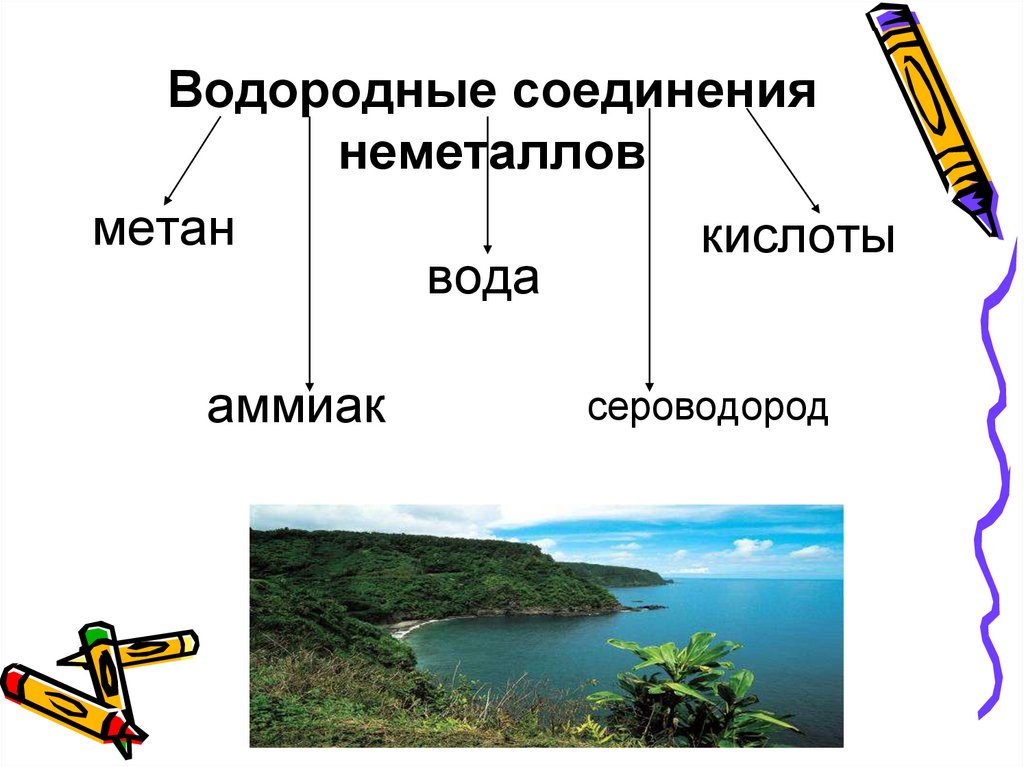
Водородные соединениянеметаллов
метан
кислоты
вода
аммиак
сероводород
6.
МетанГаз без цвета и запаха, малорастворим в воде,
легче воздуха, горит бледным синеватым пламенем.
Смесь метана с воздухом взрывоопасна!
7.
АммиакБесцветный газ с резким характерным запахом,
почти в два раза легче воздуха, легко сжижается,
очень хорошо растворим в воде.
Газообразный аммиак при содержании 0,05% в воздухе
очень сильно раздражает слизистые оболочки глаз и
дыхательных путей.
8.
ВодаСамое распространенное на Земле соединение.
Существует в трех агрегатных состояниях:
твердое – лед, жидкое – вода, газообразное – пар.
Без вкуса, без цвета, без запаха.
Вода – основа жизни на Земле!
9.
СероводородБесцветный газ с характерным неприятным запахом,
тяжелее воздуха, малорастворим в воде. В смеси с
воздухом взрывоопасен.
Сероводород ядовит! При вдыхании сероводорода
может наступить обморочное состояние или даже
смерть от паралича дыхания.
10.
КислотыЭлектролиты, образующие при диссоциации
катионы водорода.
Растворы кислот имеют кислый вкус.
Соляная кислота содержится в желудочном соке и
способствует перевариванию пищи, а также убивает
различные болезнетворные бактерии. Однако, при
повышенном содержании соляной кислоты в желудке
ощущается изжога.
11.
Состав и строениеводородных соединений
неметаллов
RH4, RH3, RH2, RH
В периоде кислотные свойства водных
растворов л.в.с. увеличиваются.
В группах кислотные свойства водных
растворов тоже увеличиваются.
12.
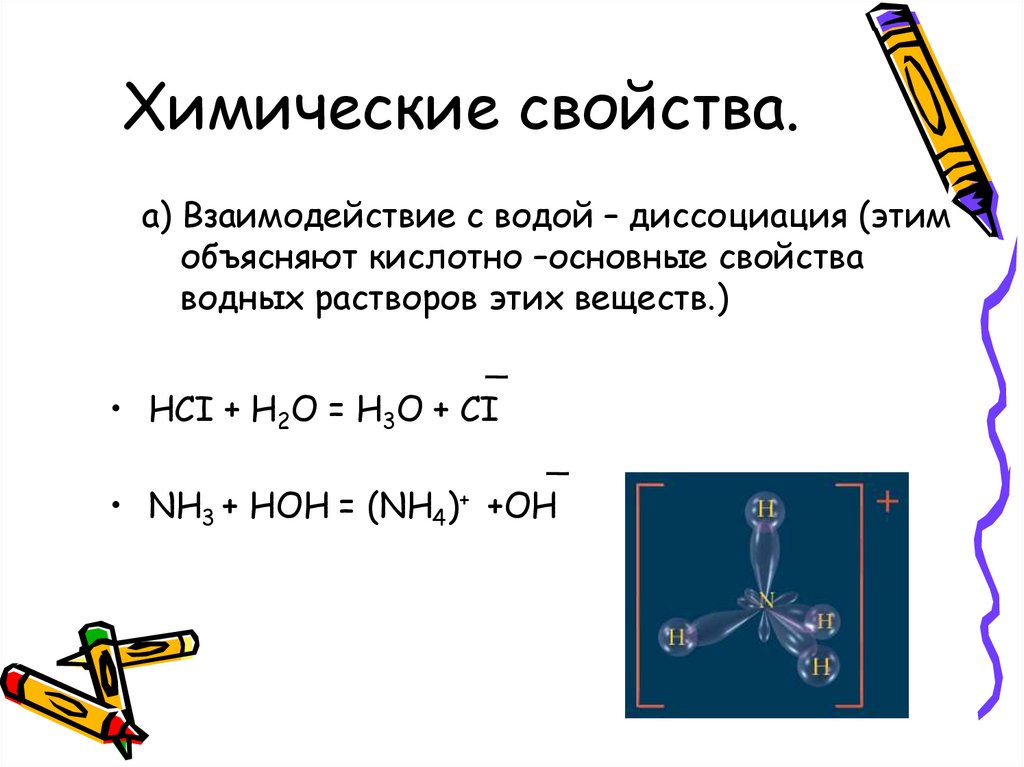
Химические свойства.а) Взаимодействие с водой – диссоциация (этим
объясняют кислотно –основные свойства
водных растворов этих веществ.)
_
• HCI + H2O = H3O + CI
_
• NH3 + HOH = (NH4)+ +OH
13.
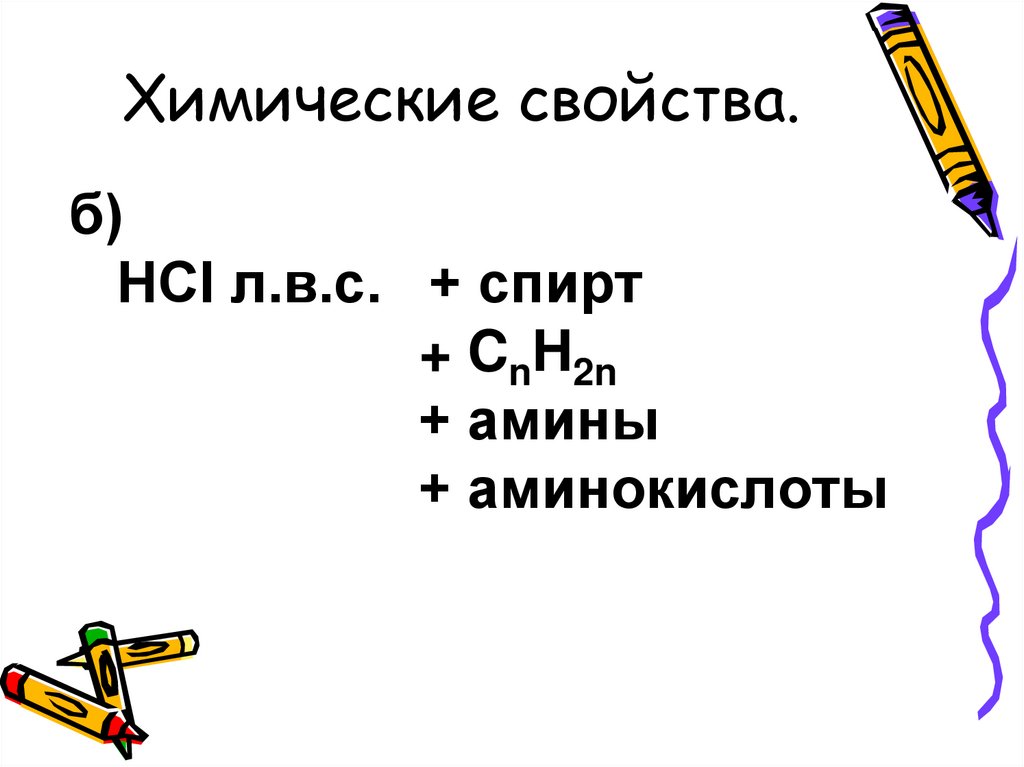
Химические свойства.б)
HCI л.в.с. + спирт
+ CnH2n
+ амины
+ аминокислоты
14.
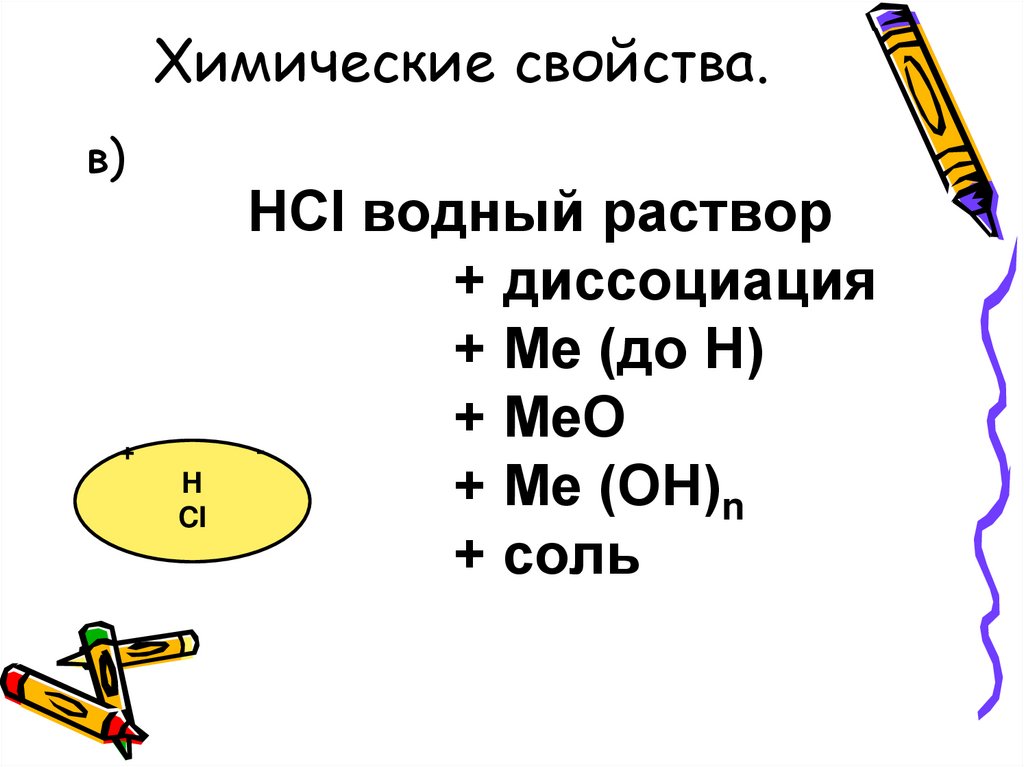
Химические свойства.в)
+
H
CI
HCI водный раствор
+ диссоциация
+ Ме (до Н)
+
МеО
+ Ме (ОН)n
+ соль
15.
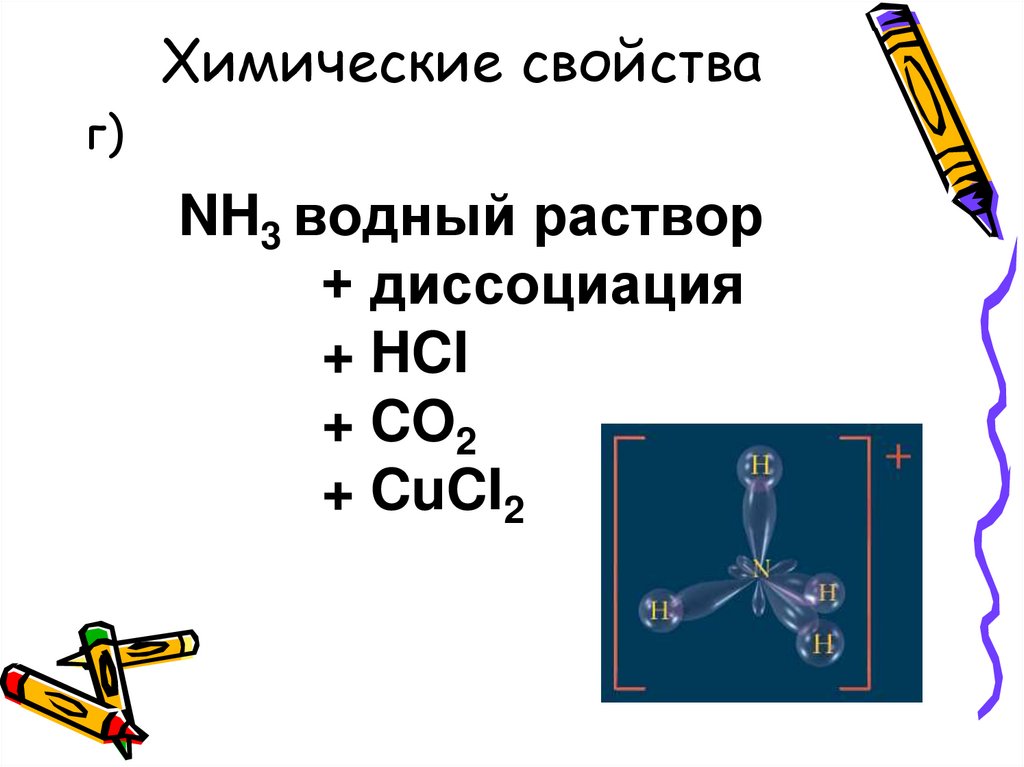
Химические свойстваг)
NH3 водный раствор
+ диссоциация
+ HCI
+ CO2
+ CuCI2
16.
Химические свойства• Другие свойства водородных соединений
NH3 + O2 = N2 + H2O
NH3 + O2 = NO + H2O
H2S + O2 = SO2 + H2O
• Особые свойства CH4.
17.
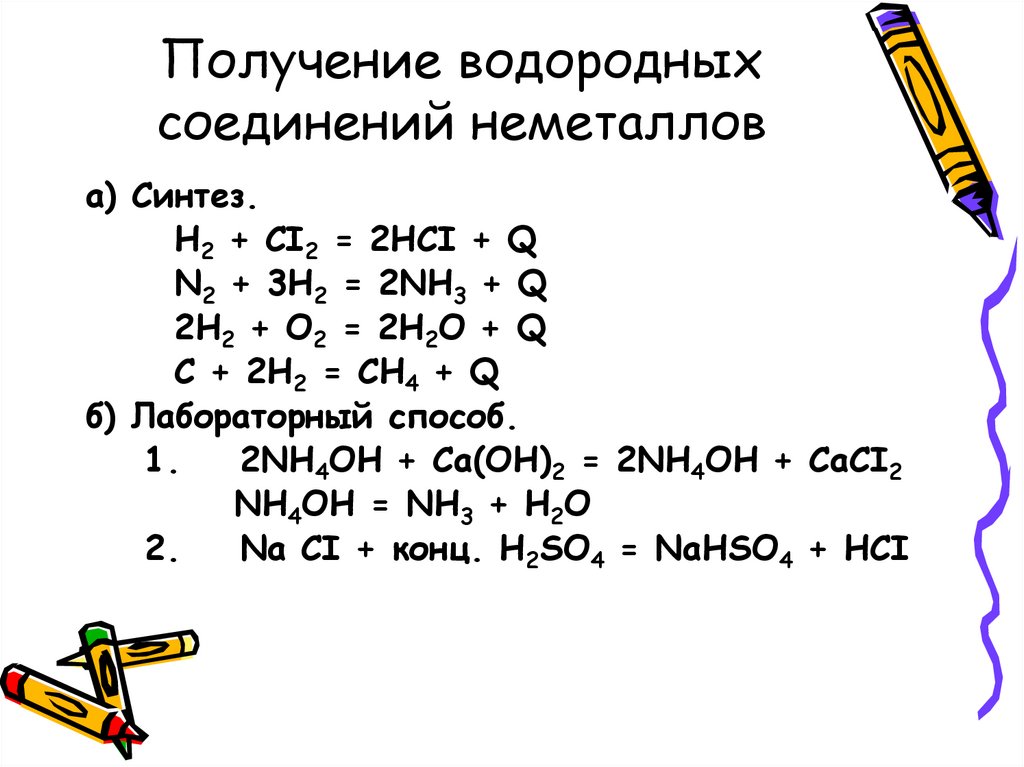
Получение водородныхсоединений неметаллов
а) Синтез.
H2 + CI2 = 2HCI + Q
N2 + 3H2 = 2NH3 + Q
2H2 + O2 = 2H2O + Q
C + 2H2 = CH4 + Q
б) Лабораторный способ.
1.
2NH4OH + Ca(OH)2 = 2NH4OH + CaCI2
NH4OH = NH3 + H2O
2.
Na CI + конц. H2SO4 = NaHSO4 + HCI
18.
Закрепление темыЗапишите уравнения этих реакций с точки
зрения процессов окисления и восстановления:
( составить окислительно- восстановительный баланс.
Уравнять коэффициенты и указать сумму коэффициентов в
уравнении)
CH4 + O2 → CO2 + H2O
Cl2 + H2O → HCl + HClO
S + HNO3 → H2SO4 + NO2 + H2O












 chemistry
chemistry








