Similar presentations:
Фармацевтическая химия (лекция 4)
1. ФАРМАЦЕВТИЧЕСКАЯ ХИМИЯ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧЕРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ«БЕЛГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ УНИВЕРСИТЕТ» (НИУ «БелГУ»)
ИНСТИТУТ ФАРМАЦИИ, ХИМИИ И БИОЛОГИИ
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ТЕХНОЛОГИИ
ФАРМАЦЕВТИЧЕСКАЯ ХИМИЯ
Лекция 4
доцент кафедры ФТ, к.фарм.н.
Анастасия Юрьевна Малютина
Белгород
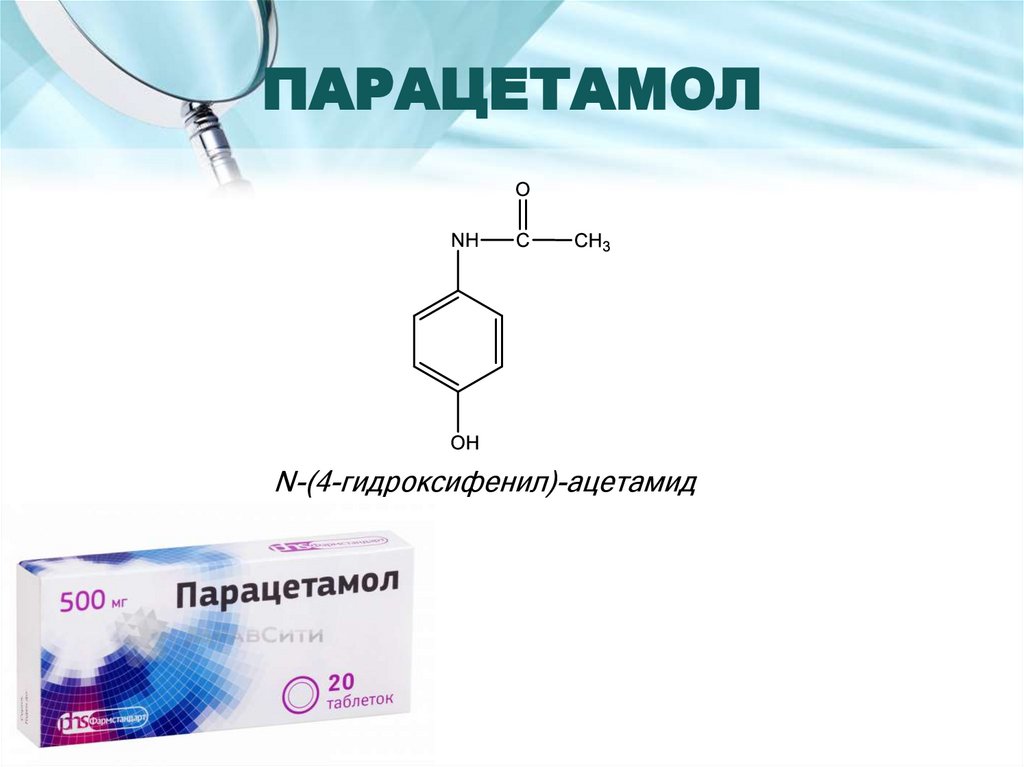
2. ПАРАЦЕТАМОЛ
N-(4-гидроксифенил)-ацетамид3.
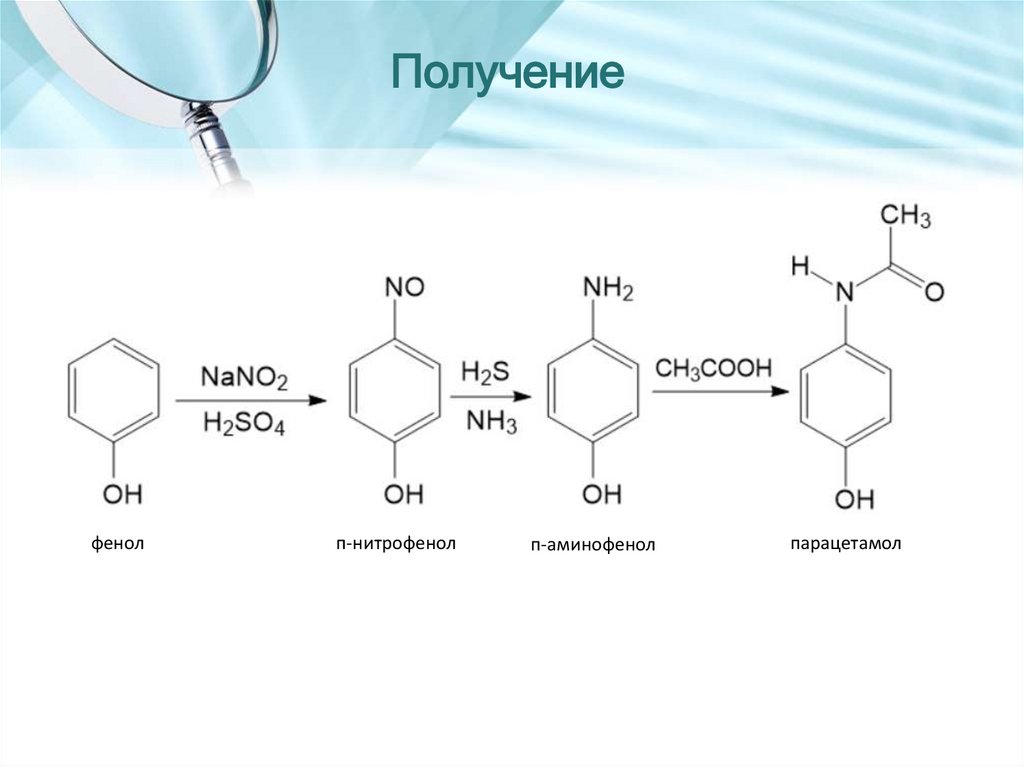
Получениефенол
п-нитрофенол
п-аминофенол
парацетамол
4.
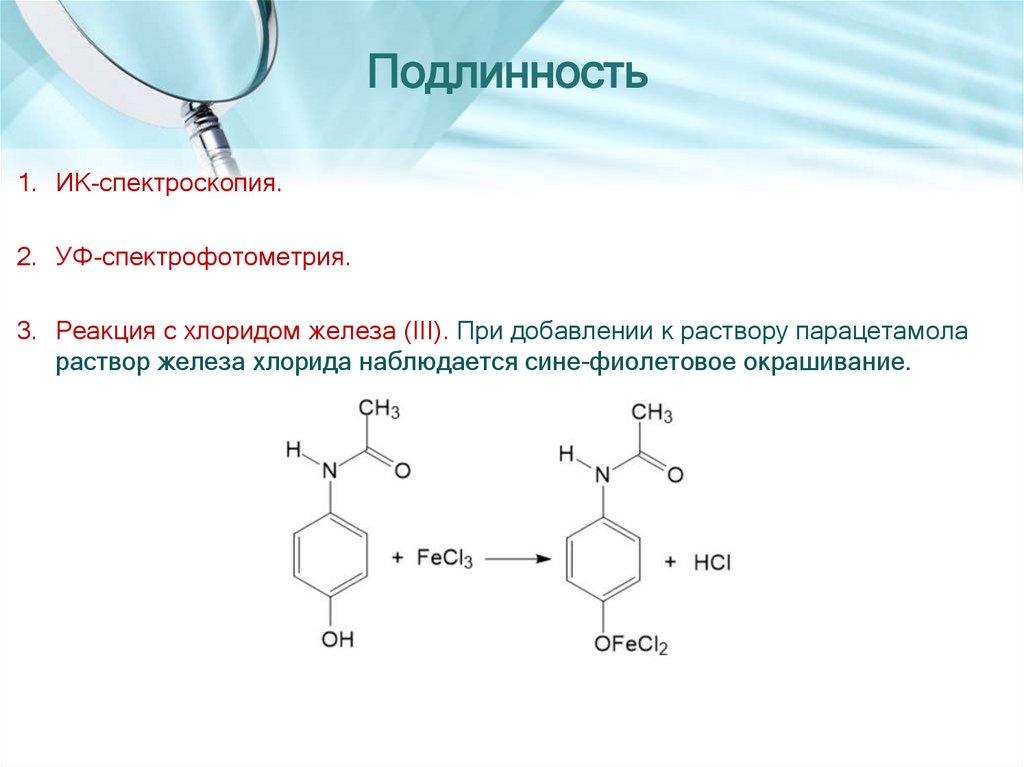
Подлинность1. ИК-спектроскопия.
2. УФ-спектрофотометрия.
3. Реакция с хлоридом железа (III). При добавлении к раствору парацетамола
раствор железа хлорида наблюдается сине-фиолетовое окрашивание.
5.
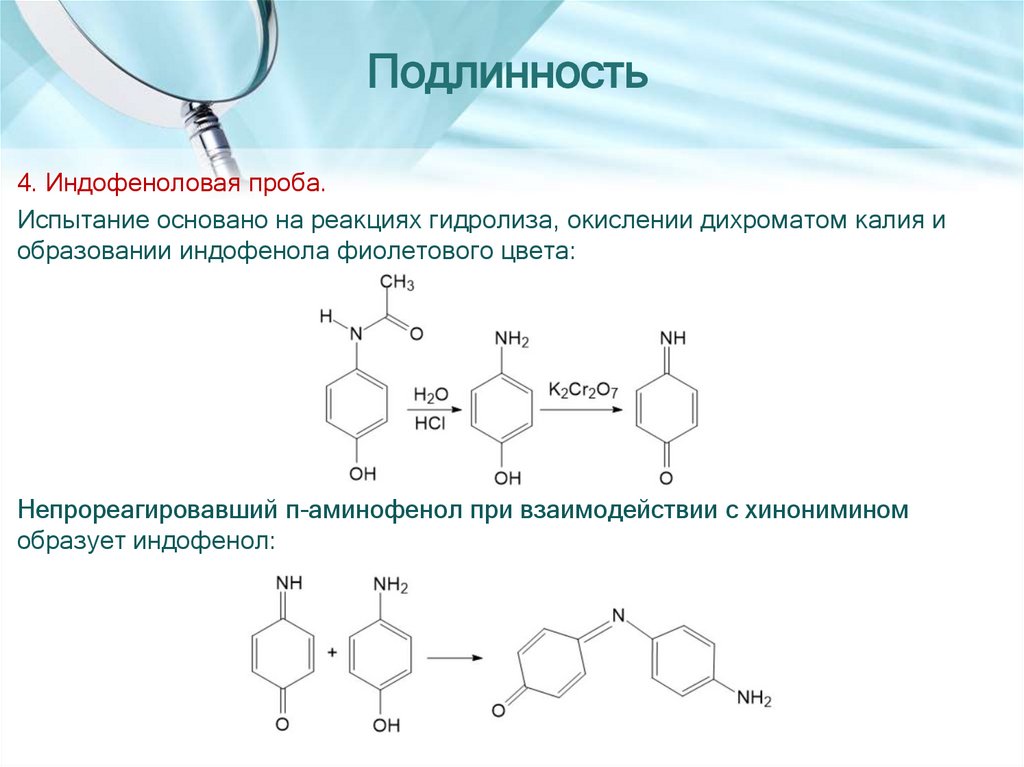
Подлинность4. Индофеноловая проба.
Испытание основано на реакциях гидролиза, окислении дихроматом калия и
образовании индофенола фиолетового цвета:
Непрореагировавший п-аминофенол при взаимодействии с хинонимином
образует индофенол:
6.
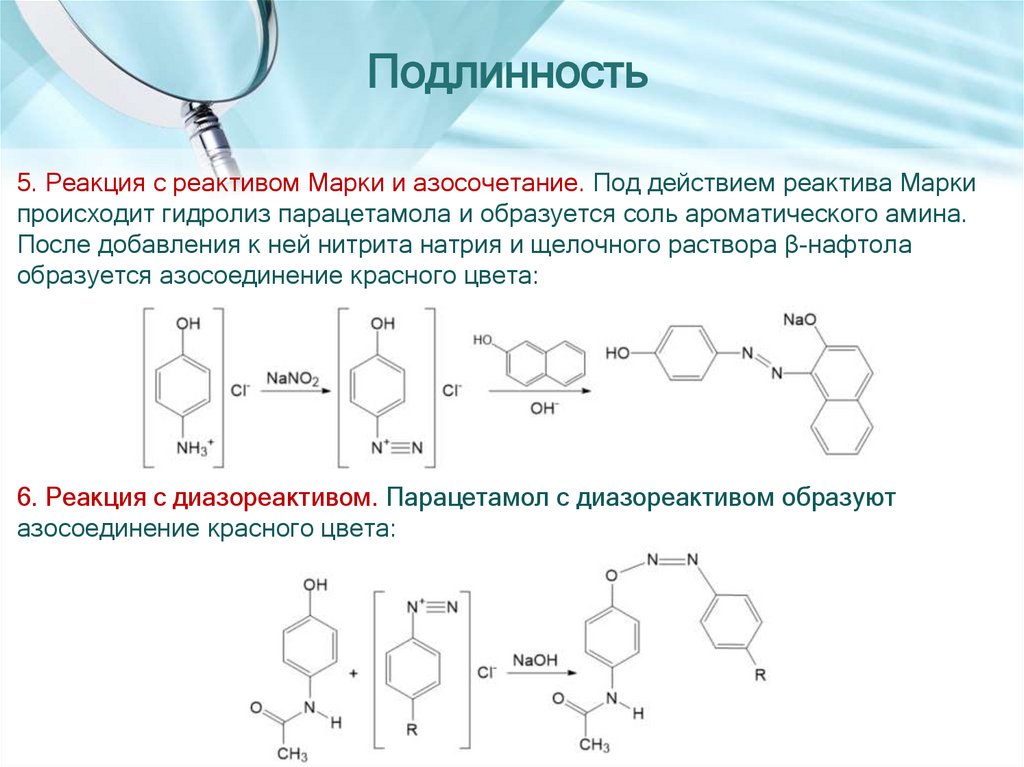
Подлинность5. Реакция с реактивом Марки и азосочетание. Под действием реактива Марки
происходит гидролиз парацетамола и образуется соль ароматического амина.
После добавления к ней нитрита натрия и щелочного раствора β-нафтола
образуется азосоединение красного цвета:
6. Реакция с диазореактивом. Парацетамол с диазореактивом образуют
азосоединение красного цвета:
7.
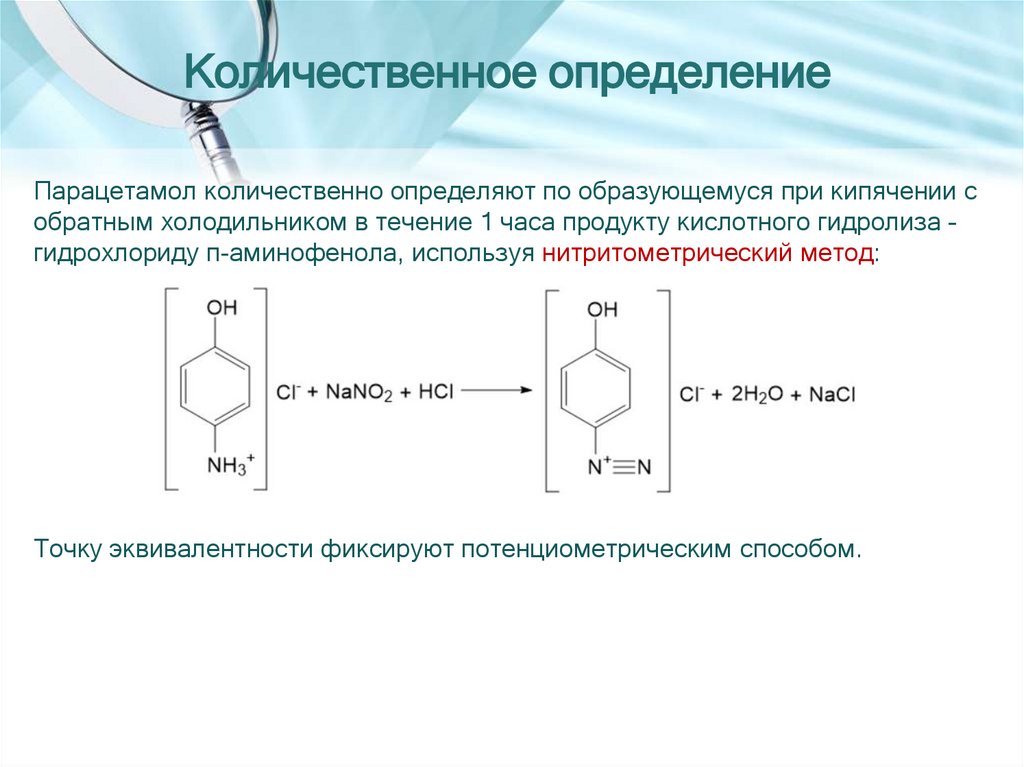
Количественное определениеПарацетамол количественно определяют по образующемуся при кипячении с
обратным холодильником в течение 1 часа продукту кислотного гидролиза –
гидрохлориду п-аминофенола, используя нитритометрический метод:
Точку эквивалентности фиксируют потенциометрическим способом.
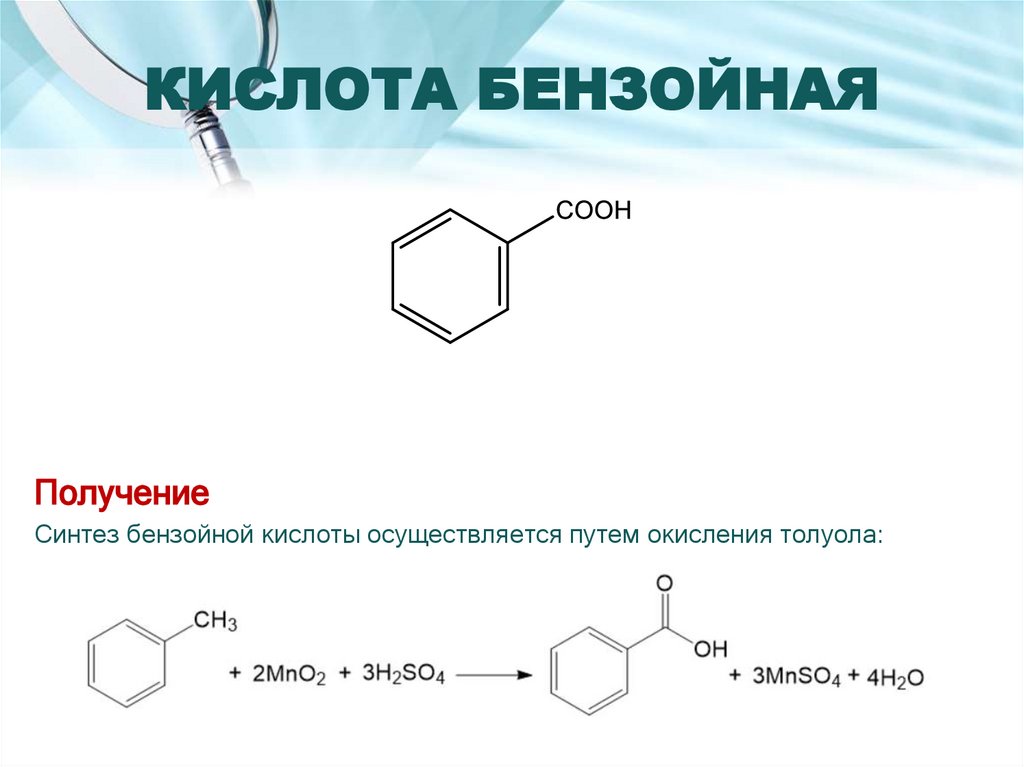
8. КИСЛОТА БЕНЗОЙНАЯ
ПолучениеСинтез бензойной кислоты осуществляется путем окисления толуола:
9. КИСЛОТА БЕНЗОЙНАЯ
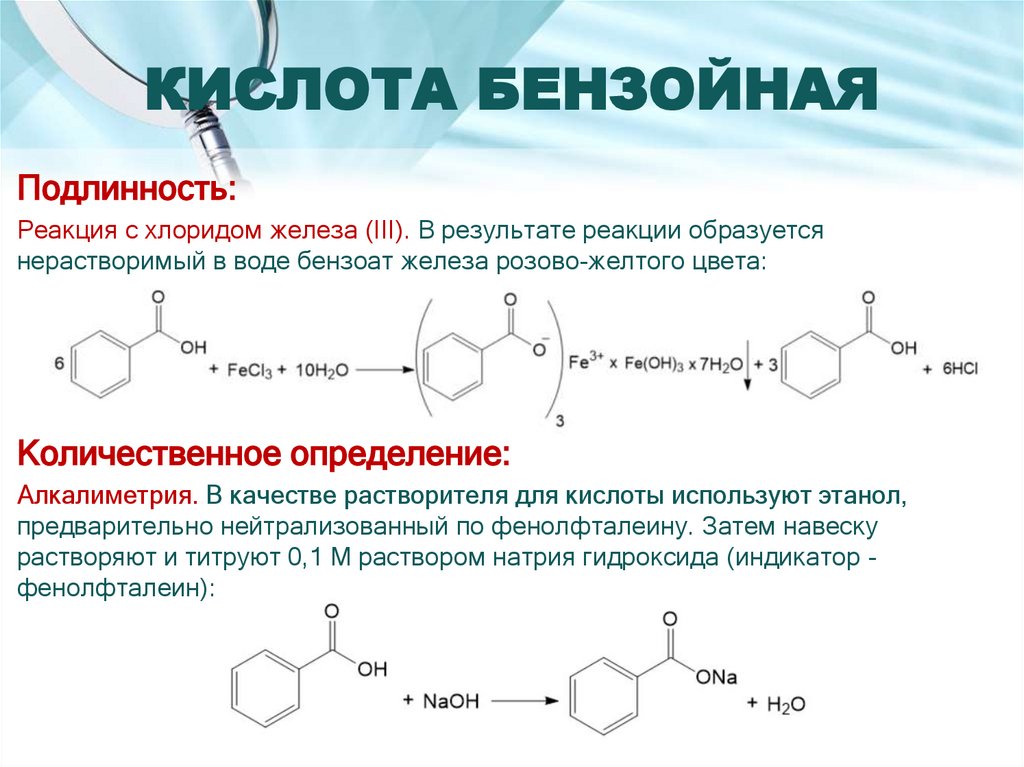
Подлинность:Реакция с хлоридом железа (III). В результате реакции образуется
нерастворимый в воде бензоат железа розово-желтого цвета:
Количественное определение:
Алкалиметрия. В качестве растворителя для кислоты используют этанол,
предварительно нейтрализованный по фенолфталеину. Затем навеску
растворяют и титруют 0,1 М раствором натрия гидроксида (индикатор фенолфталеин):
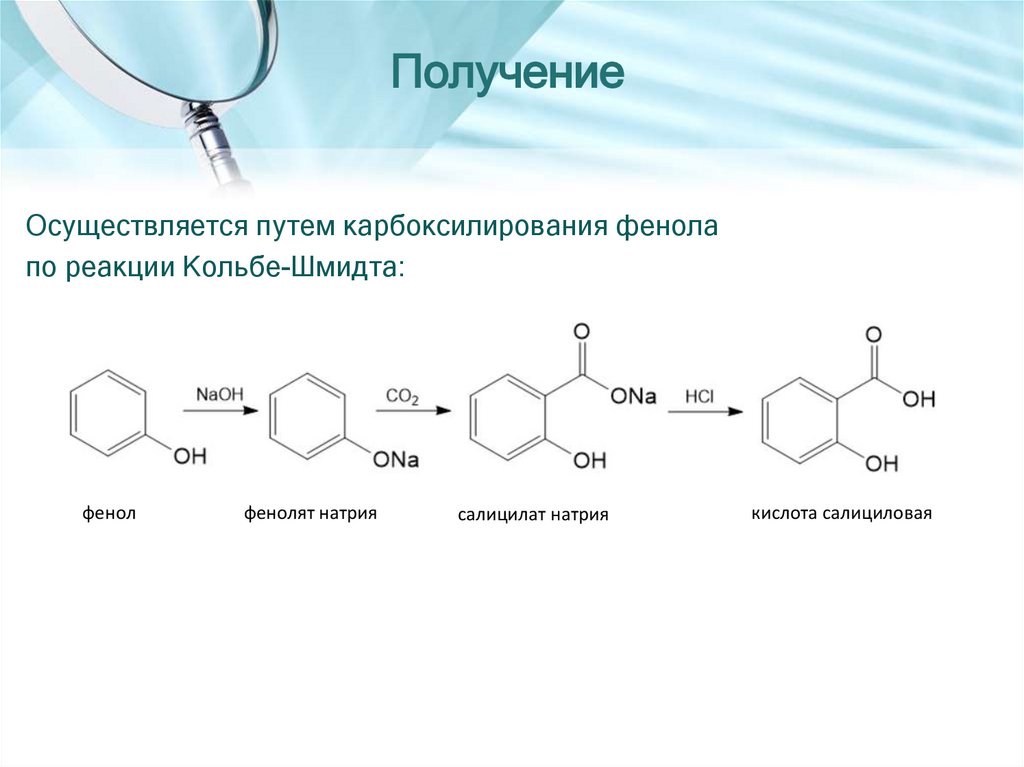
10. КИСЛОТА САЛИЦИЛОВАЯ
2-гидроксибензойная кислота11.
ПолучениеОсуществляется путем карбоксилирования фенола
по реакции Кольбе-Шмидта:
фенол
фенолят натрия
салицилат натрия
кислота салициловая
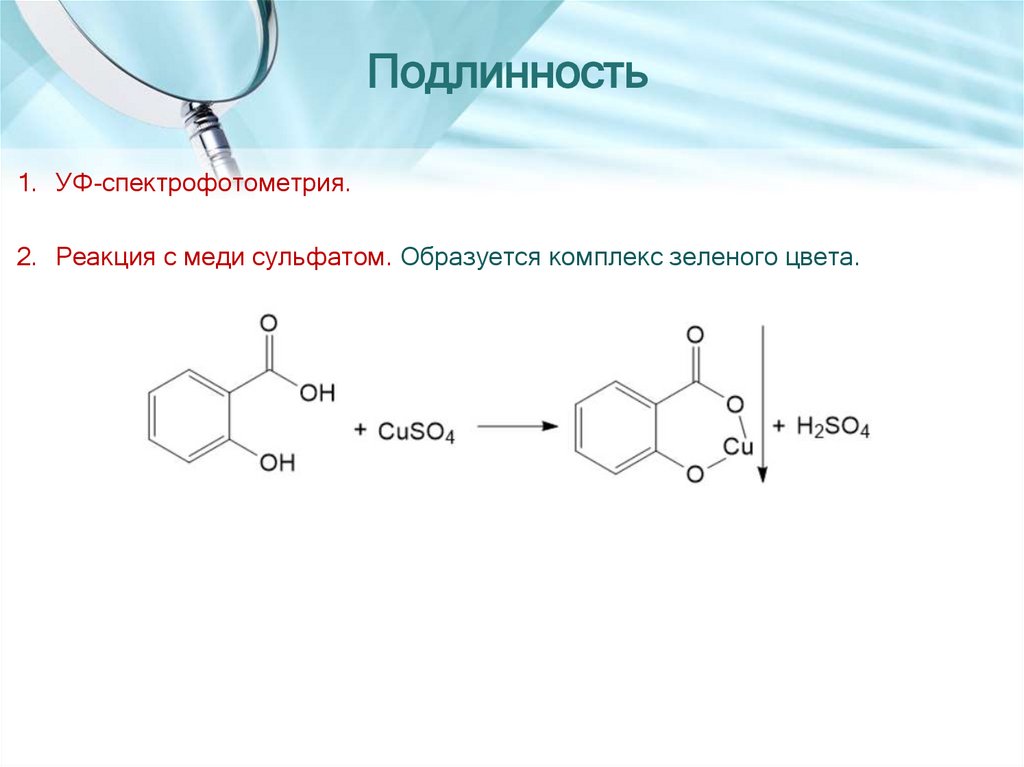
12.
Подлинность1. УФ-спектрофотометрия.
2. Реакция с меди сульфатом. Образуется комплекс зеленого цвета.
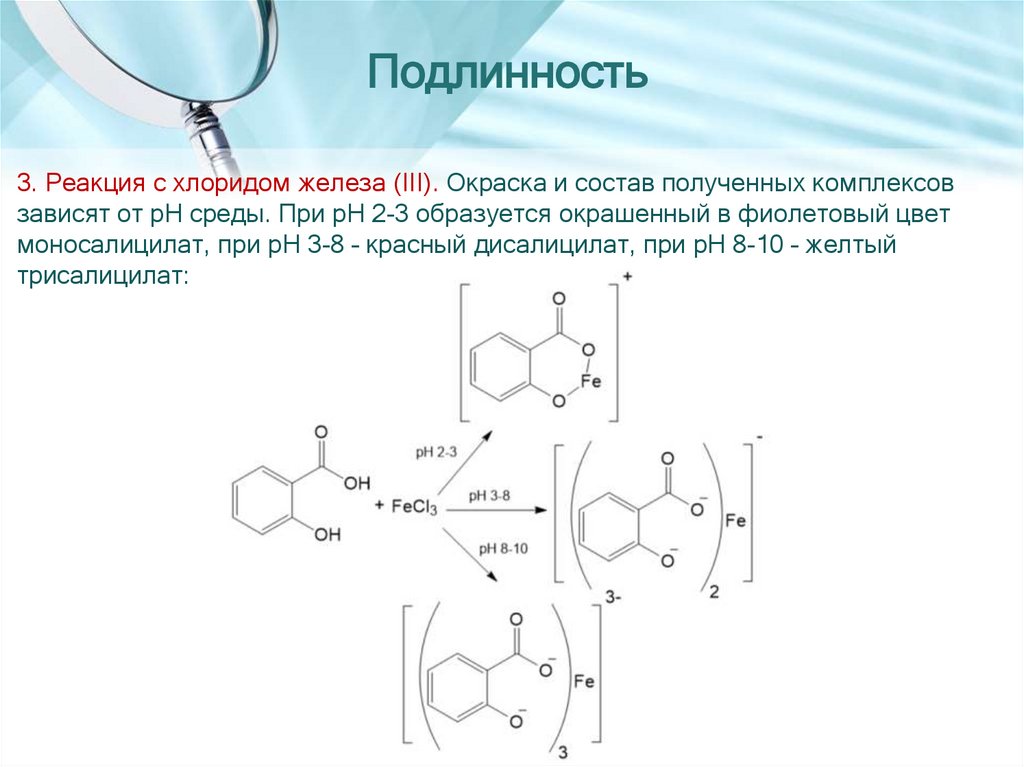
13.
Подлинность3. Реакция с хлоридом железа (III). Окраска и состав полученных комплексов
зависят от pH среды. При pH 2-3 образуется окрашенный в фиолетовый цвет
моносалицилат, при pH 3-8 – красный дисалицилат, при pH 8-10 – желтый
трисалицилат:
14.
Количественное определениеАлкалиметрия
В качестве растворителя для кислоты используют этанол, предварительно
нейтрализованный по фенолфталеину. Затем навеску растворяют и титруют
0,1 М раствором натрия гидроксида (индикатор - фенолфталеин):
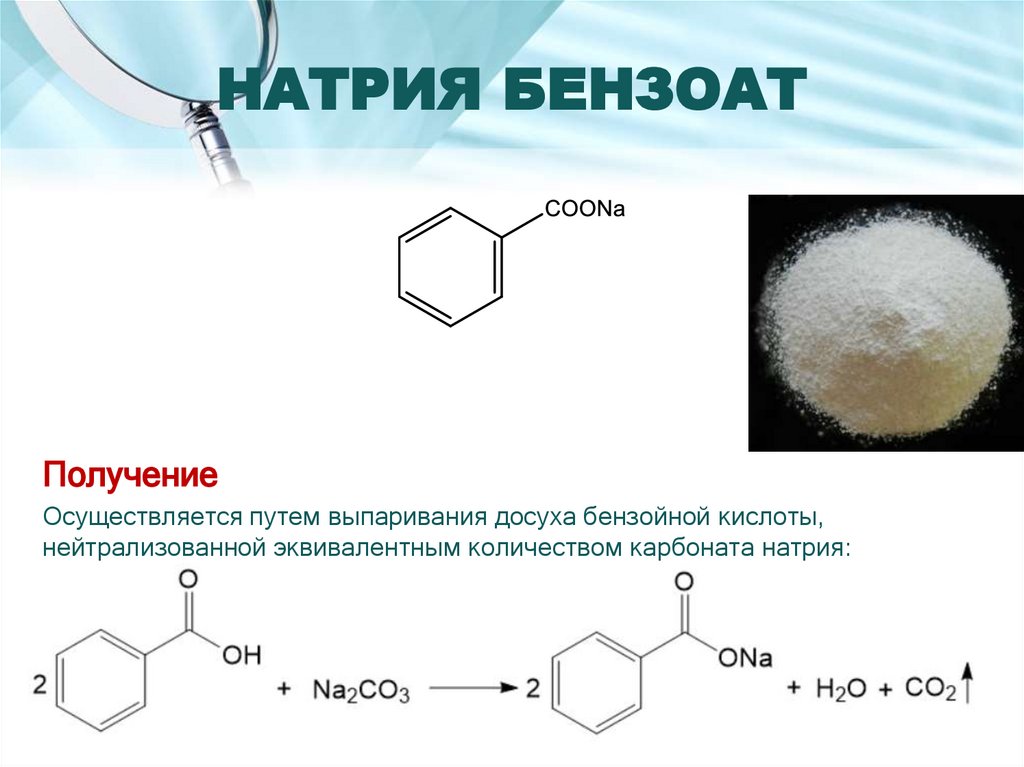
15. НАТРИЯ БЕНЗОАТ
ПолучениеОсуществляется путем выпаривания досуха бензойной кислоты,
нейтрализованной эквивалентным количеством карбоната натрия:
16.
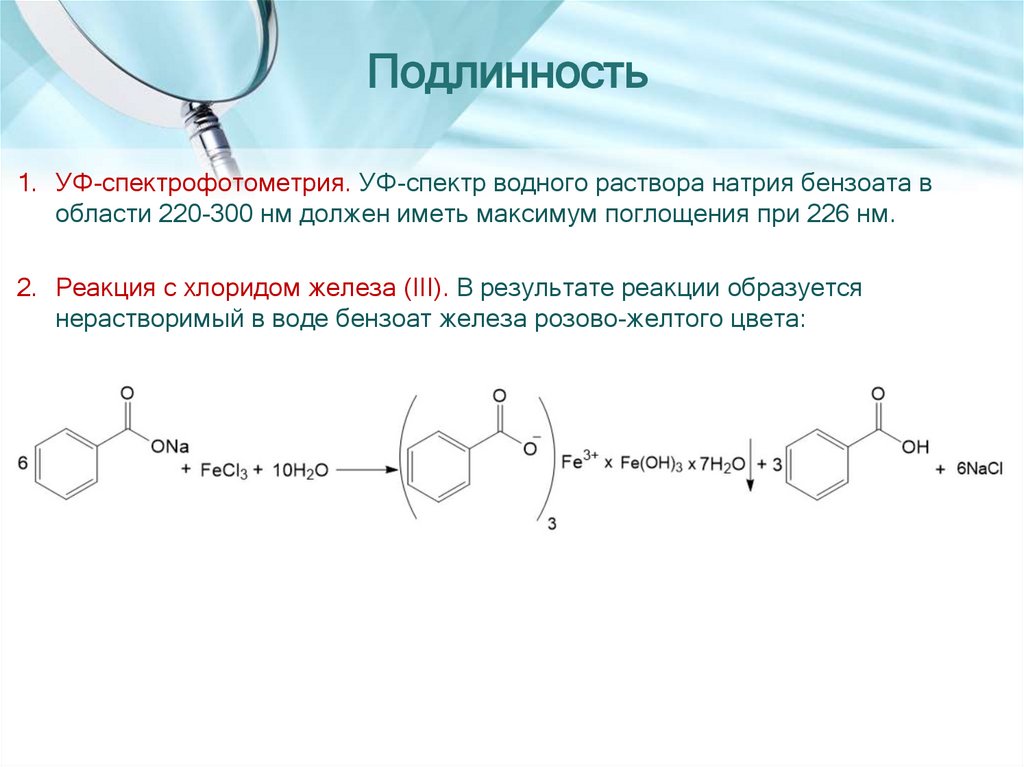
Подлинность1. УФ-спектрофотометрия. УФ-спектр водного раствора натрия бензоата в
области 220-300 нм должен иметь максимум поглощения при 226 нм.
2. Реакция с хлоридом железа (III). В результате реакции образуется
нерастворимый в воде бензоат железа розово-желтого цвета:
17.
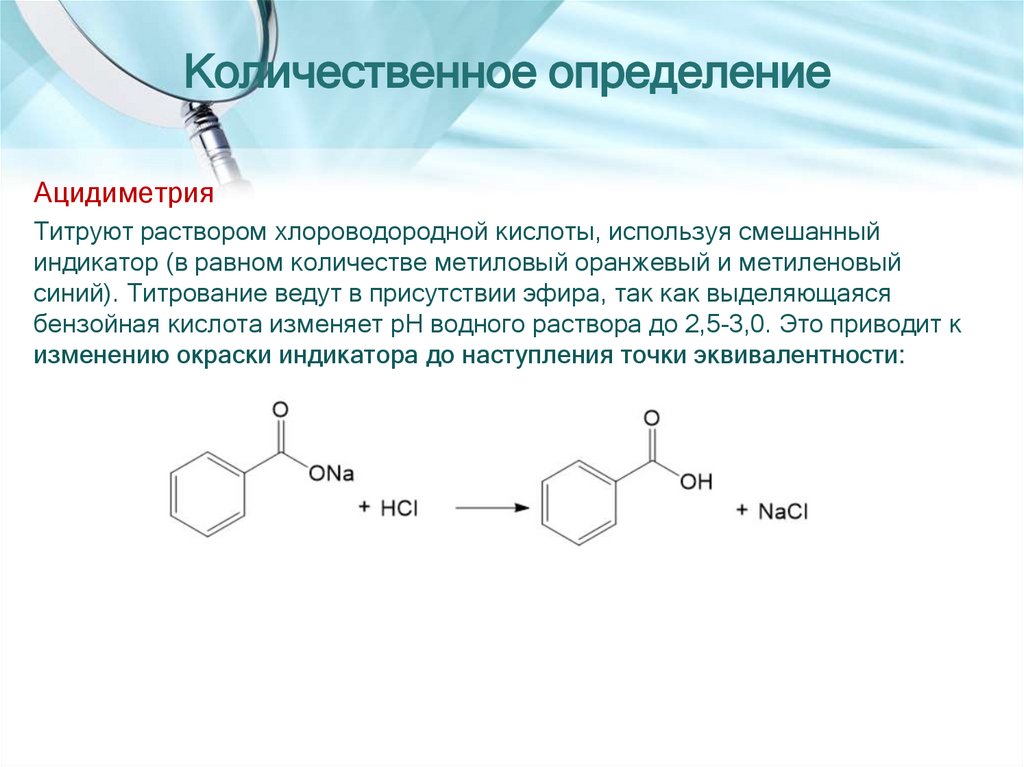
Количественное определениеАцидиметрия
Титруют раствором хлороводородной кислоты, используя смешанный
индикатор (в равном количестве метиловый оранжевый и метиленовый
синий). Титрование ведут в присутствии эфира, так как выделяющаяся
бензойная кислота изменяет pH водного раствора до 2,5-3,0. Это приводит к
изменению окраски индикатора до наступления точки эквивалентности:
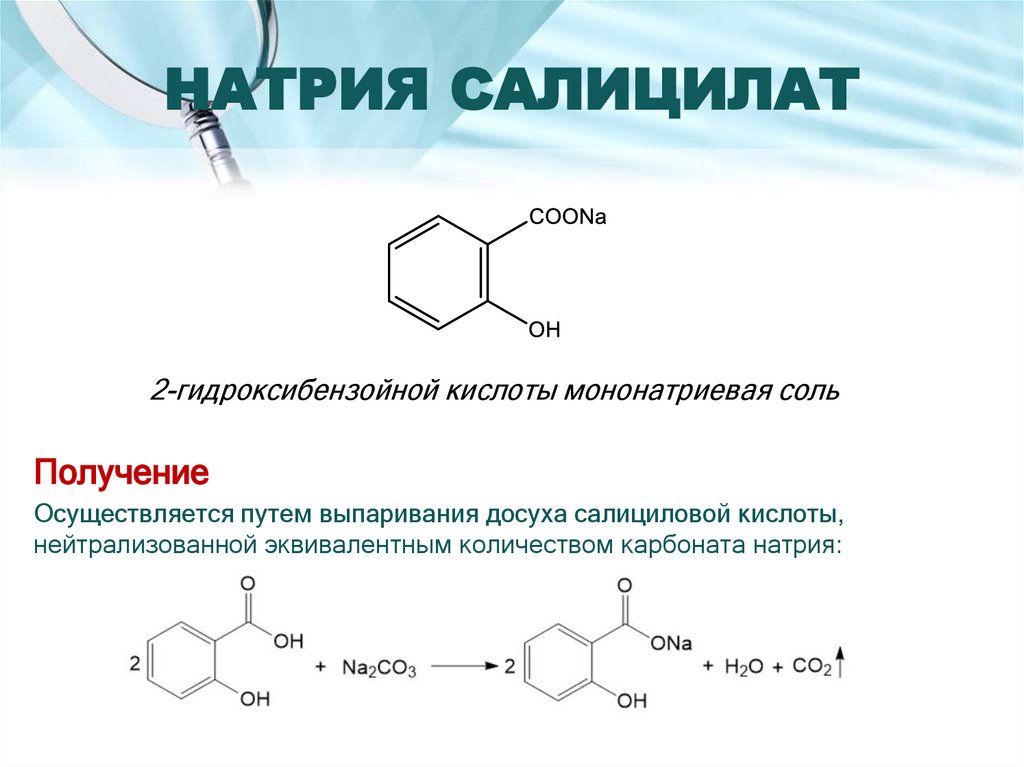
18. НАТРИЯ САЛИЦИЛАТ
2-гидроксибензойной кислоты мононатриевая сольПолучение
Осуществляется путем выпаривания досуха салициловой кислоты,
нейтрализованной эквивалентным количеством карбоната натрия:
19.
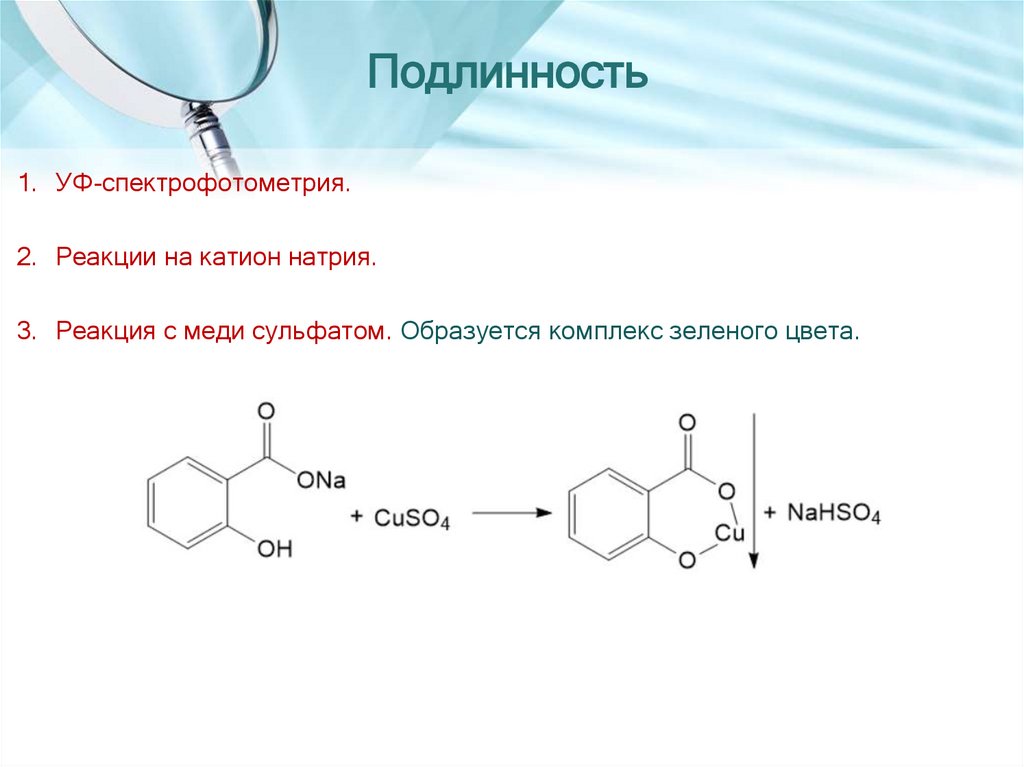
Подлинность1. УФ-спектрофотометрия.
2. Реакции на катион натрия.
3. Реакция с меди сульфатом. Образуется комплекс зеленого цвета.
20.
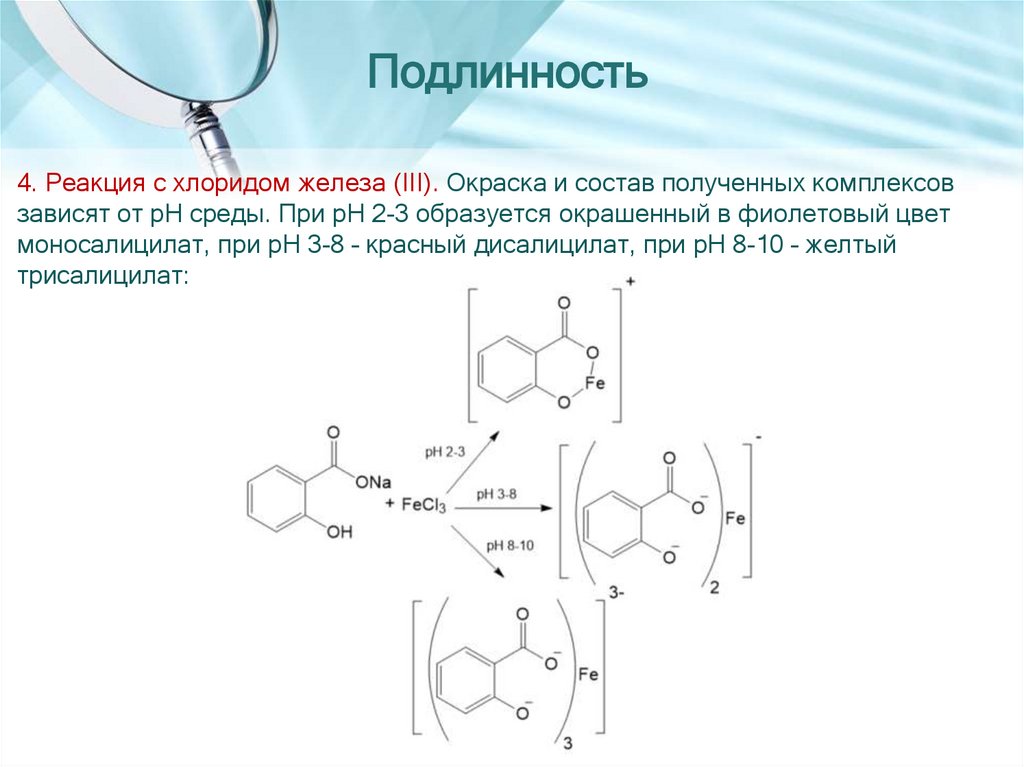
Подлинность4. Реакция с хлоридом железа (III). Окраска и состав полученных комплексов
зависят от pH среды. При pH 2-3 образуется окрашенный в фиолетовый цвет
моносалицилат, при pH 3-8 – красный дисалицилат, при pH 8-10 – желтый
трисалицилат:
21.
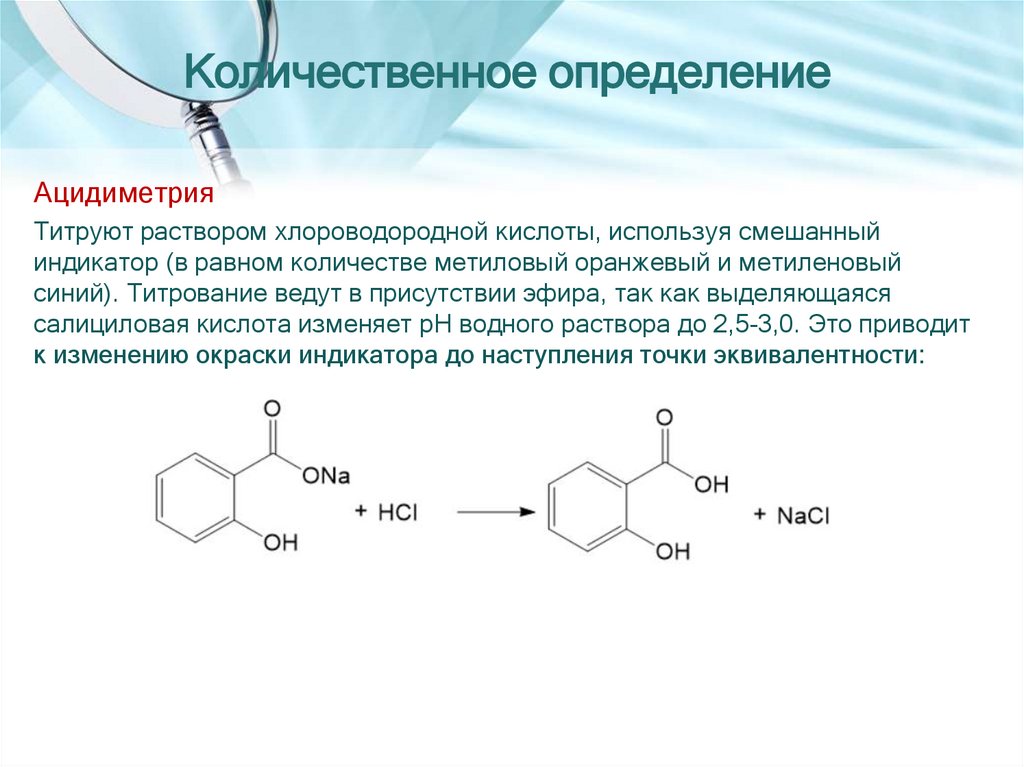
Количественное определениеАцидиметрия
Титруют раствором хлороводородной кислоты, используя смешанный
индикатор (в равном количестве метиловый оранжевый и метиленовый
синий). Титрование ведут в присутствии эфира, так как выделяющаяся
салициловая кислота изменяет pH водного раствора до 2,5-3,0. Это приводит
к изменению окраски индикатора до наступления точки эквивалентности:



 chemistry
chemistry








