Similar presentations:
Фармацевтическая химия. Лекция 3
1. ФАРМАЦЕВТИЧЕСКАЯ ХИМИЯ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧЕРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ«БЕЛГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ УНИВЕРСИТЕТ» (НИУ «БелГУ»)
ИНСТИТУТ ФАРМАЦИИ, ХИМИИ И БИОЛОГИИ
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ТЕХНОЛОГИИ
ФАРМАЦЕВТИЧЕСКАЯ ХИМИЯ
Лекция 3
доцент кафедры фарм.технологии, к.фарм.н.
Анастасия Юрьевна Малютина
Белгород
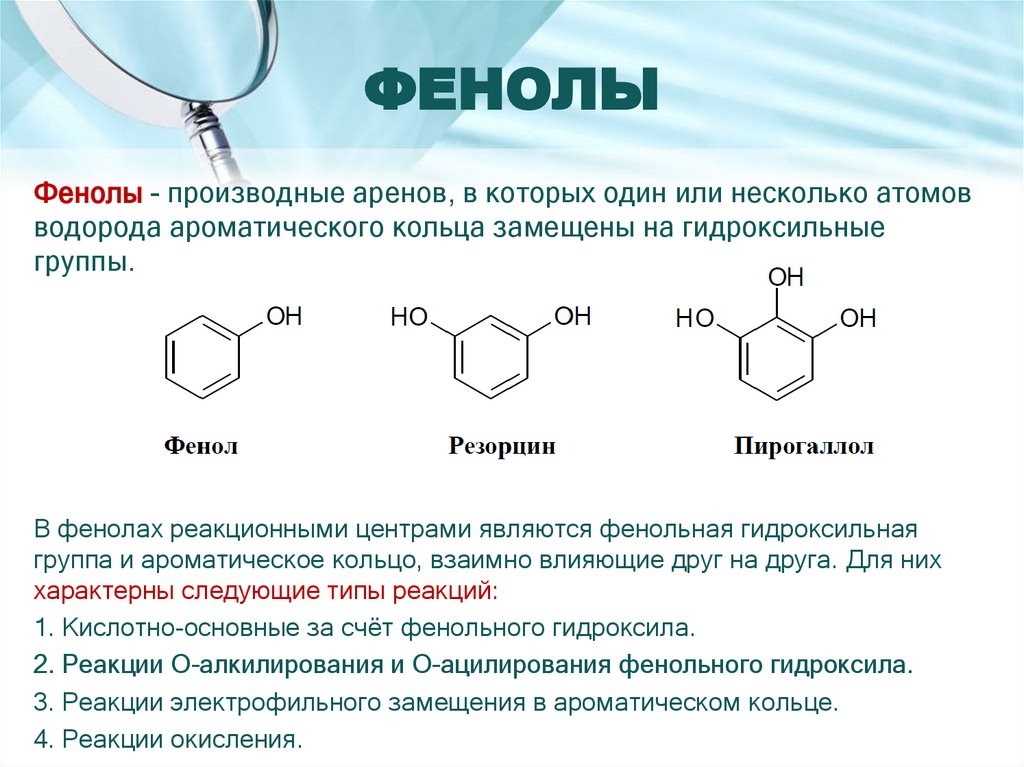
2. ФЕНОЛЫ
Фенолы - производные аренов, в которых один или несколько атомовводорода ароматического кольца замещены на гидроксильные
группы.
В фенолах реакционными центрами являются фенольная гидроксильная
группа и ароматическое кольцо, взаимно влияющие друг на друга. Для них
характерны следующие типы реакций:
1. Кислотно-основные за счёт фенольного гидроксила.
2. Реакции О-алкилирования и О-ацилирования фенольного гидроксила.
3. Реакции электрофильного замещения в ароматическом кольце.
4. Реакции окисления.
3. ФЕНОЛЫ
Кислотно-основные свойстваСвязи С→О и Н→О поляризованы, электронная плотность у них
смещена в сторону электроотрицательного атома кислорода. Однако
р,π–сопряжение фенольного гидроксила с ароматическим кольцом
обусловливает дефицит электронной плотности на атоме кислорода, в
результате чего протон гидроксильной группы фенолов становится
более подвижным, чем в спиртах, т. е. увеличиваются кислотные
свойства.
4. ФЕНОЛ
гидроксибензолПолучение
изопропилбензол
гидропероксид
изопропилбензол
фенол
ацетон
5.
Подлинность1. Реакция с хлоридом железа (III) - появляется фиолетовое окрашивание:
железа фенолят
2. Реакция азосочетания.
соль диазония
азосоединение
ярко-оранжевого цвета
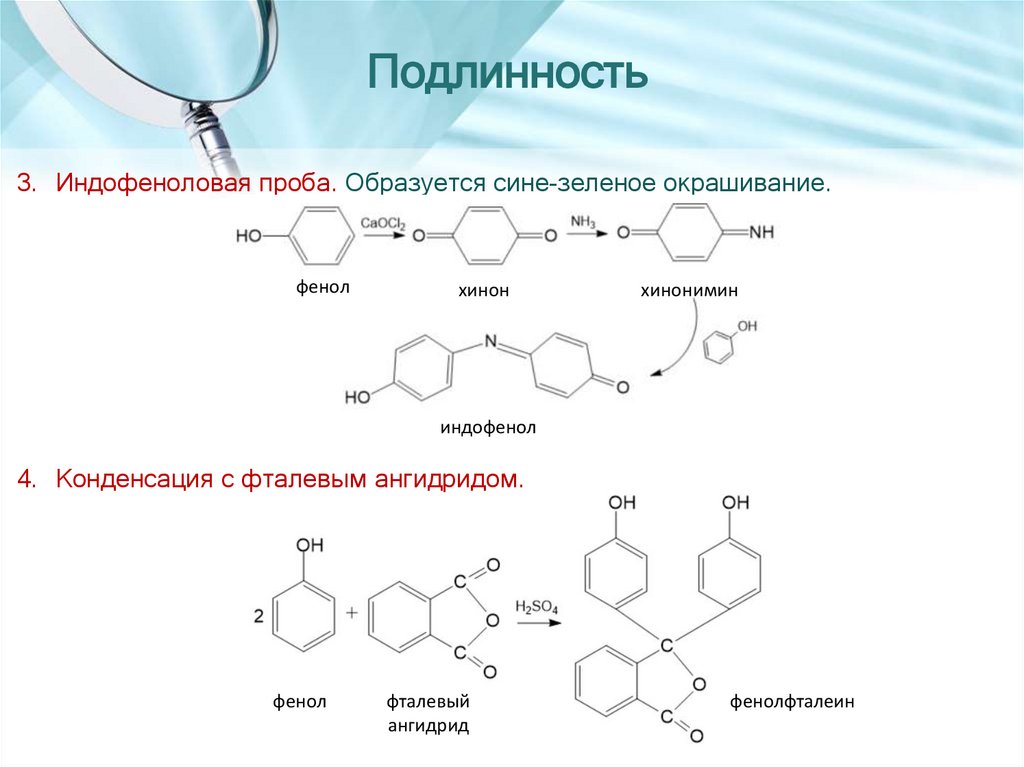
6.
Подлинность3. Индофеноловая проба. Образуется сине-зеленое окрашивание.
фенол
хинон
хинонимин
индофенол
4. Конденсация с фталевым ангидридом.
фенол
фталевый
ангидрид
фенолфталеин
7.
Подлинность5. Реакция с бромной водой. Выпадает белый осадок.
фенол
трибромфенол
6. Реакция нитрирования. При действии на фенол разведенной азотной кислоты
образуется п-нитропроизводное фенола, которое может существовать в двух
таутомерных формах: бензоидной (бесцветной) и хиноидной (желтого цвета).
Интенсивность окраски зависит от pH среды. Добавление натрия гидроокиси
усиливает окраску до ярко-желтой.
фенол
бензоидная
хиноидная
натриевая соль
8.
Количественное определение1. Бромид-броматометрический способ.
Титрование 0,1 М раствором бромата калия в присутствии бромида калия:
Избыток титрованного раствора бромата калия приводит к образованию
эквивалентного количества брома. При определении фенола избыток
брома устанавливают йодометрически
9.
Количественное определение2. Цериметрический метод.
Он основан на окислении фенола избытком 0,1 М раствора сульфата
церия (IV) в кислой среде при нагревании до 70-80℃. Избыток титранта
устанавливают йодометрическим методом
10. РЕЗОРЦИН
1,3-дигидроксибензолПолучение
бензол
м-бензол
дисульфокислота
резорцин
11.
Подлинность1. Реакция с хлоридом железа (III) - появляется фиолетовое окрашивание:
2. Реакция азосочетания.
резорциновый желтый
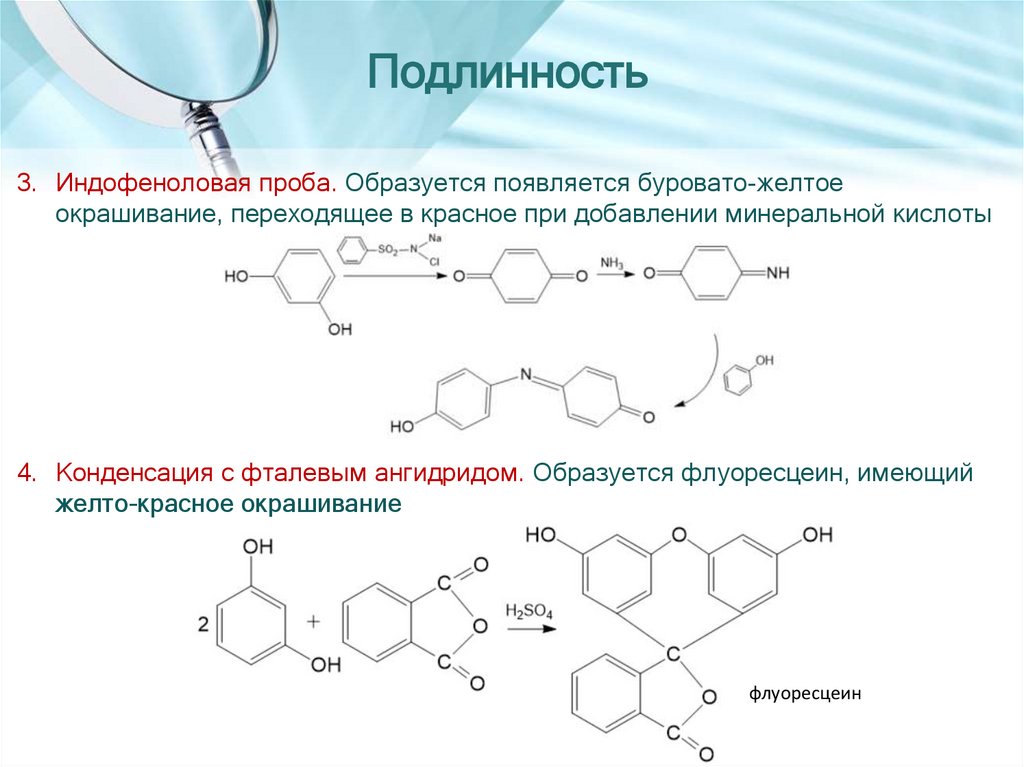
12.
Подлинность3. Индофеноловая проба. Образуется появляется буровато-желтое
окрашивание, переходящее в красное при добавлении минеральной кислоты
4. Конденсация с фталевым ангидридом. Образуется флуоресцеин, имеющий
желто-красное окрашивание
флуоресцеин
13.
Подлинность5. Реакция с бромной водой. Выпадает белый осадок.
трибромрезорцин
14.
Количественное определение1. Бромид-броматометрический способ.
Титрование 0,1 М раствором бромата калия в присутствии бромида калия:
Избыток титрованного раствора бромата калия приводит к образованию
эквивалентного количества брома. При определении резорцина избыток
брома устанавливают йодометрически:
15.
Количественное определение2. Цериметрический метод.
Он основан на окислении резорцина избытком 0,1 М раствора сульфата
церия (IV) в кислой среде при комнатной температуре, что ведет к
образованию глутаровой и муравьиной кислот:
Избыток титранта устанавливают йодометрическим методом:
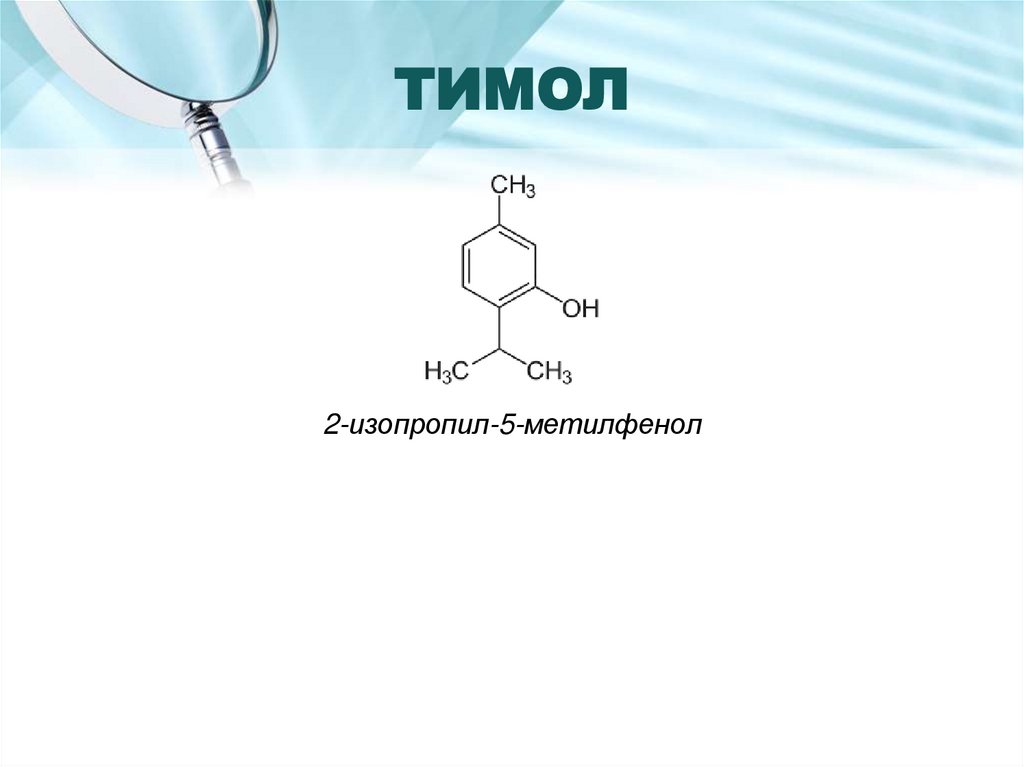
16. ТИМОЛ
2-изопропил-5-метилфенол17.
Подлинность1. Реакция с хлоридом железа (III) - появляется светло-зеленое окрашивание:
2. Индофеноловая проба. Производное индофенола образуется при
нитровании тимола в среде уксусного ангидрида и концентрированной
серной кислоты. Появляется темно-зеленое окрашивание:
18.
Количественное определение1. Бромид-броматометрический способ.
Титрование 0,1 М раствором бромата калия в присутствии бромида калия:
Избыток титрованного раствора бромата калия приводит к образованию
эквивалентного количества брома. При определении тимола избыток
брома устанавливают йодометрически:
19. СИНЭСТРОЛ
4,4'-(1,2-диэтил-1,2-этандиил) бисфенол20.
Получениеанетол
анетолгидробромид
диметиловый эфир гексэстрола
анетолгидробромид
диметиловый эфир гексэстрола
синэстрол
21.
Подлинность1. ИК-спектроскопия.
2. УФ-спектрофотометрия. Растворы в этаноле в области 230-350 нм у 0,005%ного синэстрола имеют максимум поглощения при 280 нм, минимум – при 247
нм и плечо от 283 до 287 нм.
3. Реакции нитрования. После добавления азотной кислоты и нагревания на
водяной бане постепенно появляется желтое окрашивание:
22.
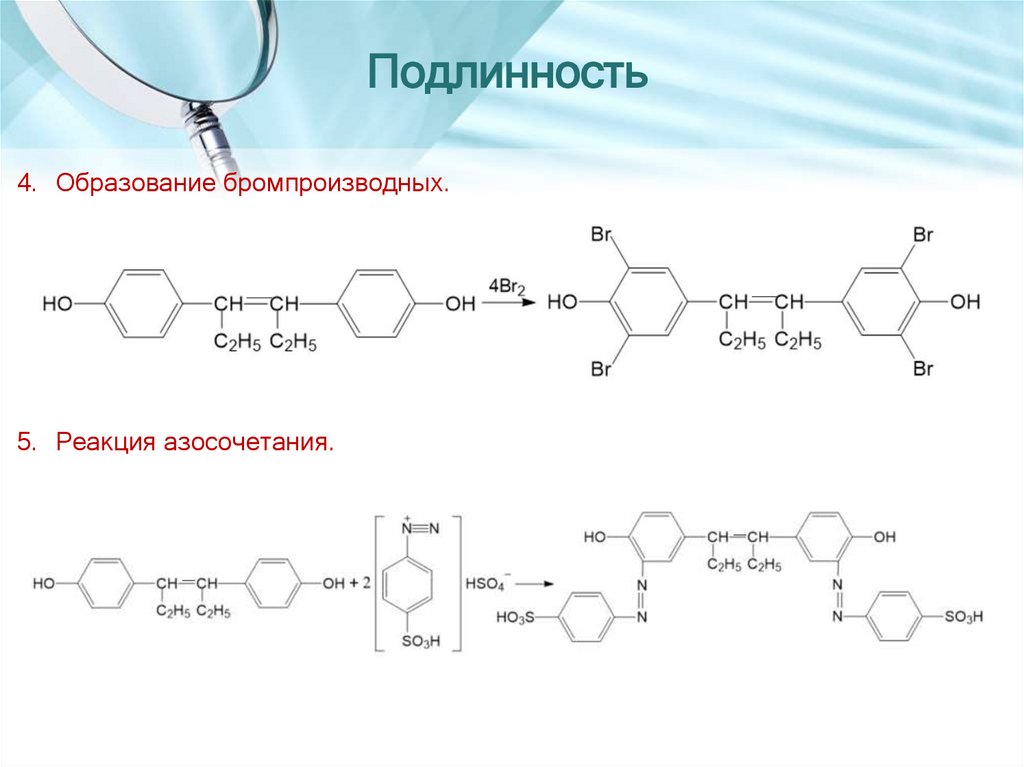
Подлинность4. Образование бромпроизводных. При действии бромной воды на раствор
синэстрола в среде ледяной уксусной кислоты выделяется осадок
тетрабромгексэстрола желтого цвета:
5. Реакция азосочетания.
23.
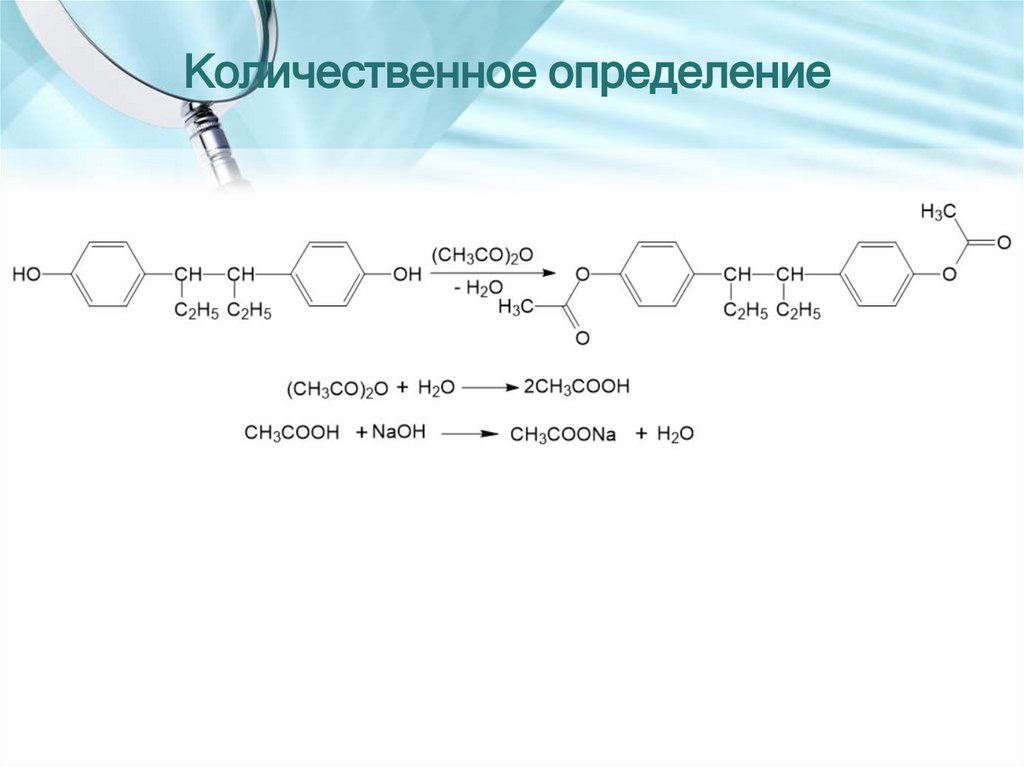
Количественное определение24. ДИЭТИЛСТИЛЬБЭСТРОЛ
(E)-4,4'-(1,2-диэтил-1,2-этендиил) бисфенол25.
Подлинность1. ИК-спектроскопия.
2. УФ-спектрофотометрия. Растворы в этаноле в области 230-350 нм у 0,001%ного диэтилстильбэстрола имеют максимум поглощения при 242 нм и плечо
от 276 до 280 нм.
3. Реакции нитрования. После добавления азотной кислоты и нагревания на
водяной бане постепенно появляется желтое окрашивание:
26.
Подлинность4. Образование бромпроизводных.
5. Реакция азосочетания.
27.
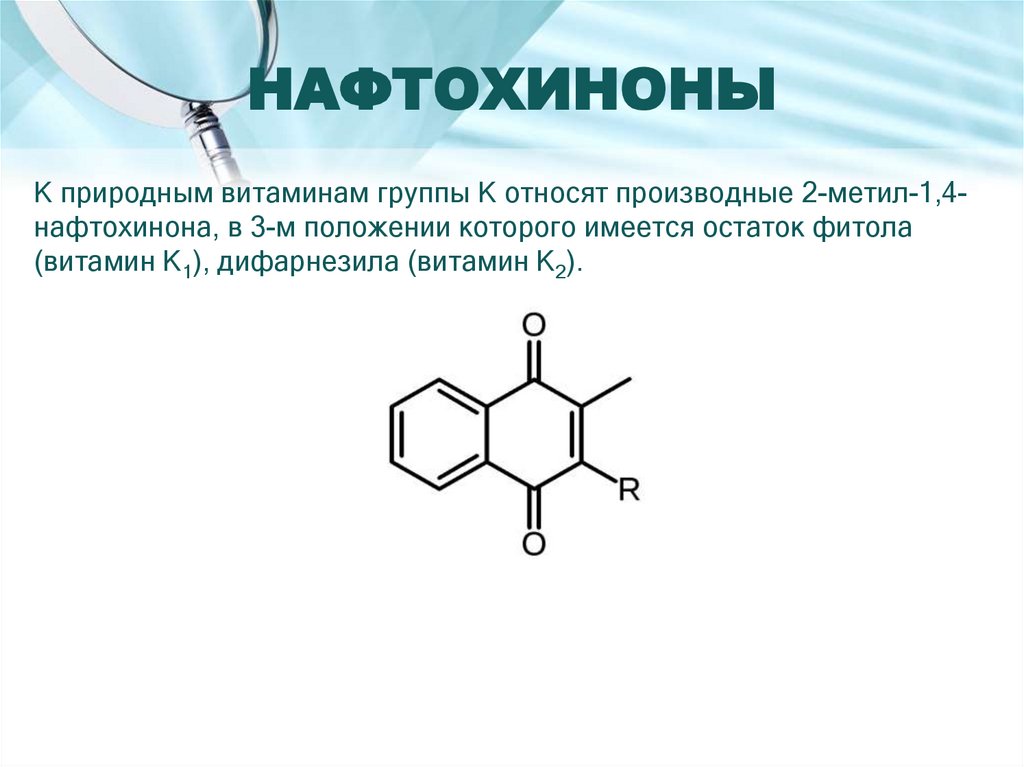
Количественное определение28. НАФТОХИНОНЫ
К природным витаминам группы К относят производные 2-метил-1,4нафтохинона, в 3-м положении которого имеется остаток фитола(витамин К1), дифарнезила (витамин К2).
29. ВИТАМИН К1
Филлохинон (витамин К1) в индивидуальном виде известен подназванием фитоменадион
Это вязкое маслообразное вещество желтого цвета. При освещении аргоновой
лампой флюоресцирует. Легко окисляется по месту двойной связи нафтохинона с
образованием эпокислот. При действии на витамин К1 слабых окислителей
отщепляется боковая алифатическая цепь по двойной связи, а при действии
энергичных окислителей образуется фталевая кислота. Не растворим в воде,
хорошо растворим в органических растворителях.
30. ВИТАМИН К2
Витамин К2 (фарнохинон) - группа соединений, содержащих радикал сразличным числом частично насыщенных изопреноидных звеньев
(для отличия друг от друга витаминов К2 в скобках указывают число
углеродных атомов в боковой цепи).
менахинон-4
витамин К2 (20)
2-метил-3-дигеранил-1,4-нафтохинон
менахинон-6
витамин К2 (30)
2-метил-3-дифарнезил-1,4-нафтохинон
является продуктом биологического синтеза гнилостных микроорганизмов и
выделен из гниющей костной рыбной муки.
Фарнохинон – кристаллическое вещество желтого цвета. Не растворим в воде, легко
растворим в органических растворителях.
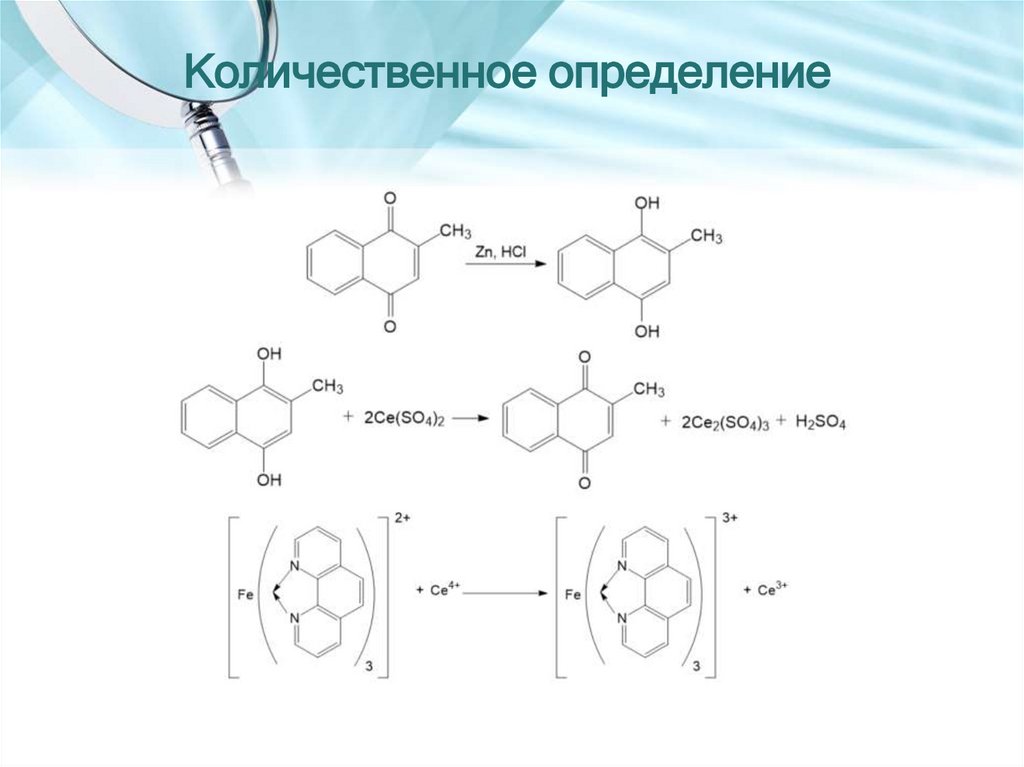
31. ВИКАСОЛ
2-метил-1,4-нафталендион натрий сульфонатПолучение
β-бензилнафталин
менадион
викасол
32.
Подлинность1. ИК-спектроскопия.
2. УФ-спектрофотометрия. УФ-спектр 0,0005%-ного водного раствора викасола
в области 220-280 нм имеет максимумы поглощения при 230 и 265 нм, а
минимум – при 248 нм.
3. Обнаружение катиона натрия.
33.
Подлинность4. Реакция с серной кислотой. Запах оксида серы (IV).
5. Удаление молекулы сульфоната натрия. При добавлении к раствору
викасола натрия гидроксида выпадает осадок 2-метил-1,4-диоксонафталина,
который имеет температуру плавления 104-107℃:
34.
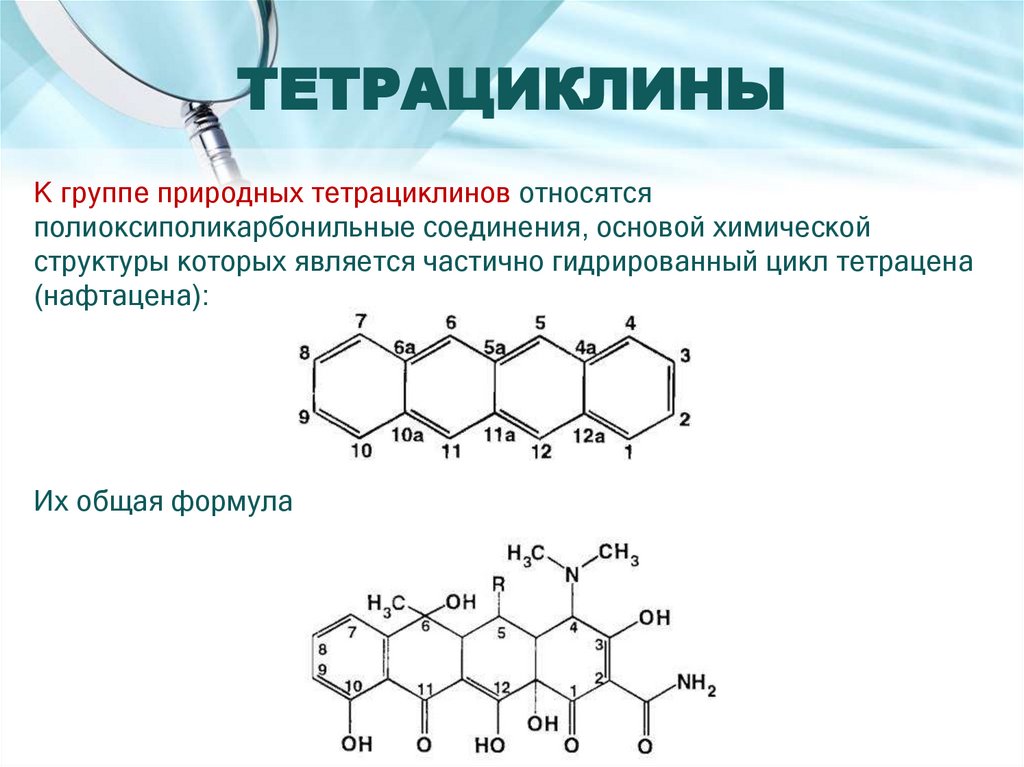
Количественное определение35. ТЕТРАЦИКЛИНЫ
К группе природных тетрациклинов относятсяполиоксиполикарбонильные соединения, основой химической
структуры которых является частично гидрированный цикл тетрацена
(нафтацена):
Их общая формула
36. ТЕТРАЦИКЛИН
[4S-(4альфа,4а альфа,5аальфа,6бета,12а альфа)]-4(диметиламино)-1,4,4а,5,5а,6,11,12аоктагидро-3,6,10,12,12апентагидрокси-6-метил-1,11-диоксо-2нафтаценкарбоксамид
37.
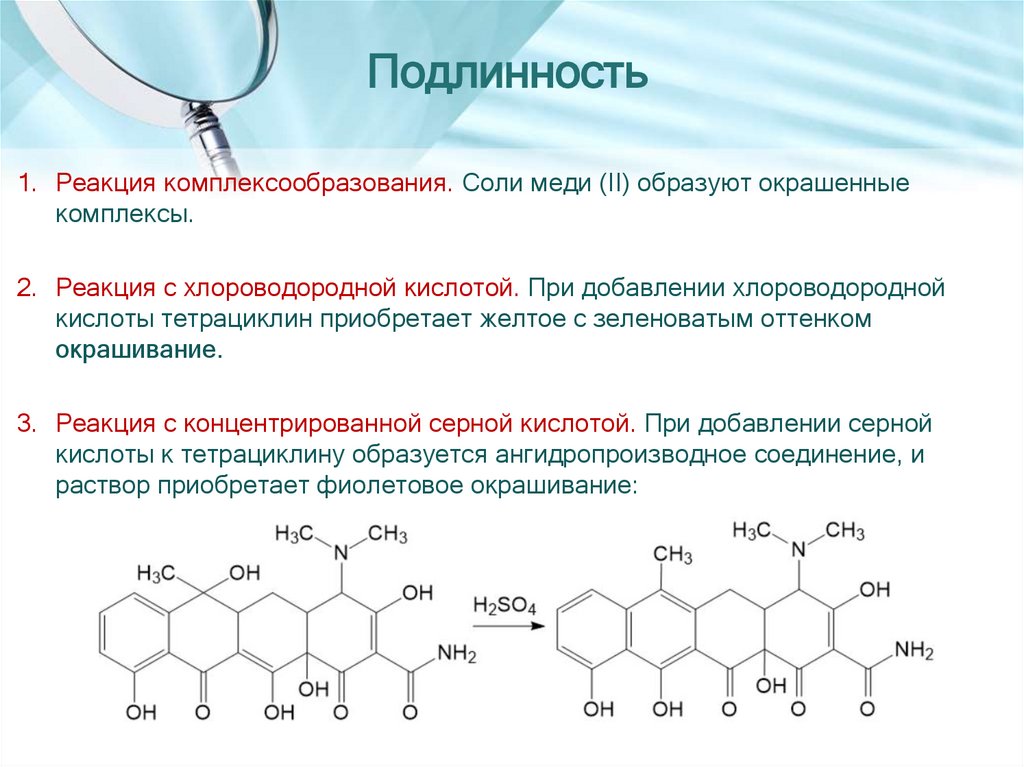
Подлинность1. Реакция комплексообразования. Соли меди (II) образуют окрашенные
комплексы.
2. Реакция с хлороводородной кислотой. При добавлении хлороводородной
кислоты тетрациклин приобретает желтое с зеленоватым оттенком
окрашивание.
3. Реакция с концентрированной серной кислотой. При добавлении серной
кислоты к тетрациклину образуется ангидропроизводное соединение, и
раствор приобретает фиолетовое окрашивание:
38.
Подлинность4. Реакция с диазореактивом. Наличие в молекулах фенольных гидроксилов
обусловливает образование имеющих красное окрашивание азокрасителей
при взаимодействии с диазореактивом:
39. ОКСИТЕТРАЦИКЛИНА ДИГИДРАТ
[4S-(4альфа,4а альфа,5а альфа,6бета,12а альфа)]-4-(Диметиламино)1,4,4а,5,5а,6,11,12а-октагидро-3,6,10,12,12а-пентагидрокси-6-метил1,11-диоксо-2-нафтаценкарбоксамид40.
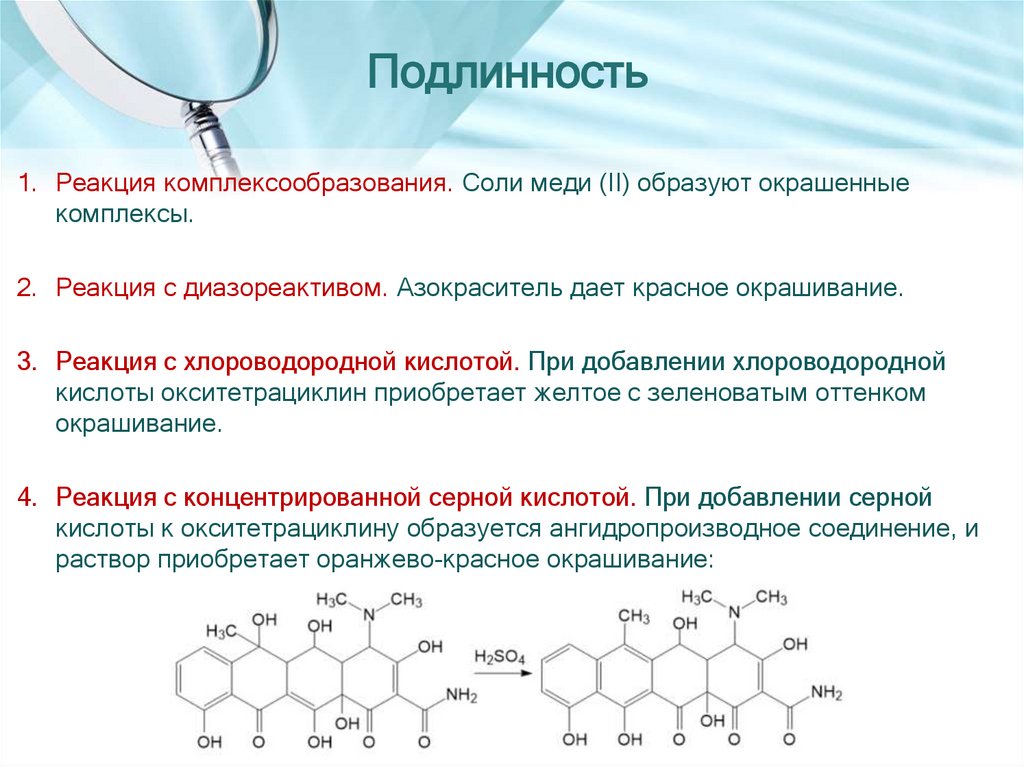
Подлинность1. Реакция комплексообразования. Соли меди (II) образуют окрашенные
комплексы.
2. Реакция с диазореактивом. Азокраситель дает красное окрашивание.
3. Реакция с хлороводородной кислотой. При добавлении хлороводородной
кислоты окситетрациклин приобретает желтое с зеленоватым оттенком
окрашивание.
4. Реакция с концентрированной серной кислотой. При добавлении серной
кислоты к окситетрациклину образуется ангидропроизводное соединение, и
раствор приобретает оранжево-красное окрашивание:
41. ТЕТРАЦИКЛИНЫ
Существенный недостаток природных тетрациклинов - сравнительновысокая токсичность. Это послужило толчком к созданию
полусинтетические аналоги природных тетрациклинов: доксициклин
(вибрамицин), метациклин (рондомицин) и др.
Общая формула полусинтетических тетрациклинов:
42. МЕТАЦИКЛИНА ГИДРОХЛОРИД
Получениеокситетрациклин
доксициклин
метациклин
43.
Подлинность1. Реакция комплексообразования. Соли меди (II) образуют окрашенные
комплексы.
2. Реакция с диазореактивом. Азокраситель дает красное окрашивание.
3. Реакция с хлоридом железа (III). При добавлении хлорида железа
метациклин приобретает темное красно-коричневое окрашивание.
4. Реакция с концентрированной серной кислотой. При добавлении серной
кислоты к метациклину появляется желтое окрашивание.
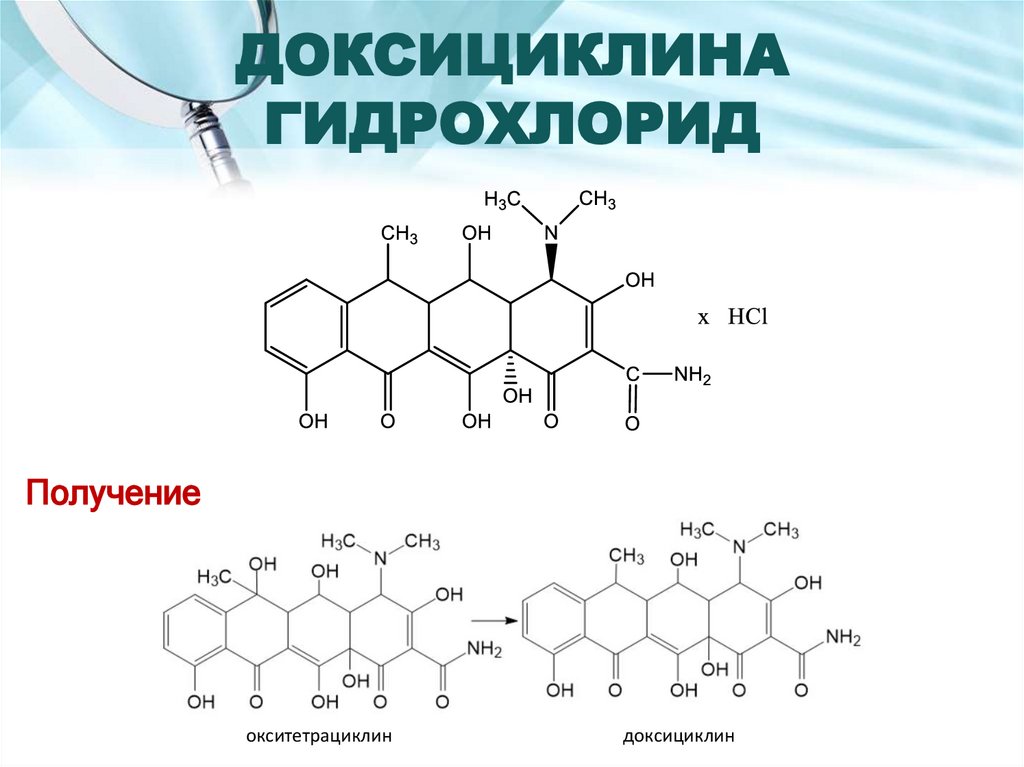
44. ДОКСИЦИКЛИНА ГИДРОХЛОРИД
Получениеокситетрациклин
доксициклин
45.
Подлинность1. Реакция комплексообразования. Соли меди (II) образуют окрашенные
комплексы.
2. Реакция с диазореактивом. Азокраситель дает красное окрашивание.
3. Реакция с хлоридом железа (III). При добавлении хлорида железа
доксициклин приобретает темное красно-коричневое окрашивание.
4. Реакция с концентрированной серной кислотой. При добавлении серной
кислоты к доксициклину появляется желтое окрашивание.


































 medicine
medicine chemistry
chemistry








