Similar presentations:
Фармацевтическая химия
1.
Фармацевтическая химия - это наука,изучающая
• способы получения,
• физические и химические свойства,
• методы контроля качества
лекарственных веществ,
• изменения, происходящие при их хранении
• влияние отдельных особенностей
строения молекул лекарственных веществ
на характер действия их на организм.
Основа – фармацевтический анализ
2.
Основа – фармацевтический анализ(4 вида анализа):
1. Фармакопейный анализ
2. Постадийный контроль производства
лекарственных средств (ЛС)
3. Анализ лекарственных форм
индивидуального изготовления
4. Биофармацевтический анализ
3.
1. Фармакопейный анализ – это анализлекарственных средств: субстанций
(лекарственных веществ) и изготовленных
из них лекарственных препаратов
(лекарственных форм)
по нормативной документации (НД) фармакопейной статье ГФХIV (ОФС, ФС
или ФПС, ВФС).
Итогом фармакопейного анализа
является вывод о возможности или
невозможности использования в медицине
исследуемого объекта
(т.е. соответствие НД).
4.
2. Постадийный контроль производстваЛС: от контроля исходного сырья до
контроля качества полученного ЛС,
анализ проводят по НД технологическому регламенту,
спецификации.
5.
3. Анализ лекарственных форминдивидуального изготовления – это
внутриаптечный контроль качества
лекарственных форм, приготовленных по
индивидуальным рецептам (экспрессанализ). Анализ проводят по ГФ, приказам,
инструкциям и методическим
рекомендациям.
вывод - (приготовлено удовл., неуд.)
Качественный анализ и количественный!!!
6.
4. Биофармацевтический анализ – этоанализ ЛС в биологических жидкостях
(кровь, моча, ткани и т.д.). Анализ
проводят по экспериментальным
методикам.
7.
Вопросы в учебникепо ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
Общие
1. современная номенклатура
2. система контроля качества ЛС
3. физические и химические свойства основных классов
ЛВ
4. испытания на подлинность (реакции по катионам и
анионам, по функциональным группам)
5. испытания на возможные примеси (общие - степень
очистки и специфические)
6. общие методы количественного определения
(химические, физические, физико-химические)
7. обоснование условий хранения и применения
8.
Специальныек изучению групп лекарственных веществ
1. Особенности химического строения
(функциональные группы). Латинское название,
Международное непатентованное название(МНН)
2. Физические свойства (описание, растворимость)
3. Методы определения подлинности, качественное
(сопоставлять и обосновывать их с физическими,
физ.-хим. и химическими свойствами реакции )
4. Методы количественного определения
(обосновывать сопоставляя со свойствами,
реакции эффекты)
5. Хранение. Применение
9.
Ответы обязательно!!! должныиллюстрироваться уравнениями
химических реакций, положенными в
основу методов анализа лекарственных
веществ.
Методики подлинности и количественного
определения из НД (ФС, приказов,
инструкций методических пособий и
рекомендаций) следует обосновывать по
методам определения и физико-химическим
свойствам ЛВ.
10.
В качественном определении (подлинность)следует выделять
обоснование реакции (указать свойства в реакции
функциональной группы (ФГ), гетероцикла,
катиона, аниона и назвать их)
каким внешним эффектом они сопровождаются:
выпадение в осадок, цвет осадка, в чем он
растворяется, появление окраски, выделение
газообразных продуктов и как они
обнаруживаются.
особые условия (указывать среду) и ее значение в
реакции
11.
Например, реакция обнаружения хлорид- ионовсогласно ГФ основана на осаждении хлоридов
нитратом серебра и образовании белого
творожистого осадка
NаСl + AgNO3 → NаNO3 + AgСl ↓
Белый творож. осадок
в азотнокислой среде (для растворения
сопутствующих осадков пр. фосфатов, карбонатов ).
Осадок хлорида серебра растворим в водном
растворе аммиака вследствие образования
комплексного соединения аммиаката серебра.
AgCI↓ + 2NH4OH→ [Ag(NH3)2]CI + 2Н2O
12.
В количественном определенииследует выделять
• название метода по титранту, с которым
реагирует определяемое вещество
(ацидиметрия, алкалиметрия, аргентометрия,
трилонометрия, нитритометрия,
броматометрия, йодометрия, йодатометрия, и
т.д.) или физико-химические - по прибору
(рефрактометрия);
• вариант титрования (прямой, обратный или
косвенный);
• обоснование выбора метода анализа на основе
свойств функциональной группы или по иону
для конкретного препарата:
13.
Обоснование метода-возможно применение благодаря какой ФГ???,
- обладающей какими свойствами??? (кислотноосновными, окислительно-восстановительными,
способностью осаждаться или образовывать
устойчивые комплексы, соли диазония и т.д.),
-почему обратный, а не прямой вариант???, почему
выбран вариант Фаянса, а не Мора,
-почему надо титровать в неводной среде и нельзя
в водной и т.д.
14.
- указать среду??? (обосновать)нейтральная водная,
водная с подкислением или с подщелачиванием,
с органическим растворителем (спирт, эфир.
хлороформ)
или неводный растворитель (диметилформамид,
ледяная уксусная кислота, уксусный ангидрид
и ацетат ртути если гидрохлориды и
гидробромиды азотистых оснований);
15.
- Индикатор и переход окраски??? в конечнойточке титрования (точка эквивалентности),
- расчет фактора эквивалентности и молярной
массы эквивалента, титра,
(по общей схеме
Кстех → РЧ или УЧ(1/n)→ fэкв → М.э, → Т).
Ответ обязательно иллюстрируется
уравнениями реакций!!! (в т.ч.индикации и
вспомогательные)
16.
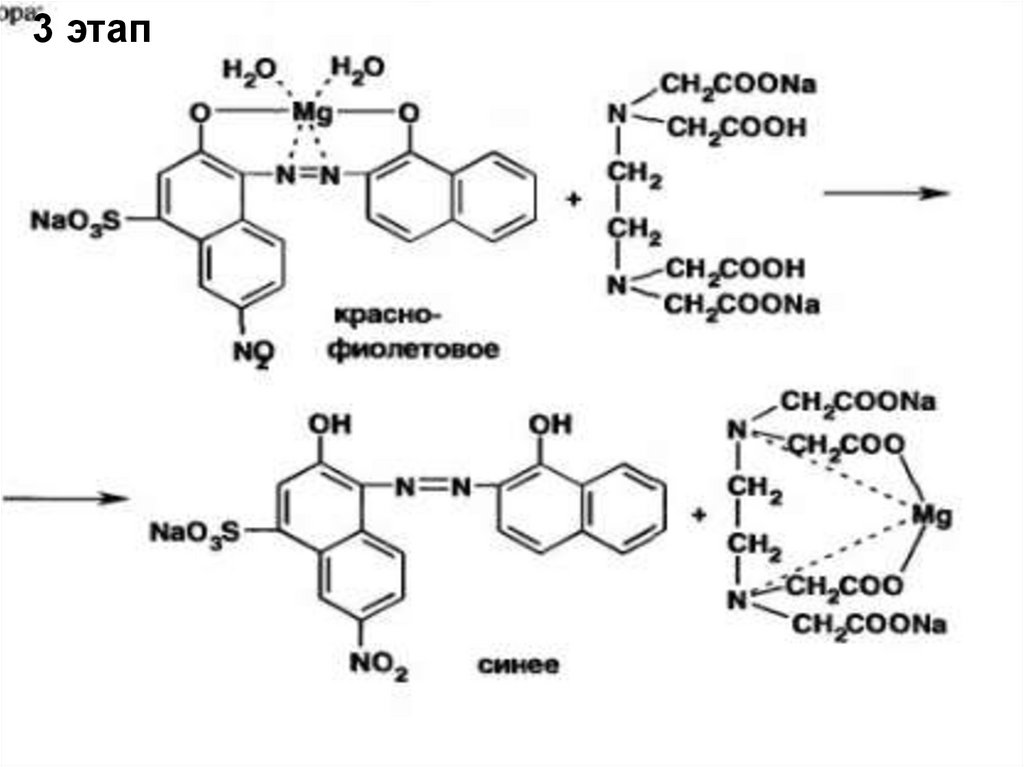
Например,Количественное определение магния сульфата
проводится трилонометрическим
(комплексонометрическим) методом,
основанным на образовании прочного
комплекса иона магния с комплексомтрилоном Б. Титрование проводят в
присутствии аммиачного буферного раствора рН
среды 10-11(для индикатора). Индикаторкислотный хром черный специальный.
17.
Далее приводятся все 3 стадиитрилонометрического титрования
(уравнения реакций).
1 стадия- () взаимодействие
металлоиндикатора с ионом металла
анализируемого соединения
- образование не прочного комплекса иона
магния с индикатором
18.
2 стадия- взаимодействие трилона Б санализируемым соединением,
3 стадия -взаимодействие комплекса
металлоиндикатора-магния с трилоном Б.
Так как прочность комплекса иона магния с
индикатором меньше, чем с трилоном Б в
точке эквивалентности, избыточная капля
титранта разрушает комплекс иона магния с
индикатором. Исследуемый раствор титруют
до перехода красной окраски (цвет комплекса
иона магния с индикатором) раствора в
синюю (индикатор).
19.
1 этап2 этап (основной)
20.
3 этап21.
При составлении ответов на вопросы,касающиеся хранения лекарственных
веществ, необходимо иметь представление о
влиянии внешних факторов - влаги,
температуры, атмосферной углекислоты,
кислорода воздуха и т.д. При этом надо так же
знать, за счет каких функциональных групп
(ионов) в молекуле лекарственного вещества
происходят изменения под влиянием внешних
факторов и соответствующие реакции
(приводить примеры по ЛВ программы).
22.
При характеристике реакций на общие испецифические примеси (вода очищенная, вода
для инъекций) как в реакциях подлинности
следует указывать:
обоснование реакции (ФГ, ион)
С каким внешним эффектом (отличаются от
реакций подлинности (идентификации) !!!,
особые условия (указывать среду,
вспомогательные реактивы и их значение),
роль эталонных растворов и общие положения
проведения испытаний по ГФ ОФС
«Испытания на чистоту и допустимые пределы
примесей»
химические реакции (можно в ионном виде)
23.
В количественном анализе используютсяразличные титриметрические методы:
алкалиметрия, ацидиметрия,
аргентометрия, перманганатометрия,
комплексонометрия и тд.
Названия методов
происходят от названий используемых для
титрования стандартных растворов (растворов
с точно известной концентрацией, которые
называют титрованными растворами ,
рабочими растворами или просто
титрантами).
24.
Концентрации титрантовпо ГФ ОФС статья «Титрованные растворы»,
приводятся в единицах молярности (M)
– это количество растворенного вещества в молях,
содержащееся в 1л раствора.
Например 0,1М; 0,02 М; 0,01 М; 0,0167 М
М (моль/л)
В методиках молярность часто соответствует
нормальности (N) - 0,1н и зависит от того с
учетом каких Частиц приготовлен титрант
(реальных или условных).
N (н)
25. Расчеты концентрации в титриметрии.
1 моль вещества титранта может содержать всебе реальные частицы (РЧ) или условные
частицы (УЧ).
реальные частицы (РЧ) – целые атомы,
ионы, молекулы, электроны (принимают
за единицу 1)
условные частицы (УЧ) – их доли 1/n.
Если титрант УЧ, то его молярная
концентрация (М)– это молярная
концентрация эквивалента.
26.
Значения реальных и условных частиц обозначены вОФС ГФ ХI «Титрованные растворы»
Значит тирант приготовлен с учетом
реальных частиц РЧ (1 NaOH)
Значит тирант приготовлен с учетом
условных частиц УЧ (1/6 KBrO3)
27.
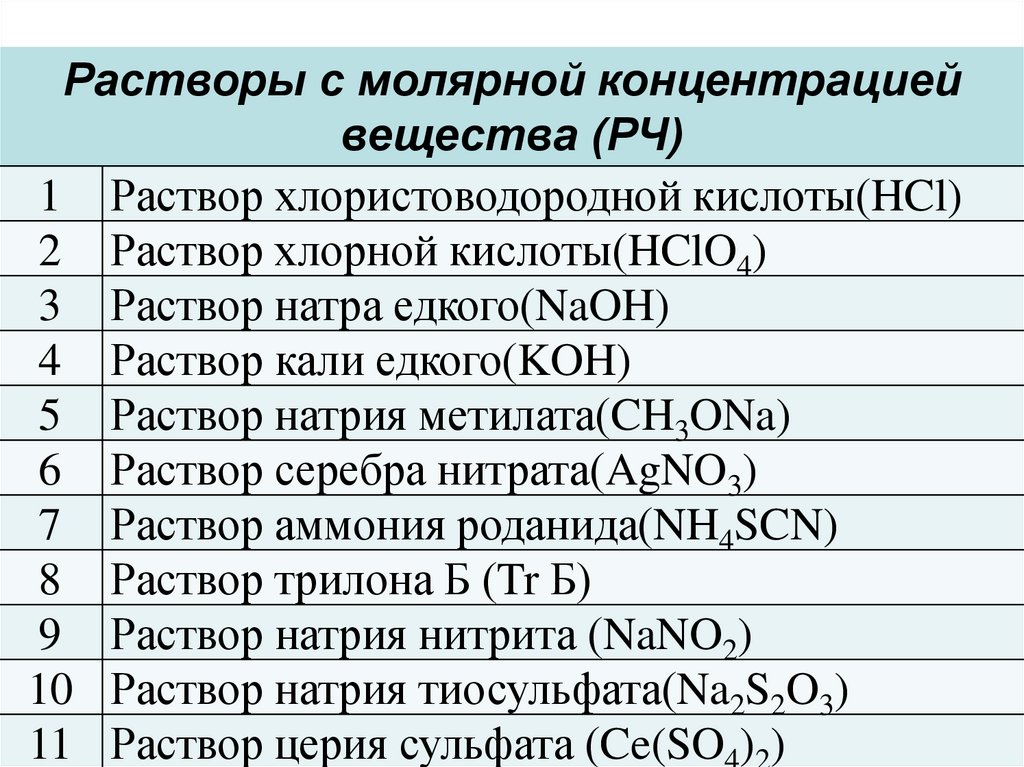
Растворы с молярной концентрациейвещества (РЧ)
1 Раствор хлористоводородной кислоты(HCl)
2 Раствор хлорной кислоты(HClO4)
3 Раствор натра едкого(NaOH)
4 Раствор кали едкого(KOH)
5 Раствор натрия метилата(CH3ONa)
6 Раствор серебра нитрата(AgNO3)
7 Раствор аммония роданида(NH4SCN)
8 Раствор трилона Б (Tr Б)
9 Раствор натрия нитрита (NaNO2)
10 Раствор натрия тиосульфата(Na2S2O3)
11 Раствор церия сульфата (Ce(SO ) )
28.
Растворы с молярной концентрациейэквивалента вещества (УЧ)
1 Раствор серной кислоты УЧ (½ H2SO4)
2 Р-р ртути окисной нитрата УЧ [½ Hg(NO3)2]
3 Раствор йода УЧ (½ I2)
4 Раствор йодмонохлорида УЧ (½ ICl)
5 Раствор калия йодата УЧ (1/6 KIO3)
6 Раствор калия бромата УЧ (1/6 KBrO3)
7 Раствор калия перманганата УЧ (1/5 KMnO4)
29.
Во всех вопросах и задачах ститриметрическими методами анализа
поэтапно рассчитывают
(К стех для расчета fэкв, fэкв для расчета М.э,
М.э для расчета Т, Т для расчета С ) :
1.Коэффициент стехиометричности
(стехиометрический коэффициент)
– это молярное соотношение анализируемого
вещества и титранта (по коэффициентам
уравнения реакции – левая часть основного
уравнения, ЛВ +титрант)
К стех = n моль вещества
n моль титранта
30.
2. Фактор эквивалентности (fэкв)– это произведение коэффициента
стехиометричности на реальные или условные
частицы (статья ГФ ХI «Титрованные
растворы»)
если титрант приготовлен с учетом реальных
частиц РЧ(1)
fэкв = Кстех · РЧ(1) = Кстех
если титрант приготовлен с учетом условных
частиц УЧ(1/х)
fэкв = Кстех · УЧ(1/х) = Кстех /х
31.
3. Молярная масса эквивалента, (Э или М.э)– это произведение фактора эквивалентности и
молярной массы исследуемого вещества
М.э = fэкв · М.м
Если фактор эквивалентности fэкв = 1, то
молярная масса эквивалента равна молярной
массе
М.э = 1 · М.м
32.
4. Титр (Т) – это количество граммопределяемого вещества, которое
взаимодействует с 1 мл титранта
(0,1 моль/л или 0,1н [г/мл]) данной
концентрации в данной реакции.
Т = М.э · Сн
1000
Где: С – концентрация титранта (моль/л, н)
33.
5. Составление расчетной формулыФормулу условно делим на три части
С(Х,mr) = V · K · T
.
a (Vпр, m)
1
2
3
Где: С –содержание определенного вещества (%,г)
V – объем титранта в мл
К – коэффициент поправки титранта (на флаконе)
Т – титр рабочего раствора титранта по
определяемому веществу
а (Vпр ) – масса в гр или объем в мл
анализируемого вещества, взятый для анализа
34.
1 часть – основа формулы (скелет)2 часть – учет разведения (в числителе –
объемы колб разведения, в знаменателе аликвотные пробы взятые из колбы
разведения)
3 часть –пересчет в % концентрацию или
в граммы, на лекарственную форму или
дозу (в числителе – 100%, или объем
лекарственной формы, или средняя масса
порошка или таблетки)
35.
Если расчет содержания вещества в субстанцииили в 100 мл раствора то считают
концентрацию в %
С% = V· К· T· 100 % (или в 100 мл)
а( или Vпр )
Где: С –концентрация определенного вещества в %
V – объем титранта в мл
К – коэффициент поправки титранта (на флаконе)
Т – титр по определенному веществу
а (Vпр ) – масса в гр или объем в мл
анализируемого вещества, взятый для анализа
36.
Если расчет содержания вещества на объем(VЛФ) или массу (Рср) лекарственной формы,
то считают в граммах
С = V · К · T · Рср(или VЛФ, Vобщ )
а
Р – средняя масса (Рср) ЛФ (порошки, таблетки)
или объем лекарственной формы (VЛФ или Vобщ )
в инъекционных ЛП промышленного производства
считают содержание в 1 мл раствора
37.
Если титрование обратноето объем равен разности основного
титранта (добавленного в избытке) и
вспомогательного титранта
(определяющего остаток избытка
основного)
V = (V1· К1 – V2 · К2)
С % = (V1· К1 – V2 · К2) · T · 100%
а
38.
Если предварительно сделали разведение ититровали часть полученного разведения
С% = V· К· T · Vк · 100%
а
· Vал
Vк – объем мерной колбы в мл ( в тексте
методики – «в мерную колбу», «довели до
метки» «в 30 раз развели», «1:100»)
Vал – объем разведения, взятый пипеткой для
титрования (аликвотная доля), в мл
39.
Например, задача с количественнымопределением раствора перекиси водорода
40.
1. Перманганатометрический метод.Метод основан на способности пероксида
водорода проявлять восстановительные
свойства в присутствии более сильного
окислителя. Пероксид водорода окисляется до
кислорода и восстанавливает Mn (+7) до Mn
(+2) в кислой среде разведенной серной кислоты.
Титрование проводят в серно-кислой среде без
индикатора до появления устойчивого розового
окрашивания избыточной каплей титранта
(окрашен в фиолетовый цвет).
41.
5 H2O2 + 2 KMnO4 + 3H2SO4 → 2MnSO4 +5O2↑+K2SO4 + 8H2O
Восст. распад H2O2 - 2ē → 2H+ + O2
Кстех = 5моль H2O2 .= 5/2;
2моль KMnO4
Титрант по ГФ ХI приготовлен с учетом
условных частиц УЧ (1/5 KMnO4)
fэкв = Кстех · УЧ = 5/2 · 1/5 = ½ ;
42.
М.м Н2О2 = 34,02М.э (Э) = fэкв · М.м Н2О2 = ½ · М.м Н2О2 =
= 34,01 / 2 = 17,01
Т = Ст-та · М.э = 17,01· 0,1 / 1000 = 0,001701г/мл
1000
С% =V KMnO4 · К KMnO4· TH2O2/0,1н KMnO4 · Vк · 100%
Vпр · Vал
С% = V · 1,0000· 0,001701 · 100 · 100%
10 · 10
43.
2. Йодометрический метод (косвенный)Основан на окислительных свойствах водорода
пероксида (окислительный распад), который
окисляет калия йодид до йода в кислой среде
разведенной серной кислоты.
Выделившийся йод титруют раствором натрия
тиосульфата.
Способ титрования – косвенный (по
заместителю).
Индикатор – крахмал, титруют до обесцвечивания
синего окрашивания.
44.
H2O2 + 2KI + H2SO4 → I2 + K2SO4 + 2H2OI2 + 2Na2S2O3 → 2NaI + Na2S4O6
1 моль пероксида образует 1 моль йода, на
который идет 2 моль тиосульфата натрия
Кстех = 1моль H2O2 .= ½;
2моль Na2S2O3
Титрант по ГФ ХI приготовлен с учетом
реальных частиц (принимаем за 1 РЧ Na2S2O3)
fэкв = Кстех · РЧ = ½ · 1 = ½ ;
М.э = fэкв · М.м Н2О2 = ½ М.м Н2О2
Т = М.э · Ст-та /1000
45.
Расчет теоретического расхода(ориентировочного) расхода (объема)
титранта при количественном определении
субстанций лекарственных средств
1.На основе уравнения реакции количественного
определения расчет
К стех., f экв., М.э (Э).
2.Расчет титра Т = Ст-та · М.э
1000
3.Дальнейший расчет ведут одним из следующих
способов:
46.
1) первый способ расчета расчет теоретическогосодержания определяемого вещества в объеме
титруемого раствора (в колбе для титрования).
1а) В случае, если вся навеска помещается в
колбу для титрования (нет разведения в мерной
колбе), расход титранта эквивалентен всей
навеске. Исходя из теоретического
содержания 100% вещества в навеске, расчет
по формуле:
V ор. = а / Т
где а – навеска определяемого вещества,
а(х,m) – масса вещества в навеске (пробе).
47.
напримерМетодика комплексонометрического
титрования кальция глюконата по ГФ Х:
около 0,2 гр препарата (точная навеска)
растворяют при подогревании в 10 мл воды. По
охлаждении прибавляют 5 мл аммиачного
буферного раствора, около 0,1 гр индикаторной
смеси или 7 капель раствора кислотного хром
темно- синего и титруют 0,05 н раствором
трилона Б до сине-фиолетового окрашивания
48.
К стех.1 = 1;
1
f экв. = 1·1 = 1;
М.э = М.м = 448,4
Т г/мл = 0,05 * 448,4 = 0,02242г/мл
1000
Vор.=
а
0,4
=
=17,84мл
Т
0,02242
Ориентировочный (теоретический) расход
титранта – 17,84 мл
49.
1б) Если методика количественного определенияпредполагает предварительное разведение
навески определяемого вещества в мерной
колбе с последующим отбором аликвотной
пробы, которую помещают в колбу для
титрования, то расход титранта эквивалентен
содержанию вещества в аликвоте (пробе),
поэтому сначала делают расчет теоретического
количества вещества в аликвоте:
а * Vп
а – V колбы
или х =
Vк
x гр – V пробы
V ор. = х / Т
50.
Методика прямого йодатометрическоготитрования аскорбиновой кислоты по ФС:
около 0,5 гр препарата (точная навеска)
растворяют в воде в мерной колбе ёмкостью 50
мл, доводят объем раствора водой до метки и
перемешивают. К 10 мл приготовленного
раствора прибавляют 0,5 мл 1% раствора йодида
калия, 2 мл раствора крахмала и 1 мл 2%
раствора соляной кислоты и титруют 0,1 н
раствором йодата калия до появления стойкого
слабо синего окрашивания.
51.
Йодатометрический методвариант прямого титрования.
Кислота аскорбиновая окисляется по диенольной
группе до дикетонной (кислоты
дегидроаскорбиновой), а реагент
восстанавливается .
Титрант - раствор калия йодата (KIО3) , титруют
в кислой среде разведенной хлороводородной
кислоты в присутствии калия йодида и
индикатора – крахмала до наступления
стойкого слабо-синего окрашивания.
52.
В точке эквивалентности избыточная капляKIО3 взаимодействует с KI. Выделившийся
йод окрасит крахмал в синий цвет.
KIO3 + 5KI + 6HCl → 3I2 + 6KCI + 3H2O
Титрант по ГФ ХI приготовлен с учетом
условных частиц УЧ (1/6 KIO3)
53.
К стех. = 3f экв.= 3 · 1 = 1
1
1 6
2
1
176,13
М. = 2 ·М.м =
= 88,06
2
0,1 * 88,06
Т г/мл =
= 0,008806г/мл
1000
0,5 г – 50,0
х - 10,0
х = 0,1 г
0,1
Vор. =
=11,36мл
0,008806
54.
1в) Если методика количественного определенияпредполагает определение вещества в пробе
жидкой лекарственной формы, которую
помещают в колбу для титрования, то расход
титранта эквивалентен содержанию вещества
в пробе, поэтому сначала делают расчет
теоретического количества вещества в пробе по
технологическим параметрам:
а – V лекарств.формы
х=
x гр – V пробы
а * Vп
V ор. = х / Т
Vк
55.
Раствор кислоты аскорбиновой 5% - 200 мл1. Определяем вид лекарственной формы.
В данном случае – это раствор.
2. Объем лекарственной формы – 200 мл.
( Vобщ = Vлф = 200 мл)
3. Берем объем пробы (Vпр)
Vпр = 1 мл
10,0 – 200 мл
х – 1 мл х = 0,05 - содержание кислоты
аскорбиновой в пробе (1 мл)
56.
2) Второй способ расчета предполагаетпредварительное составление формулы расчета
концентрации (в %) по методике. Затем,
предположив С теоретическую равной в
субстанции 100%, выводим Vтеор.(Vор.)
2а) С%= V * K * T *100%
a
если С=100%, то 100% = V * K * T *100%
a
Vор = а * 100
а
Т
Т * 100
К – поправочный коэффициент в знаменателе
игнорируем, если нет указаний в методике (К=1)
57.
2б) С%= V * T * Vкa * Vп
*100%
если С теор.= 100%, то 100% =
Vор=
V * Т * Vк
*100%
а * Vп
а * Vп *100
а * Vп
Т * Vк *100
Т * Vк
Если титрование обратное, то рассчитывают по
этим формулам разность объемов, т.е тот объем
титранта который израсходован на реакцию с
определяемым веществом (хлоралгидрат)
58.
При использовании метода рефрактометрииРефрактометрия- метод определения
показателя преломления , основанный на
преломлении световых лучей на границе
раздела двух различных оптических сред.
59.
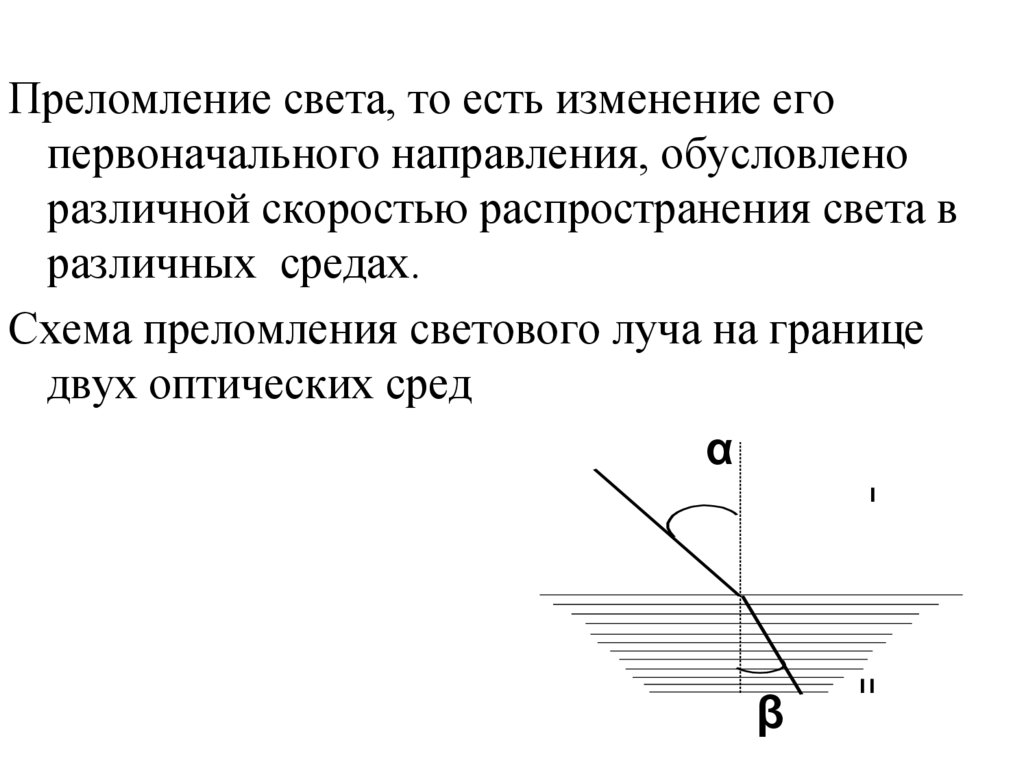
Преломление света, то есть изменение егопервоначального направления, обусловлено
различной скоростью распространения света в
различных средах.
Схема преломления светового луча на границе
двух оптических сред
α
I
β
II
60.
В среде оптически менее плотной (I, напримервоздух) скорость распространения света больше,
чем в более оптически плотной (II, например,
раствор анализируемого вещества). При этом
угол падения - α (и соответственно sin α)
больше угла преломления – β (соответственно
sin β).
Исходя из вышесказанного, отношение синуса
угла падения светового луча к синусу угла
преломления для данной длины волны есть
величина постоянная, не зависящая от угла
падения, называемая показателем преломления
(n).
61.
Показатель преломления можно такжерассматривать как отношение скоростей
распространения света, например в воздухе (V1)
и испытуемом растворе (V2):
sin α
V1
n = ------- = --------sin β
V2
Поскольку скорость распространения света в среде
менее оптически плотной больше, чем в более
оптически плотной, то показатель преломления
всегда больше единицы.
Абсолютный показатель преломления –
отношение скоростей распространения света в
вакууме и испытуемом растворе.
62.
В лабораторных условиях обычноопределяют так называемый
относительный показатель преломления
вещества по отношению воздуху
помещения, где ведется измерение.
20
t
n D = nD- (20 - t) . 0,0002
Метод используют для растворов с
концентрацией не менее 3%
63.
- расчет концентрации растворенноговещества в растворе
С% =(n-n0) / F (скелет формулы)
Где n(nх)-показатель преломления раствора;
n0-показатель преломления растворителя
(воды 1,333);
С-концентрация растворенного вещества в
массо-объемных процентах;
F-фактор прироста показателя преломления
растворенного вещества при увеличении
концентрации на 1%, величина которого
приводится в рефрактометрических таблицах
ГФ, прик. или экспериментально рассчитывают.
64.
Для определения содержания вещества вграммах в жидкой лекарственной форме
Х= (n - n0) · Vлф
F ·100%
65.
в порошках и таблеткахХ= (n-n0) · Vразв · Рср
F · а · 100%
где а- масса навески анализируемого сложного
порошка в г, взятая для приготовления
раствора;
V-объем раствора, приготовленного для
рефрактометрического анализа, мл;
Р -масса анализируемого порошка (развеска)
или средняя масса таблетки,г;
66.
в могокомпонентных лек. смесяхКонцентрацию % одного из ингредиентов
многокомпонентного раствора
С1= n – (n0 +С2·F2 +С3·F3 +… +Сn· Fn)
F1
где С2, С3, Сn - концентрации ( в %) остальных
компонентов, найденные титриметрически или
иными методами.
Пересчет на граммы и лекарственные формы
(растворы, порошки, таблетки и т.д.) аналогично
однокомпонентным.
67.
При использовании метода поляриметрииПоляриметрия – физический метод определения
угла вращения, основанный на свойстве
оптически активных веществ вращать
(отклонять) плоскость поляризации
прямолинейно поляризованного света.
Поляризованный свет можно получить, пропустив
луч света через призму Николя (поляризатор
прибора), представляющий собой
соответствующим образом подготовленный
кристалл исландского шпата (кальцита).
68.
Оптическая активность связана с асимметриеймолекулы, то есть с наличием в ней атомов и
групп атомов, которые могут быть различным
образом расположены в пространстве.
Оптически активным центром
является атом углерода (другие атомы не
рассматриваются) с четырьмя различными
заместителями, получивший название
асимметрического. В формуле ЛВ обычно
обозначают звездочкой (*). Вместо понятия
асимметричности чаще используют термин
хиральность (греч. хиро-рука)
69.
70.
Для сравнительной оценки способностиразличных веществ вращать плоскость
поляризации вычисляют удельное
вращение, которое обозначают знаком [α] и
также выражают в градусах со знаком плюс
или минус.
– это константа оптически активного
вещества.
Удельным вращением называют угол
поворота плоскости поляризации,
вызванный слоем вещества толщиной 1
дм при пересчете на содержание 1 г
вещества в 1 мл объема.
Для жидких индивидуальных веществ
удельное вращение определяют по
формуле
71.
[α]D20 = α · 100 для растворов ЛВС% · l
[α]D20 = α для жидких ЛВ
ρ·l
α - угол вращения
[α]D20 – удельное вращение
l – длинна кюветы (толщина слоя) в дециметрах
С% - концентрация раствора в %
ρ – плотность жидкого ЛВ
72.
расчет концентрации лекарственного веществав растворе
С% = α · 100
[α]D20· l
Для определения содержания вещества
в граммах на 1 мл
Сг/мл = α · 1мл
[α]D20· l
в жидкой лекарственной форме
Сг/Vлф = α · Vлф
[α]D20· l
73.
В основе расчетов в фотометрических методахлежит объединенный закон светопоглощения
Бугера-Ламберта-Бера, Величина оптической
плотности прямопропорциональна
концентрации, показателю поглощения
(удельному или молярному) и толщине слоя
кюветы:
I0
D = lg
= Сх(%) ∙ Е1%1см ∙ l
I
При определении количественного содержания
индивидуальных веществ часто используют
стандартные образцы, содержание которых
принимается за 100%
74.
Спектрофотометрия – это метод, основанный наизмерении оптической плотности
(светопоглощения) монохроматического
излучения (при строго определенной длине
волны) в УФ, в видимой областях спектра за
счет наличия в органических веществах
хромофорных групп (максимумы поглощения).
СФМ в УФ-области способы расчета
концентрации
• по стандартному раствору
• по удельному показателю поглощения
• по калибровочному графику
75.
Способы расчета концентрации в ФЭКи СФМ в В-области
•по стандартному раствору
•по калибровочному графику
76. Формулы расчета концентрации Сх при использовании РСО (раствора стандартного образца) C0
Из закона Бугера-Ламберта-Бера следуетD х = D0
С х = Dх · C 0
Сх
C0
D0
,где
Dх - оптическая плотность испытуемого раствора
(последнего разведения);
D0- оптическая плотность раствора стандартного
образца;
Сх - концентрация испытуемого раствора;
C0 - концентрация раствора стандартного образца
в % или г/мл.
77.
С% = Dх · C0(%) · Vк1 · Vк2.
D0
· а · Vпр
1
2
3
1 часть – основа закона Б– Л – Б
2 часть – учет разведения (колбы, пипетки),
где а – навеска сухого вещества в граммах,
порошка таблеток или объем раствора в мл, взятый
для анализа
Vк1, Vк2 – объем разведения (1колбы и 2
колбы)
Vпр –объем пробы (пипетки) взятой из 1
разведения (Vк1) для приготовления 2 разведения
(Vк2 )
3 часть –пересчет на лекарственную форму
78.
– Если C0(%) РСО для субстанции (порошка)С% =
Dх · C0(%)
· Vк1 · Vк2
|
D0
· а· Vпр
|
– Если C0(%) РСО для таблеток,
где Рср.– средний вес таблетки
Сг/табл =
Dх · C0(%)
D0
· Vк1 · Vк2
· Рср.
| · а· Vпр | · 100%
– Если C0(г/мл) РСО для таблеток
Сг/табл=
Dх · C0(г/мл)
D0
· Vк1 · Vк2
| · а· Vпр |
· Рср.
79. Формулы расчета концентрации Сх при использовании удельного показателя поглощения Е1%1см
Согласно закону Бугера-Ламберта-Беравеличина оптической плотности
прямопропорциональна концентрации,
показателю поглощения (удельному или
молярному) и толщине слоя кюветы
Dх = Сх(%) ∙ Е1%1см ∙ l
Е1%1см (константа) Удельный показатель
поглощения – это оптическая плотность
раствора, содержащего 1,0г вещества в 100
мл (1%) раствора при толщине слоя 1 см.
80.
если l =1 см, то Dх = Сх(%) ∙ Е1%1см– для субстанций
Сх(%) = Dх .
Е1%1см
– для таблеток
Сг/табл=
Dх
Е1%1см
1
|
· Vк1 · Vк2
· Рср.
· а· Vпр
| · 100%
2
3
81.
Спектрофотометрия – это метод, основанный на насвойстве и измерении избирательного
светопоглощения монохроматического излучения
при строго определенной длине волны в УФ, в
видимой или ИК областях спектра.
- УФ-спектрофотометрия (200-400 нм);
- Фотометрия в видимой области спектра (400-800
нм);
- ИК-спектрофотометрия (2-15 мкм; 4000-400 см-1).
ФЭК-метод основан на свойстве окрашенных
растворов поглощать полихроматический свет в
видимой области спектра.







































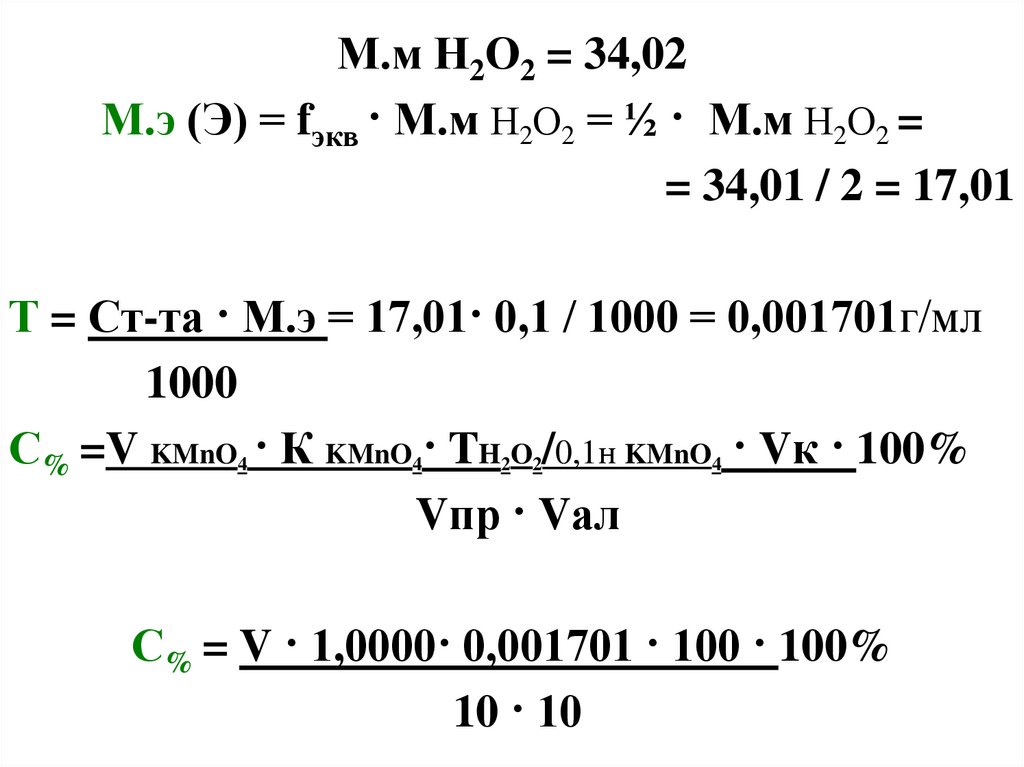










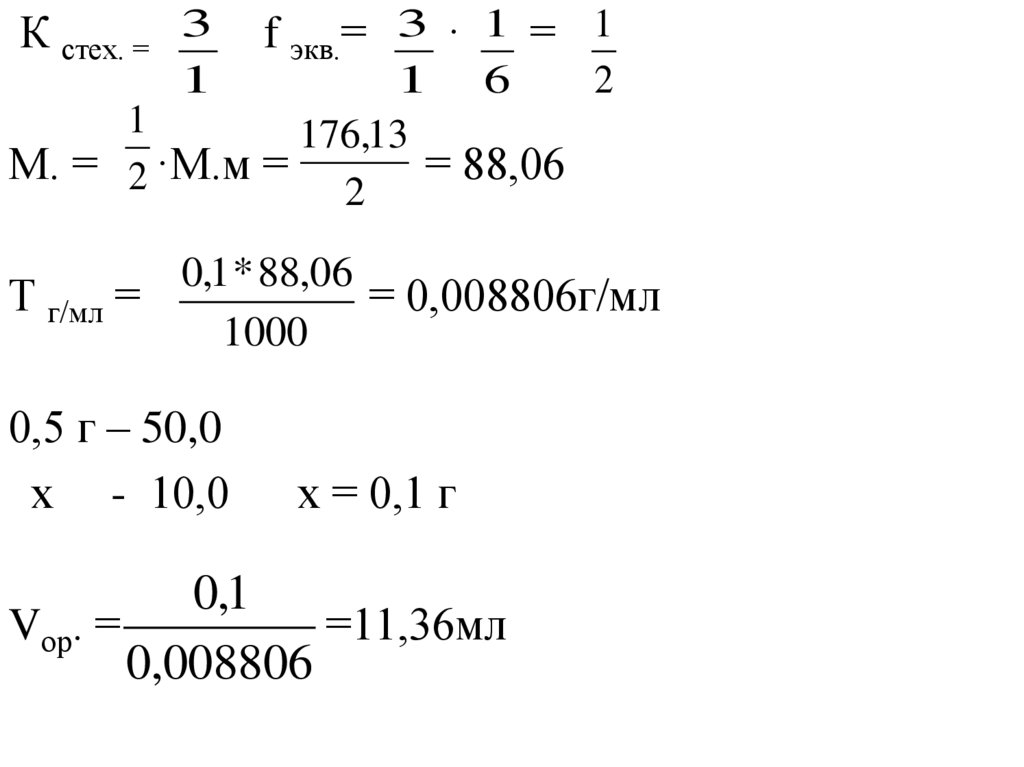



























 medicine
medicine chemistry
chemistry








