Similar presentations:
Серная кислота. Сульфаты
1.
СЕРНАЯКИСЛОТА.
СУЛЬФАТЫ
2.
Серная кислота является важнейшим кислородсодержащим соединениемсеры.
Химически чистая серная кислота
— бесцветная густая тяжёлая
жидкость, неограниченно растворимая в воде. При растворении
концентрированной серной кислоты в воде выделяется очень большое
количество теплоты. Чтобы избежать разбрызгивания, следует соблюдать
правило: нельзя лить воду в концентрированную серную кислоту!
Следует осторожно вливать кислоту в воду при непрерывном
перемешивании.
Более 70% - концентрированная серная кислота; менее 70% разбавленная серная кислота.
Серная кислота (H2SO4) обладает характерными свойствами кислот и
является сильным окислителем.
3.
Химические свойства разбавленной серной кислоты. Разбавленная сернаякислота — сильный электролит, она проявляет общие свойства кислот: меняет цвет
индикаторов и образует соли в реакциях с металлами, основными и амфотерными
оксидами, гидроксидами металлов, другими солями. Рассмотрим конкретные
примеры.
1. Индикаторы лакмус и метилоранж окрашивают раствор серной кислоты в
красный цвет. В разбавленных растворах серная кислота диссоциирует согласно
схеме:
H2SO4=2H++SO422. Образование солей:
а) металлы, расположенные в ряду активности до водорода, вытесняют его из
разбавленных растворов серной кислоты:
Zn + Н2SO4 = ZnSO4 + H2↑
Fe + Н2SO4 = FeSO4 + H2↑;
б) реакции серной кислоты с основными и амфотерными оксидами, как правило,
требуют небольшого нагревания для увеличения скорости:
СuO + Н2SO4 = CuSO4 + H2O;
Al2O3 + 3Н2SO4 = Al2(SO4)3 + 3H2O
4.
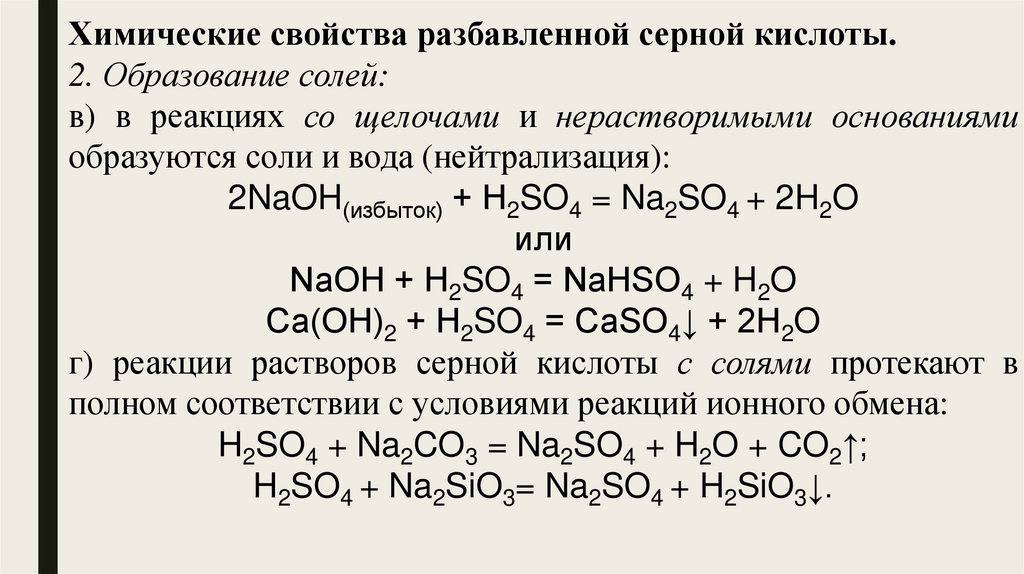
Химические свойства разбавленной серной кислоты.2. Образование солей:
в) в реакциях со щелочами и нерастворимыми основаниями
образуются соли и вода (нейтрализация):
2NaOH(избыток) + Н2SO4 = Na2SO4 + 2H2O
или
NaOH + Н2SO4 = NaНSO4 + H2O
Сa(OH)2 + Н2SO4 = СаSO4↓ + 2H2O
г) реакции растворов серной кислоты с солями протекают в
полном соответствии с условиями реакций ионного обмена:
H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑;
H2SO4 + Na2SiO3= Na2SO4 + H2SiO3↓.
5.
Химические свойства концентрированной серной кислоты6.
Сульфаты – соли серной кислоты.Для идентификации (качественного обнаружения)
сульфат-ионов чаще всего используют растворимые соли
бария (ВаСl2 или Ва(NO3)2). При этом образуется белый
осадок сульфата бария
7.
Сборник задач:№350, №351, №352,
№366
8.
Домашнее задание:параграф 35, №3, №5, №8
страница 196.







 chemistry
chemistry








