Similar presentations:
Серная кислота
1. Серная кислота
2. Физические свойства
При обычных условиях концентрированнаясерная кислота — тяжёлая маслянистая
жидкость без цвета и запаха. При
растворении её в воде происходит очень
сильное разогревание.
3.
Разбавленная сернаякислота обладает
общими свойствами,
характерными для всех
кислот.
4.
• Водный раствор изменяет окраскуиндикаторов :
- лакмус - красный,
- метилоранж - красный,
- фенолфталеин - не изменяет своей
окраски.
5.
Разбавленная серная кислота реагируетс металлами, стоящими в ряду
активности металлов до водорода:
H2SO4+Zn=ZnSO4+H2
6.
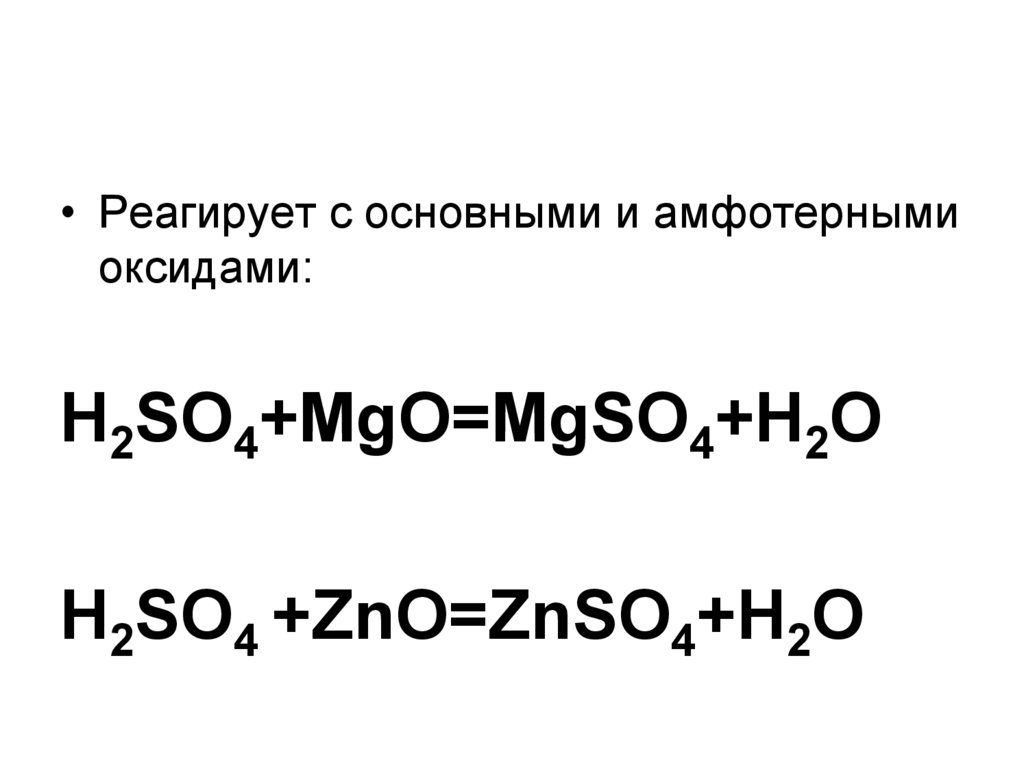
• Реагирует с основными и амфотернымиоксидами:
H2SO4+MgO=MgSO4+H2O
H2SO4 +ZnO=ZnSO4+H2O
7.
• Взаимодействует с основаниями:H2SO4+2KOH=K2SO4+2H2O
8.
Если кислота взята в избытке, тообразуется кислая соль:
H2SO4+NaOH=NaHSO4+H2O
9.
• Реагирует с солями, вытесняя из нихдругие кислоты:
H2SO4+Na2CO3 =Na2SO4+H2O +CO2
10.
Свойстваконцентрированной
серной кислоты
11.
• Концентрированная серная кислотаэнергично реагирует с водой с
образованием гидратов:
H2SO4+nH2O=H2SO4·nH2O+Q
12. -при нагревании она реагирует со всеми металлами ( исключение Au, Pt и нек. др.). В этих реакциях в зависимости от активности
металла иусловий выделяются SO2, H2S, S.
13. Взаимодействие концентрированной серной кислоты с металлами:
H2SO4 + МЕ0 = соль-сульфат + H2O + ?Ряд напряжения металлов:
Li_________________ Zn ______________ H2 ________
H2S↑
H2S↑
S↓
SO2↑
S↓
SO2↑
SO2↑
14.
• Характерной реакцией на сернуюкислоту и её соли является
взаимодействие с растворимыми
солями бария:
H2SO4+BaCl2=BaSO4↓+2HCl
Выпадает белый осадок, который не
растворяется ни в воде, ни в
концентрированной азотной кислоте
15. Применение серной кислоты
в производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах;
для получения различных минеральных кислот и солей;
в производстве химических волокон, красителей,
дымообразующих веществ и взрывчатых веществ;
• в нефтяной, металлообрабатывающей, текстильной,
кожевенной и др. отраслях промышленности;
• в пищевой промышленности — зарегистрирована в
качестве пищевой добавки E513(эмульгатор);
• в промышленном органическом синтезе.
16. Домашнее задание:
1) написать уравнения реакций H2SO4 (разб.) в ионном видес веществами Zn, MgO, ZnO, NaOH, Ca3(PO4)2;
2) написать уравнения реакций взаимодействия
концентрированной серной кислоты с Na и Ag, расставить
коэффициенты методом электронного баланса;
3) по приведенному сокращенному ионному уравнению
Ba+2 + SO42- = BaSO4
восстановите полное ионное и молекулярное уравнения;
4) учебник, параграф 23, стр. 136-140 (до «Производство
серной кислоты»).















 chemistry
chemistry








