Similar presentations:
Серная кислота и ее соли. 9 класс
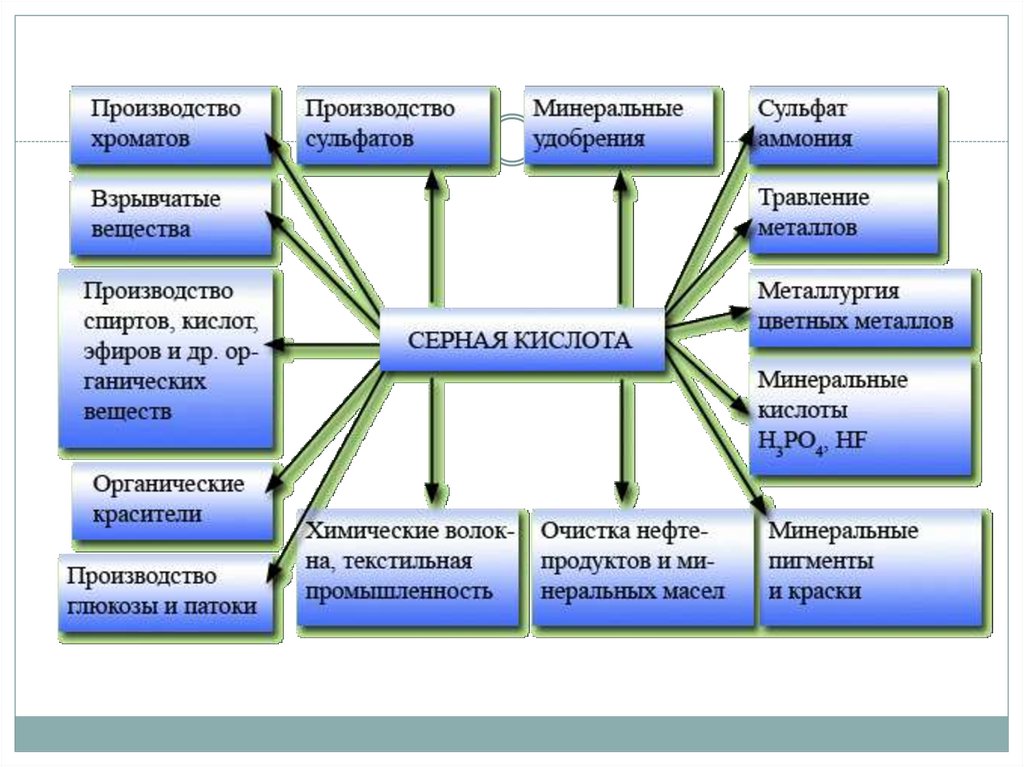
1. Серная кислота и её соли
2.
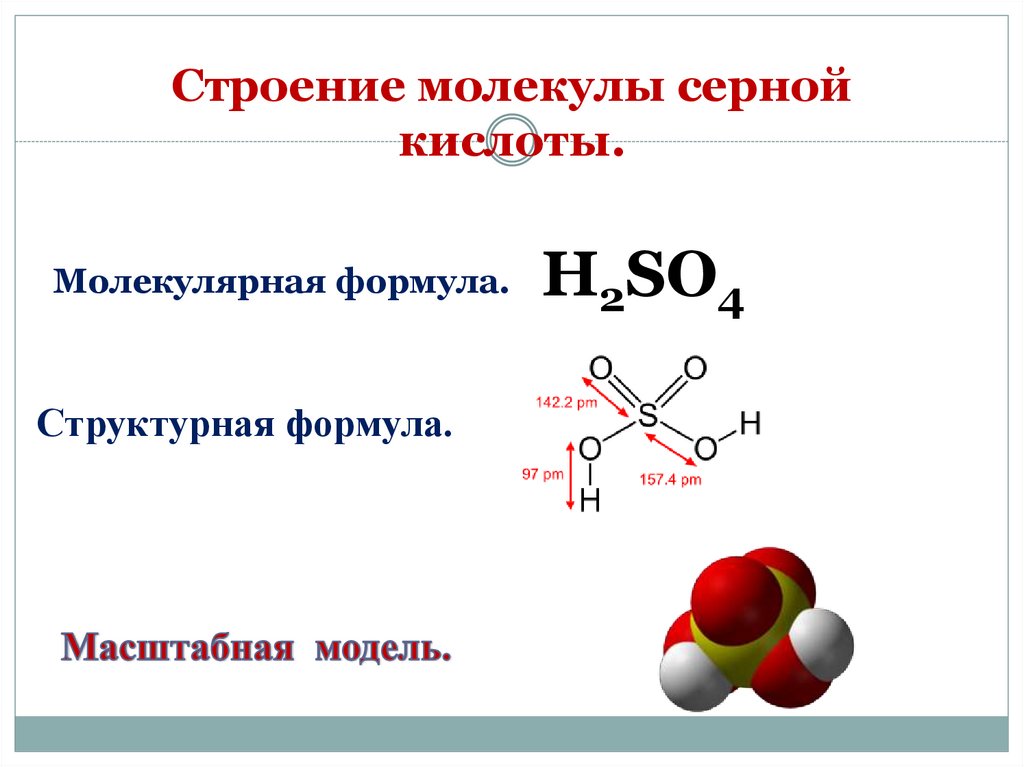
Строение молекулы сернойкислоты.
Молекулярная формула.
Структурная формула.
H2SO4
3. Серная кислота
H2SO4, сильнаядвухосновная кислота.
Безводная серная кислота
бесцветная маслянистая
жидкость, плотность
1,9203 г/см³, tпл 10,3 .С,
tкип 296,2 .С. С водой
смешивается во всех
отношениях.
4. Получение серной кислоты
FeS2S
SO2 → SO3 → H2SO4
H2S
Пирит
Серный колчедан
5. Получение серной кислоты
6.
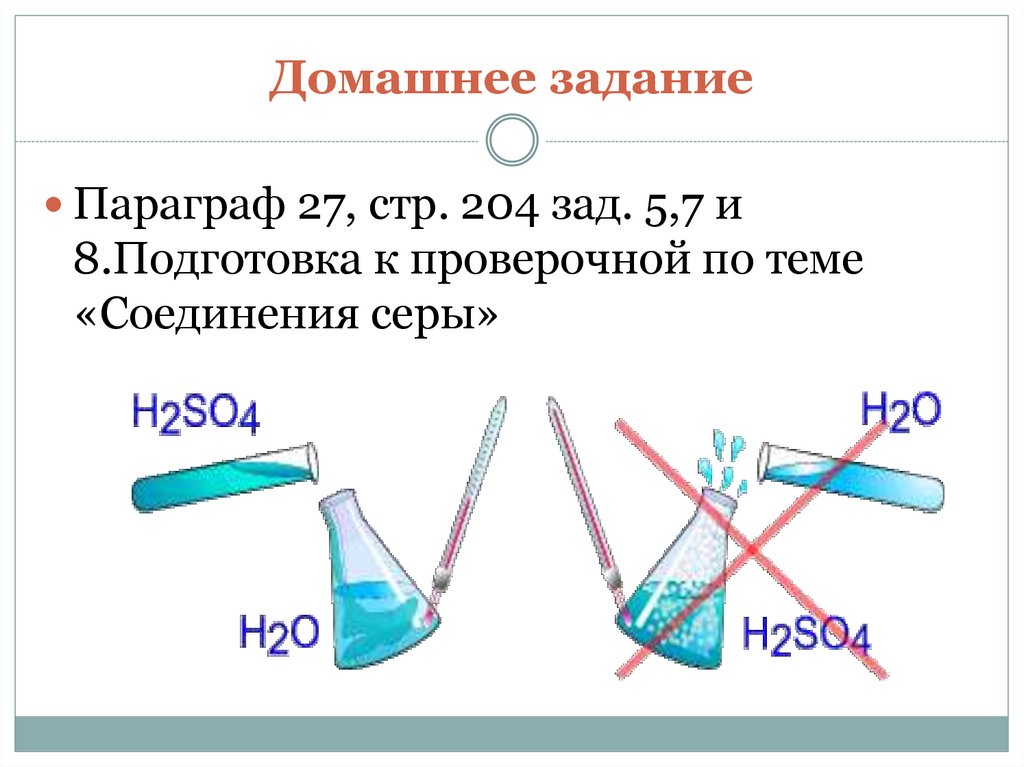
Правило разбавления кислотhttp://files.school-collection.edu.ru/dlrstore/6ae368db-1a38-5b5c-82c3aadd474e4be6/index.htm
Сначала вода, потом кислота –
иначе случится большая беда!
7.
Водоотнимающее свойствоH2SO4
http://files.school-collection.edu.ru/dlrstore/7c646dda-e274-b217-58cf1668d25430fb/index.htm
8.
Разрушающее действиеконцентрированной серной кислоты
(обугливание древесины)
http://files.school-collection.edu.ru/dlrstore/e5984256-0b18-c23b-985b397af5d9adbe/index.htm
9.
Химические свойства разбавленнойсерной кислоты
1) Взаимодействие с металлами ( до Н2 )
Zn + H2SO4 → ZnSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
10.
Взаимодействие конц.H2SO4с металлами
http://files.school-collection.edu.ru/dlrstore/9a897ea8-64e1-3877-def6aba916d777ee/index.htm
11.
2) Взаимодействиес оксидами металлов
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2H+ → Zn2+ + H2O
12.
3) Взаимодействие с основаниями2NaOH + H2SO4 → Na2SO4 +2 H2O
H+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2H+ → Zn2+ +2H2O
13.
4) Взаимодействие с солямиK2CO3 + H2SO4 = K2SO4 + H2CO3
2H++ CO32- = H2O + CO2
CO2↑
H2O
14.
Качественная реакцияMgSO4+BaCl2→BaSO4↓+ MgCl2
Ba2++SO42- = BaSO4
Белый молочный
осадок
http://files.school-collection.edu.ru/dlrstore/d8932e1e-fc13-f1de-2ace288cbf49a4db/index.htm
15. Концентрированная серная кислота
Концентрированная серная кислота-довольно сильный окислитель, особенно
при нагревании.; окисляет HI и частично
НВг до свободных галогенов, углерод - до
СО2, S-до SO2, окисляет многие металлы
Сu, Hg и др.).
C +2H2SO4 =2SO2 + CO2 +2H2O
16.
Продуктами восстановления кислоты обычноявляется оксид серы (IV), сероводород и сера
(H2S и S) образуется в реакциях кислоты с
активными металлами- магнием, кальцием,
натрием, калием и др.
Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O
Mg + 2H2SO4 = MgSO4 + SO2+ 2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
17.
18. Домашнее задание
Параграф 27, стр. 204 зад. 5,7 и8.Подготовка к проверочной по теме
«Соединения серы»
19.
Кислота - волшебницаhttp://files.school-collection.edu.ru/dlrstore/e4ae4b80-78f8-6aa5-19673de11a099cf3/index.htm
http://files.school-collection.edu.ru/dlrstore/09a73a26-340a-0743-b42dd2372b78657b/index.htm
http://files.school-collection.edu.ru/dlrstore/d52658e3-f16c-5c57-d3822f820fd82d75/index.htm
















 chemistry
chemistry








