Similar presentations:
Серная кислота. Изменение окраски индикатора
1.
МКОУ «Мало-Каменская средняя общеобразовательная школа»Серная
кислота
Работа учителя химии
МКОУ «Мало-Каменская СОШ»
Б-Солдатского р-на Курской области
Пыхтиной Валентины Дмитриевны
.
2017 г.
2.
Изменениеокраски
индикатора
3.
Сернаякислота
4.
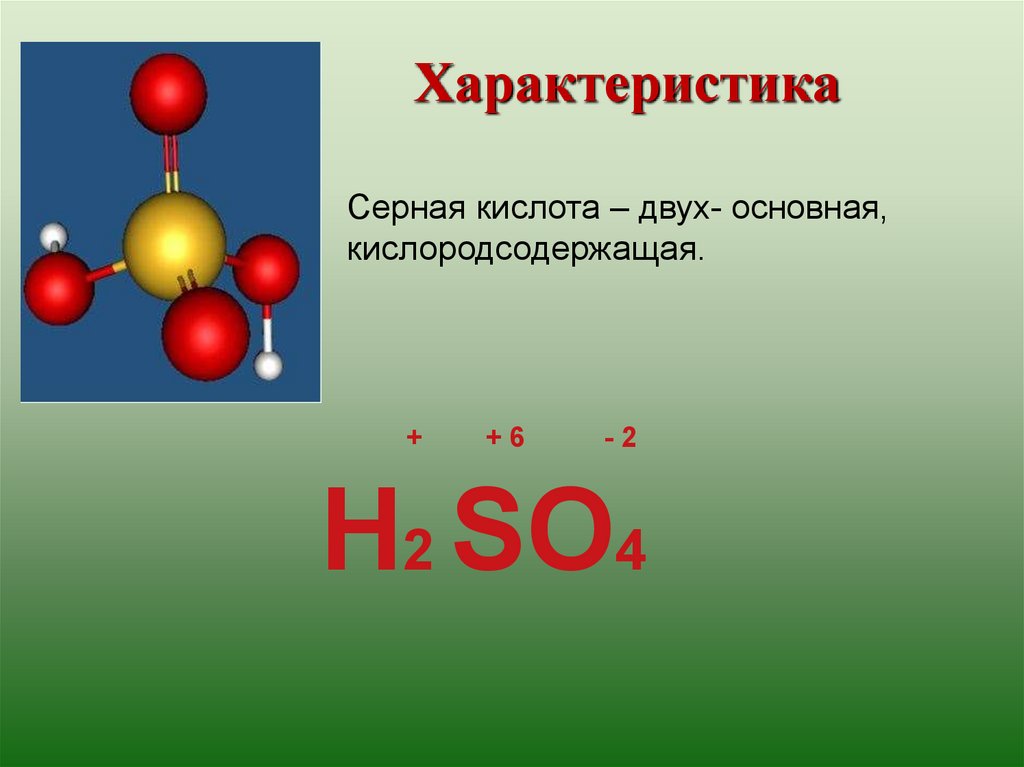
ХарактеристикаСерная кислота – двух- основная,
кислородсодержащая.
+
+6
-2
H2 SO4
5.
Физические свойства серной кислотыБесцветная
маслянистая жидкость
=1,83кг/дм3
Большая вязкость
Обладает сильным
гигроскопическим
свойством
t кип. = 340ºС
6.
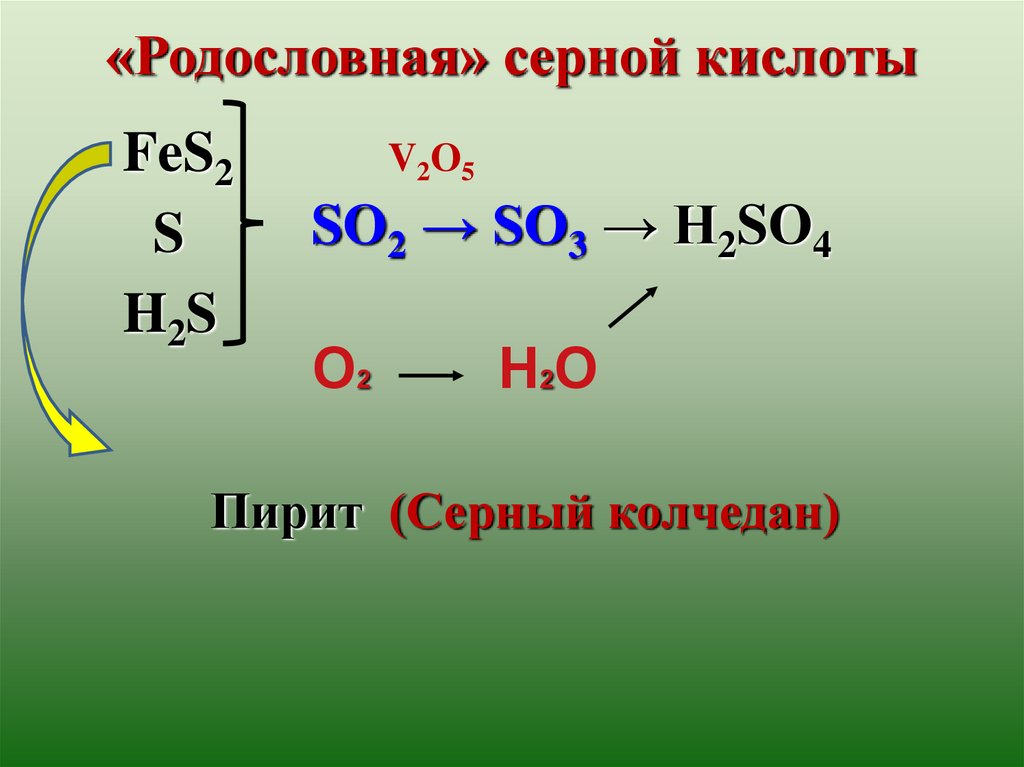
«Родословная» серной кислотыFeS2
S
H2S
V2O5
SO2 → SO3 → H2SO4
О2
Н2О
Пирит (Серный колчедан)
7.
Получение серной кислоты8.
Правило разбавления кислотhttp://files.school-collection.edu.ru/dlrstore/6ae368db-1a38-5b5c-82c3aadd474e4be6/index.htm
Н2О
Сначала вода, потом кислота –
иначе случится большая беда!
9.
Водоотнимающее свойствоH2SO4
http://files.school-collection.edu.ru/dlrstore/7c646dda-e274-b217-58cf1668d25430fb/index.htm
10.
Разрушающее действиеконцентрированной серной кислоты
(обугливание древесины)
http://files.school-collection.edu.ru/dlrstore/e5984256-0b18-c23b-985b397af5d9adbe/index.htm
11.
I. Химические свойства разбавленнойсерной кислоты
Взаимодействие с металлами ( до Н )
Zn + H2SO4 → ZnSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
12.
Взаимодействие конц.H2SO4с металлами
http://files.school-collection.edu.ru/dlrstore/9a897ea8-64e1-3877-def6aba916d777ee/index.htm
13.
Окислительные свойства конц. H2SO4H2SO4(конц.)
H2S
+ M → M2(SO4)n + S
SO2
+ H 2O
Cu + H2SO4 → SO2 + CuSO4 + H2О
Cu0 + H2S+6O4 → S+4O2 + Cu+2SO4 + H2О
Cu0 - 2е → Cu+2
S+6 + 2е→ S+4
2
1 восстановитель
2
1 окислитель
Cu0 + 2H2S+6O4 → S+4O2 + Cu+2SO4 + 2H2О
14.
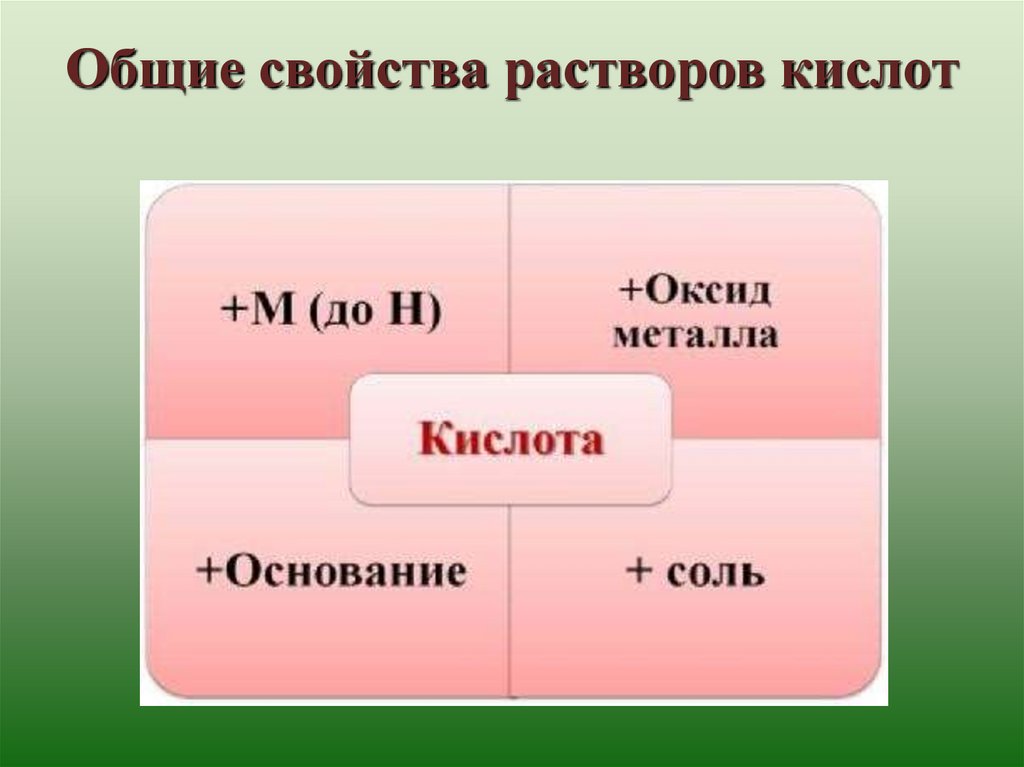
Общие свойства растворов кислот15. физкультминутка
Очень химию мы любим!Шеей влево, вправо крутим.
Воздух – это атмосфера, если правда, топай
смело.
В атмосфере есть азот, делай вправо поворот.
Также есть и кислород, делай влево поворот.
Воздух обладает массой, мы попрыгаем по
классу.
К учителю повернемся и дружно улыбнемся!
16.
Окислительные свойстваПри нагревании концентрированная серная кислота
может окислять отдельные неметаллы, а также
различные неорганические вещества проявляющие
восстановительные свойства.
S + H2SO4 = SO2 + H2O
д/з
C + H2SO4 = SO2 + H2O + CO2
NaBr + H2SO4 = Br2 + H2O + SO2 + Na2SO4
17.
Взаимодействиес оксидами металлов
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2H+ → Zn2+ + H2O
18.
Взаимодействие с основаниями2NaOH + H2SO4 → Na2SO4 +2 H2O
H+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2H+ → Zn2+ +2H2O
19.
Взаимодействие с солямиK2CO3 + H2SO4 = K2SO4 + H2CO3
2H++ CO32- = H2O + CO2
CO2↑
H2O
20.
Качественная реакцияMgSO4+BaCI2→BaSO4↓+ MgCI2
Ba2++SO42- = BaSO4
Белый молочный
осадок
http://files.school-collection.edu.ru/dlrstore/d8932e1e-fc13-f1de-2ace288cbf49a4db/index.htm
21.
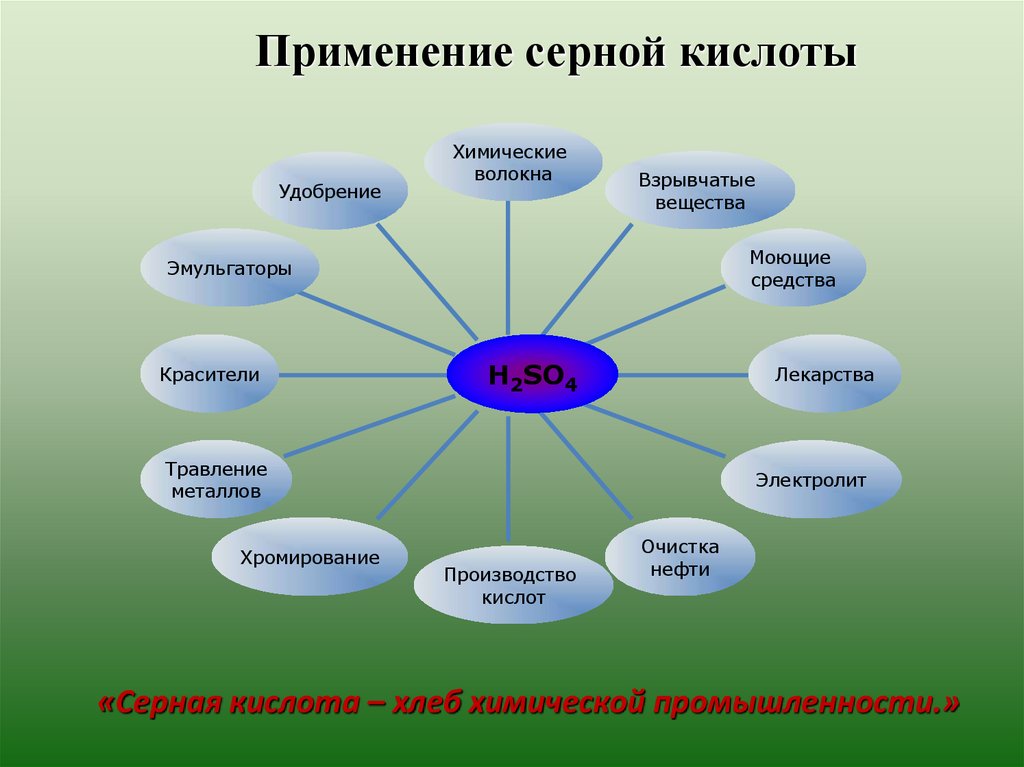
Применение серной кислотыУдобрение
Химические
волокна
Взрывчатые
вещества
Моющие
средства
Эмульгаторы
Красители
H2SO4
Лекарства
Травление
металлов
Хромирование
Электролит
Производство
кислот
Очистка
нефти
«Серная кислота – хлеб химической промышленности.»
22.
Кислота - волшебницаhttp://files.school-collection.edu.ru/dlrstore/e4ae4b80-78f8-6aa5-19673de11a099cf3/index.htm
http://files.school-collection.edu.ru/dlrstore/09a73a26-340a-0743-b42dd2372b78657b/index.htm
http://files.school-collection.edu.ru/dlrstore/d52658e3-f16c-5c57-d3822f820fd82d75/index.htm
23.
Выводы:разбавленная H2SO4 обладает общими свойствами всех кислот;
разбавленная H2SO4 – окислитель при взаимодействии с металлами
(Н+);
чистая H2SO4 и H2SO4 в конц. растворах сильный окислитель (S+6);
чистая H2SO4 не реагирует с благородными металлами (Au, Pt) и с Al,
Cr, Fe из-за пассивации;
конц. H2SO4 окисляет некоторые неметаллы (C, S, P) до высшей с.о.;
конц. H2SO4 взаимодействует с металлами (в том числе Cu, Ag, Hg),
стоящими в ряду напряжений после водорода;
активные металлы восстанавливают H2SO4 до H2S (щ. и щ/з);
от Zn до Н – до S;
с малой активностью до SO2;
H2SO4 сильный дегидратирующий агент (меры предосторожности);
бурно реагирует с водой (правило разбавления);
будучи нелетучей кислотой, H2SO4 способна вытеснять другие
кислоты из их солей.
24.
Домашнее задание§ 23, упр. 3,8
задание в тетради,
индивидуальное задание





















 chemistry
chemistry








