Similar presentations:
Серная кислота и её соли
1.
Серная кислотаи её соли
2.
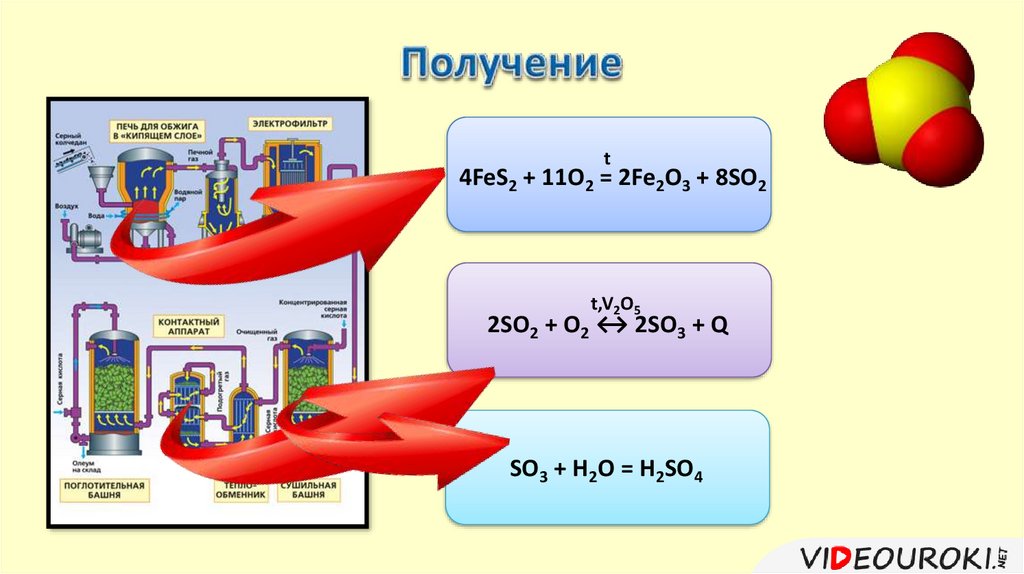
1) Получение из сырья оксида серы (IV).t
S + O2 = SO2
t
2H2S + 3O2 = 2SO2 + 2H2O
t
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
3.
2) Окисление оксида серы (IV) до оксида серы (VI).+4
0 t,V2O5 +6 -2
2SO2 + O2 ↔ 2SO3 + Q
реакция соединения;
реакция обратимая;
реакция каталитическая;
окислительно-восстановительная
реакция;
реакция гетерогенная;
реакция экзотермическая.
4.
Эта летучая бесцветная жидкость;Имеет удушливый запах;
При растворении в воде образует
серную кислоту.
5.
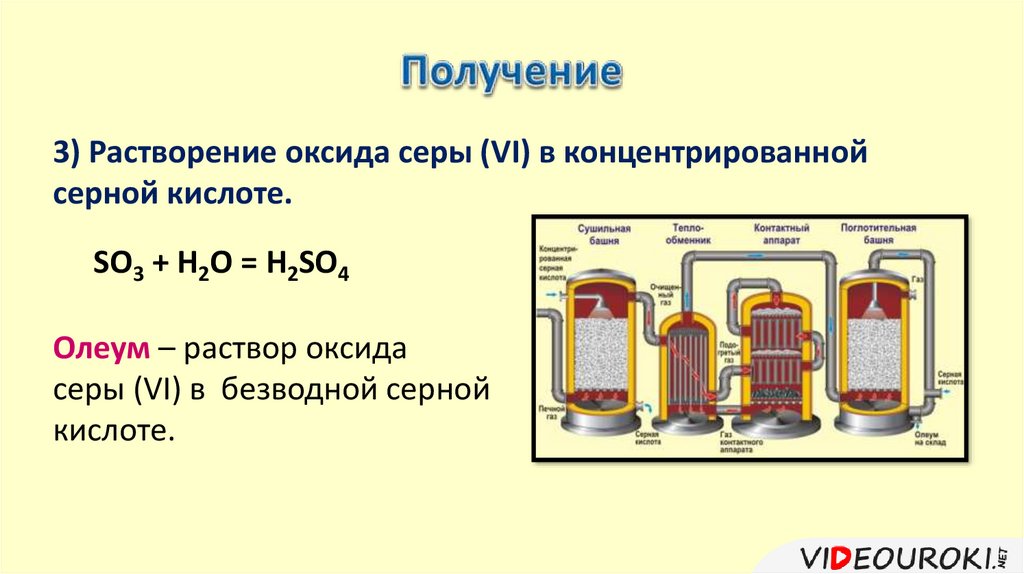
3) Растворение оксида серы (VI) в концентрированнойсерной кислоте.
SO3 + H2O = H2SO4
Олеум – раствор оксида
серы (VI) в безводной серной
кислоте.
6.
t4FeS2 + 11O2 = 2Fe2O3 + 8SO2
t,V2O5
2SO2 + O2 ↔ 2SO3 + Q
SO3 + H2O = H2SO4
7.
8.
Серная кислота – бесцветная маслянистая и тяжёлаяжидкость.
Она обладает сильными гигроскопическими
свойствами.
Её используют для осушения газов или
других веществ.
9.
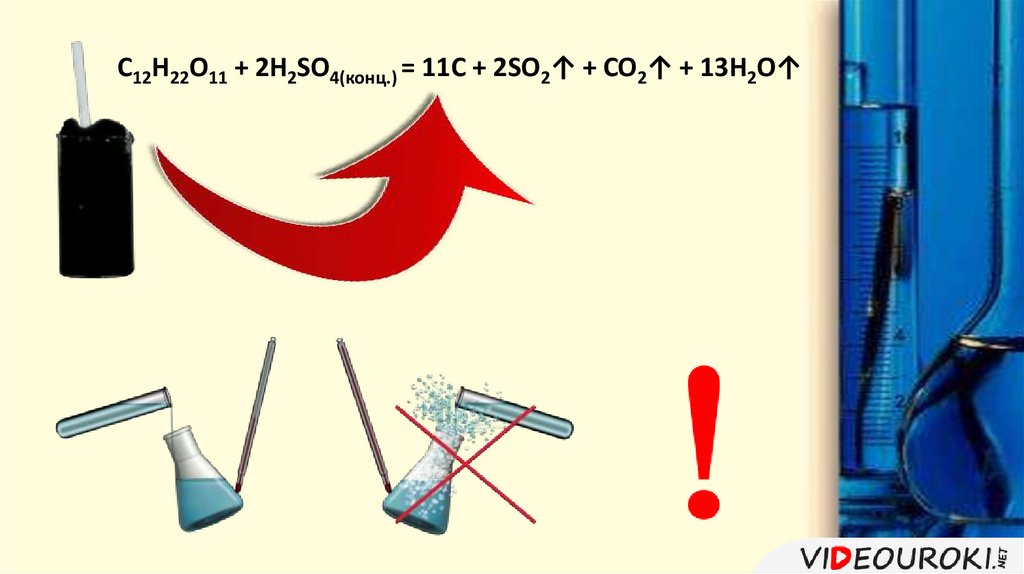
C12H22O11 + 2H2SO4(конц.) = 11C + 2SO2↑ + CO2↑ + 13H2O↑10.
Разбавленная серная кислотаИзменение окраски
индикаторов
Реакции с металлами до
водорода
Лакмус – красный
Метилоранж – красный
11.
Разбавленная серная кислотаИзменение окраски
индикаторов
Реакции с металлами до
водорода
Лакмус – красный
Метилоранж – красный
12.
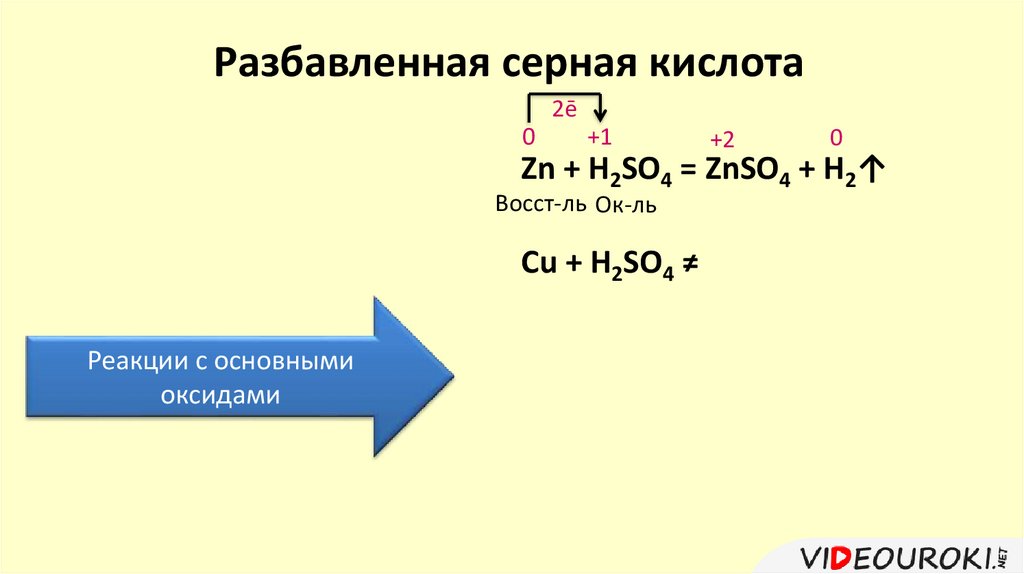
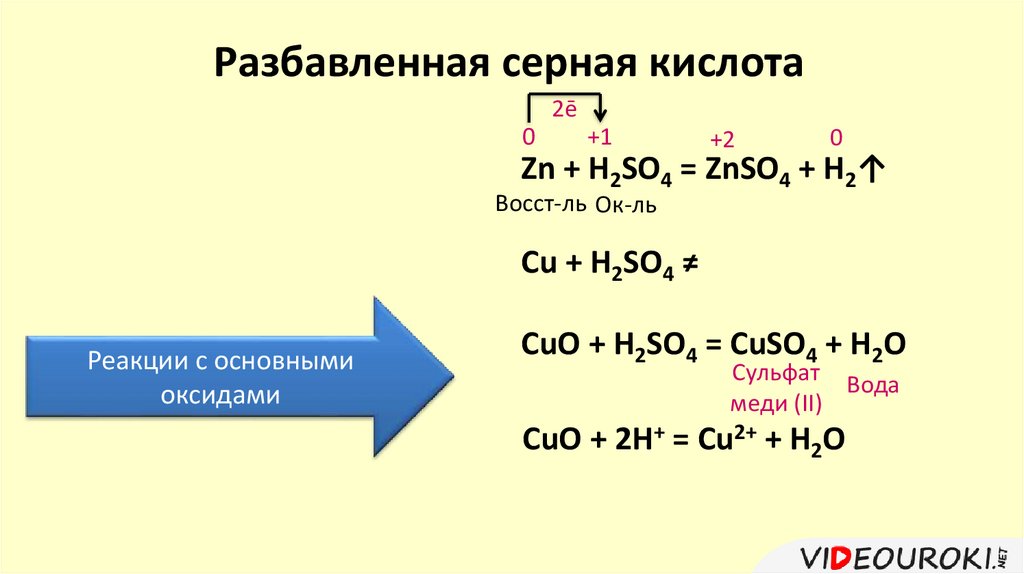
Разбавленная серная кислота2ē
0
+1
+2
0
Zn + H2SO4 = ZnSO4 + H2↑
Восст-ль Ок-ль
Cu + H2SO4 ≠
Реакции с основными
оксидами
13.
Разбавленная серная кислота2ē
0
+1
+2
0
Zn + H2SO4 = ZnSO4 + H2↑
Восст-ль Ок-ль
Реакции с основными
оксидами
14.
Разбавленная серная кислота2ē
0
+1
+2
0
Zn + H2SO4 = ZnSO4 + H2↑
Восст-ль Ок-ль
Cu + H2SO4 ≠
Реакции с основными
оксидами
CuO + H2SO4 = CuSO4 + H2O
Сульфат Вода
меди (II)
CuO + 2H+ = Cu2+ + H2O
15.
Разбавленная серная кислотаРеакции с основаниями
16.
Разбавленная серная кислотаРеакции с основаниями
17.
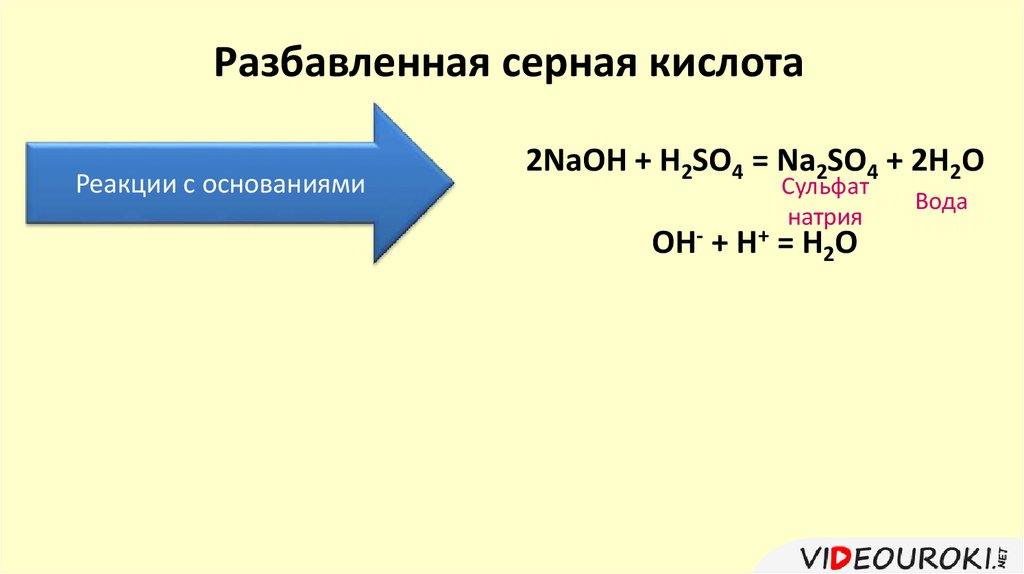
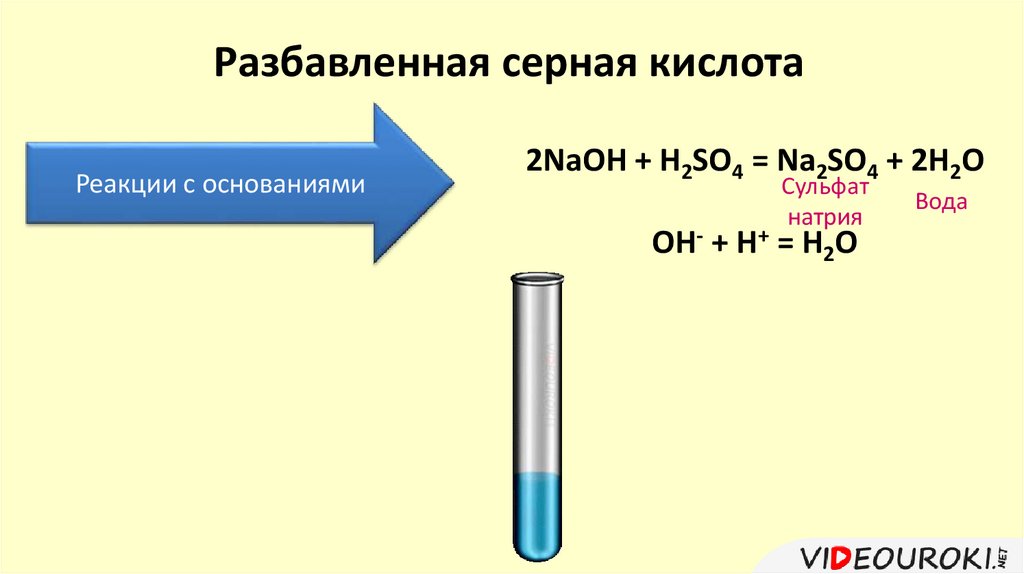
Разбавленная серная кислотаРеакции с основаниями
2NaOH + H2SO4 = Na2SO4 + 2H2O
Сульфат
натрия
OH- + H+ = H2O
Вода
18.
Разбавленная серная кислотаРеакции с основаниями
2NaOH + H2SO4 = Na2SO4 + 2H2O
Сульфат
натрия
OH- + H+ = H2O
Вода
19.
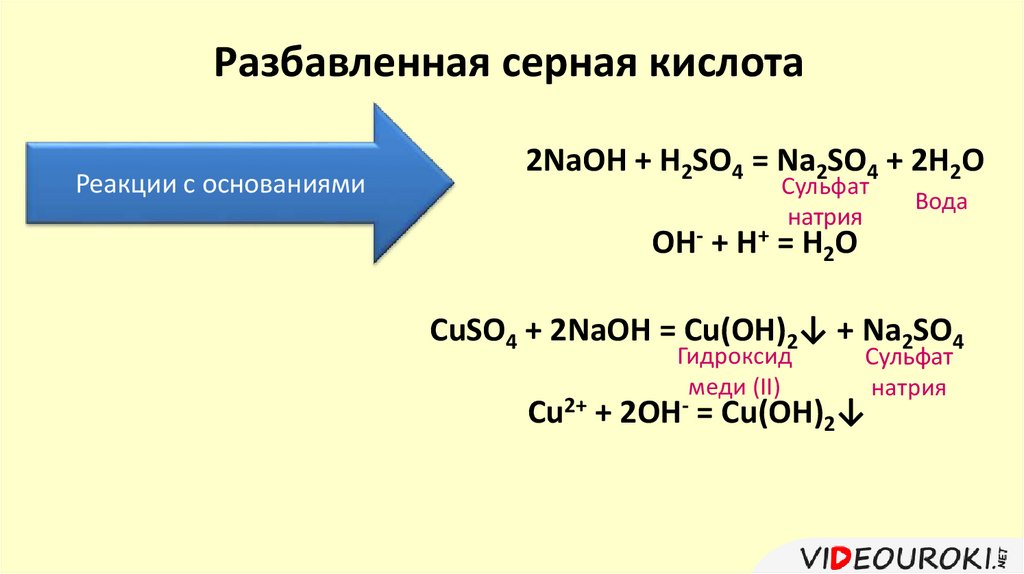
Разбавленная серная кислотаРеакции с основаниями
2NaOH + H2SO4 = Na2SO4 + 2H2O
Сульфат
натрия
Вода
OH- + H+ = H2O
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Гидроксид
меди (II)
Сульфат
натрия
Cu2+ + 2OH- = Cu(OH)2↓
20.
Разбавленная серная кислотаCuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Реакции с основаниями
Гидроксид
меди (II)
Сульфат
натрия
Cu2+ + 2OH- = Cu(OH)2↓
21.
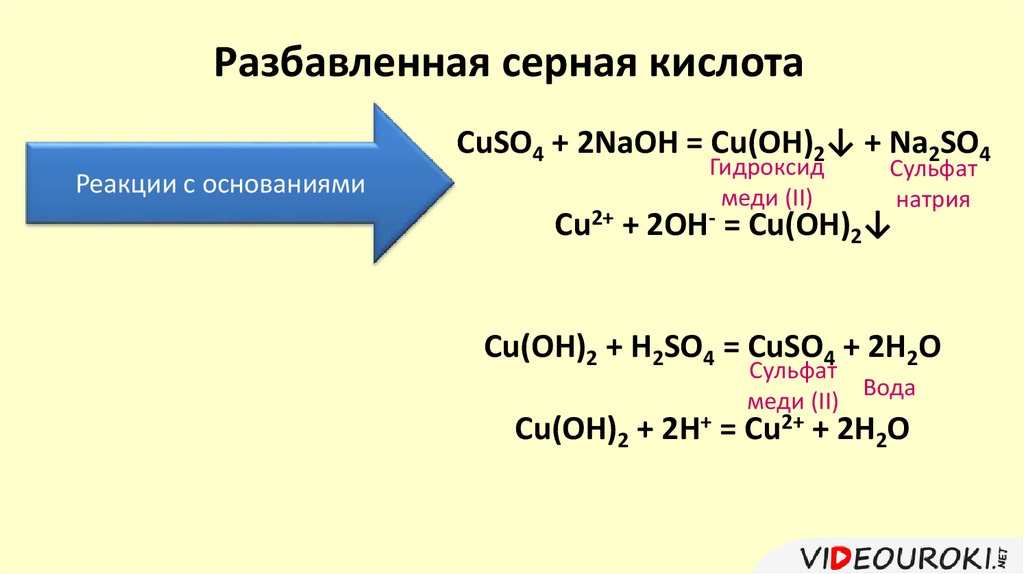
Разбавленная серная кислотаCuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Реакции с основаниями
Гидроксид
меди (II)
Сульфат
натрия
Cu2+ + 2OH- = Cu(OH)2↓
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Сульфат
Вода
меди (II)
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
22.
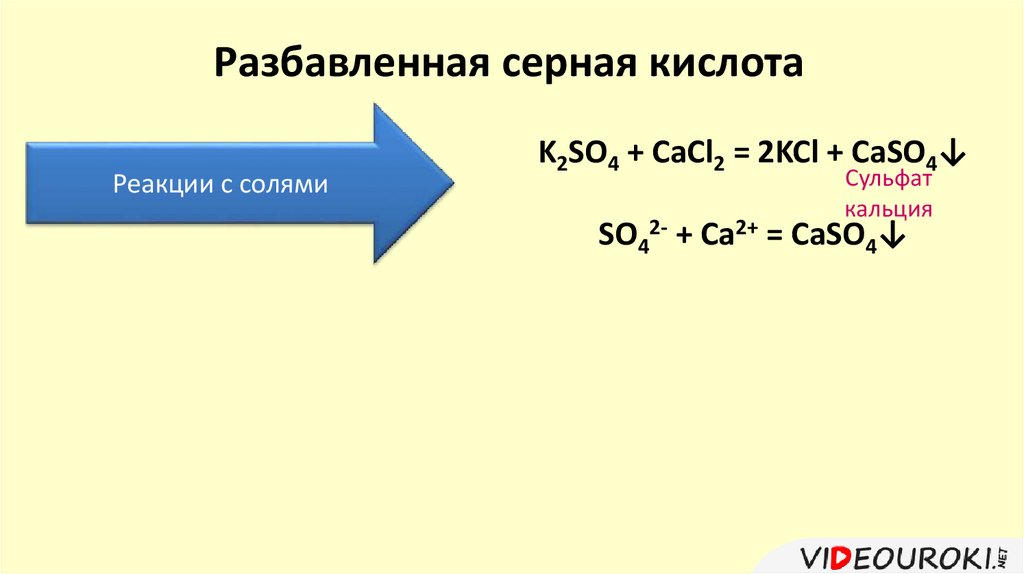
Разбавленная серная кислотаРеакции с солями
23.
Разбавленная серная кислотаРеакции с солями
K2SO4 + CaCl2 = 2KCl + CaSO4↓
Сульфат
кальция
SO42- + Ca2+ = CaSO4↓
24.
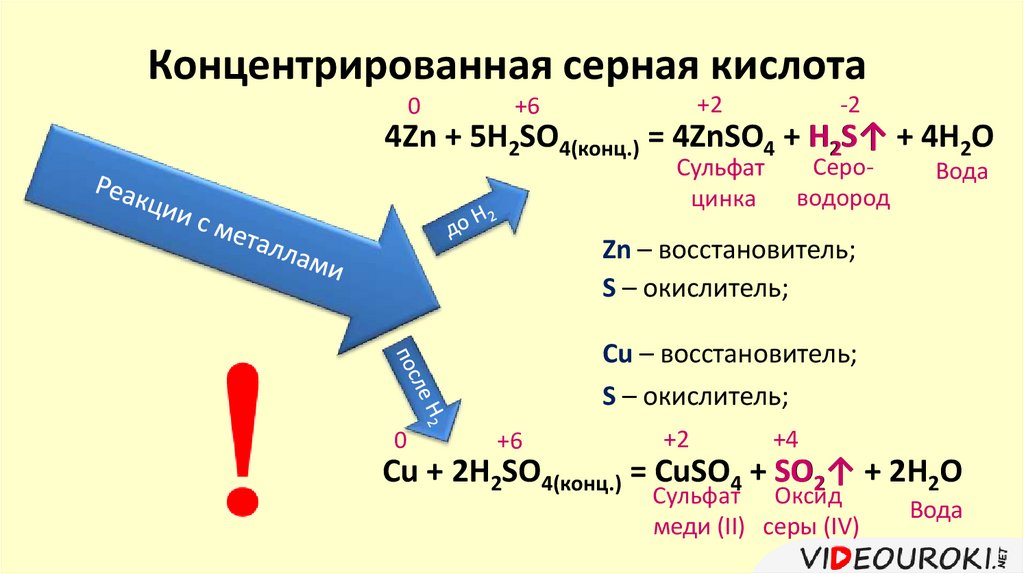
Концентрированная серная кислота0
+2
+6
-2
4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S↑ + 4H2O
Сульфат
цинка
Сероводород
Вода
Zn – восстановитель;
S – окислитель;
Cu – восстановитель;
S – окислитель;
0
+6
+2
+4
Cu + 2H2SO4(конц.) = CuSO4 + SO2↑ + 2H2O
Сульфат Оксид
меди (II) серы (IV)
Вода
25.
Железо и алюминий пассивируютсяконцентрированной серной кислотой.
26.
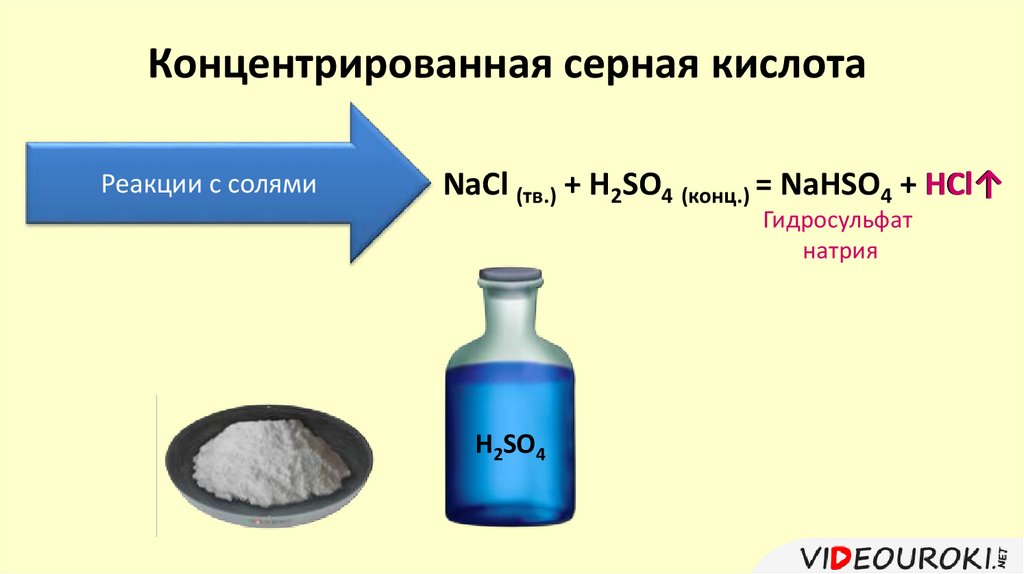
Концентрированная серная кислотаРеакции с солями
NaCl (тв.) + H2SO4 (конц.) = NaHSO4 + HCl↑
Гидросульфат
натрия
H2SO4
27.
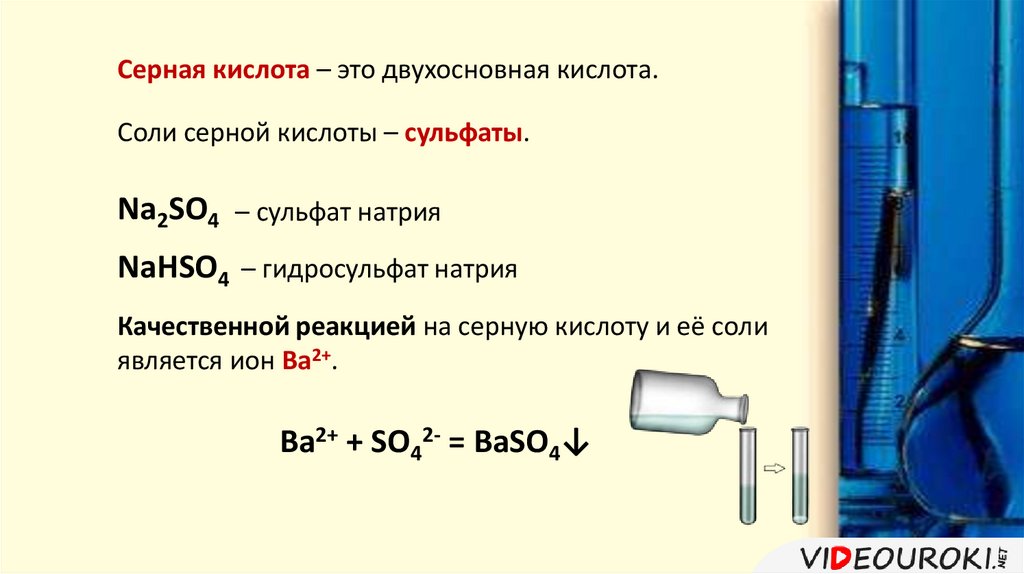
Серная кислота – это двухосновная кислота.Соли серной кислоты – сульфаты.
Na2SO4 – сульфат натрия
NaHSO4 – гидросульфат натрия
Качественной реакцией на серную кислоту и её соли
является ион Ва2+.
Ba2+ + SO42- = BaSO4↓
28.
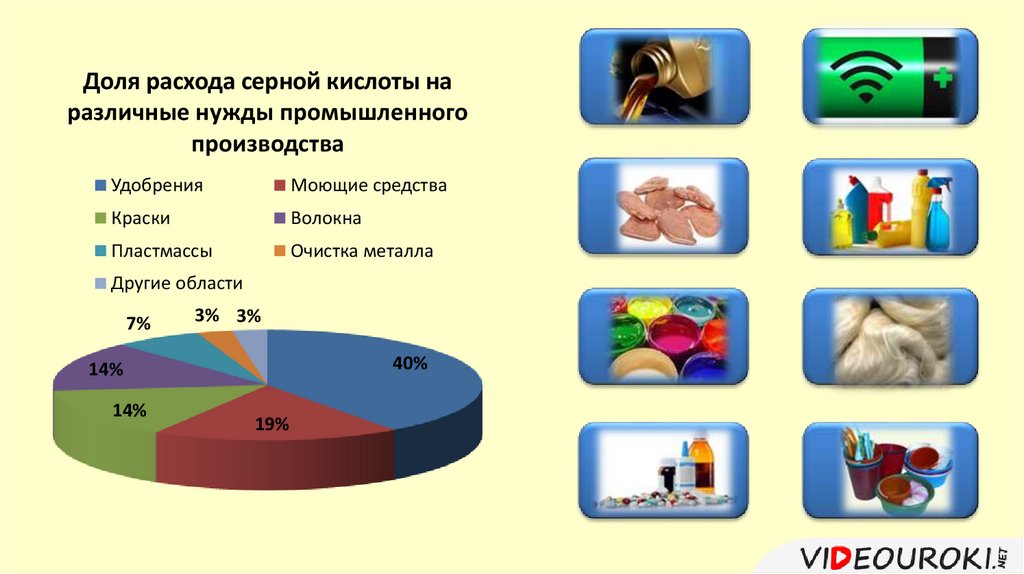
Доля расхода серной кислоты наразличные нужды промышленного
производства
Удобрения
Моющие средства
Краски
Волокна
Пластмассы
Очистка металла
Другие области
7%
3% 3%
40%
14%
14%
19%
29.
Соли серной кислотыГлауберова соль – Na2SO4 · 10H2O
Гипс – CaSO4 · 2H2O
Сульфат бария – BaSO4
Медный купорос – CuSO4 · 5H2O
30.
Серную кислоту получают в три стадии.Серная кислота представляет собой тяжёлую
маслянистую жидкость.
При разбавлении концентрированной кислоты следует
кислоту приливать к воде, а не наоборот.
Разбавленная серная кислота реагирует с металлами до
водорода, основными и амфотерными оксидами, с
основаниями и солями.
31.
Концентрированная серная кислота взаимодействует сметаллами и до водорода и после водорода (кроме
золота и платины), она пассивирует железо и алюминий,
а также реагирует с солями.
Серная кислота и её соединения находят широкое
применение в промышленности.










 chemistry
chemistry








