Similar presentations:
Серная кислота
1.
2.
СОДЕРЖАНИЕХарактеристика кислоты
Физические свойства
Получение
Химические свойства
Соли
Применение
Серная кислота в природе
ВЫВОД
3.
H2SO4Характеристика:
По основности: двухосновная
По наличию кислорода:
кислородосодержащая
По силе: сильный электролит
Это тяжёлая жидкость, которая в
любом соотношении смешивается с
водой, имеет молекулярную решётку и
ковалентную полярную связь
4.
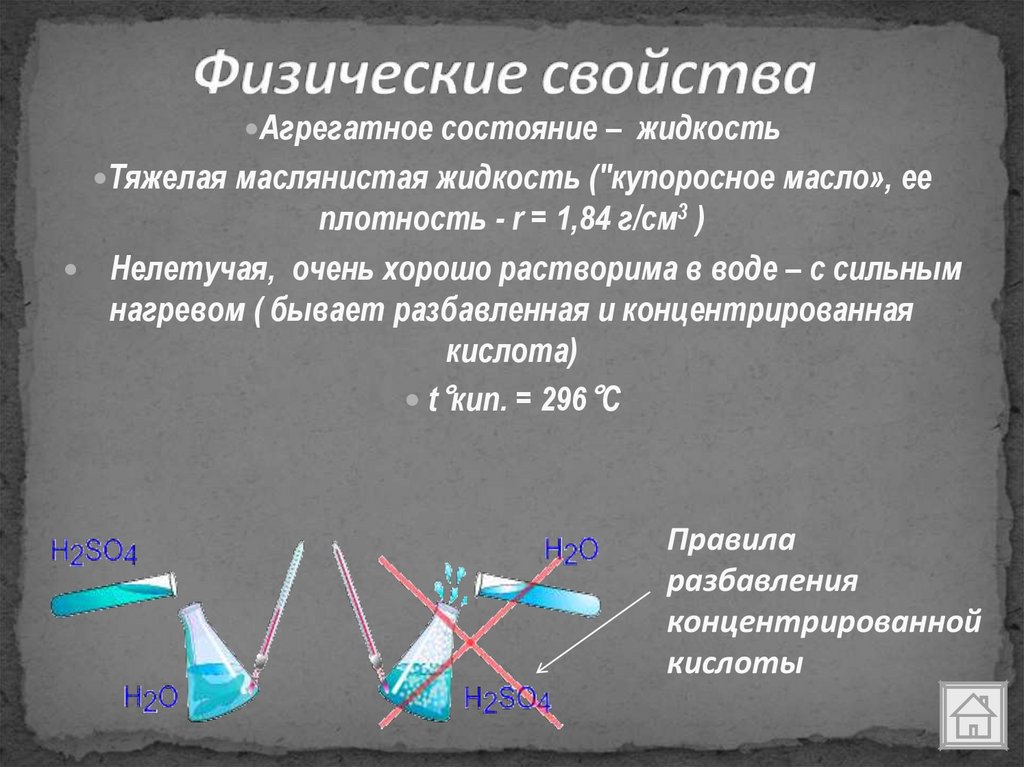
Агрегатное состояние – жидкостьТяжелая маслянистая жидкость ("купоросное масло», ее
плотность - r = 1,84 г/см3 )
Нелетучая, очень хорошо растворима в воде – с сильным
нагревом ( бывает разбавленная и концентрированная
кислота)
t°кип. = 296°С
Правила
разбавления
концентрированной
кислоты
5.
Все, что по серной кислоте узнал –Запомни – это важно,
Чтоб пользоваться ей
Было бы тебе не страшно!
Если вдруг захочешь кислоту ты растворить,
Надо правило важное повторить:
Что при растворении
С веществом случается?
Разогрев произойдет,
Если кто-то вдруг нальет
В воду серной кислоты.
Но не вздумай только ты
Наливать наоборот –
Брызгать кислота начнет.
Объяснения просты:
Как для серной кислоты,
Так и для других кислот:
Здесь реакция пойдет.
6.
Химические свойства H2SO41.С металлами (в ряду активности
металлов до водорода):
H2SO4+Zn=ZnSO4 + H2
2. С оксидами металлов:
H2SO4+K2O=K2SO4+H2O
3. С гидроксидами металлов:
H2SO4+2NaOH=Na2SO4+2H2O
4. С солями:
H2SO4+MgCO3=MgSO4+H2O+CO2
7.
ОСОБОЕ СВОЙСТВО КОНЦЕНТРИРОВАННОЙСЕРНОЙ КИСЛОТЫ –
ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
В этих реакциях серная кислота проявляет окислительные
свойства, так как сера понижает свою степень окисления.
Концентрированная серная кислота при нагревании может
взаимодействовать с металлами, расположенными в ряду
напряжений металлов правее водорода.
При этом продуктом реакции является сернистый газ:
Cu + H2SO4 ----CuSO4 + SO2 + H2O
При взаимодействии концентрированной серной кислоты с
металлами до водорода возможно образование газасероводорода или серы.
Zn + H2SO4 ---ZnSO4 + S + H2O
8.
Автоцистерна для перевозкисерной кислоты
9.
Соли H2SO4Сульфаты (SO4) – средние соли
Гидросульфаты (НSO4) – кислые
соли
Они могут быть как растворимыми,
так и нерастворимыми
Химические свойства сульфатов:
1. С металлами (прибавляемый металл должен
быть активнее металла в соли):
CuSO4+Fe=FeSO4+Cu
2. С щелочами:
FeSO4+2NaOH=Na2SO4+Fe(OH)2
3. С другими солями:
К2SO4+BaСl2=2КСl+BaSO4
10.
В природе встречается 180 минераловсульфатов, и на их долю приходится
~0,5 % массы земной коры.
Их даже много и в
морской воде,
особенно в лагунах по
берегам морей.
Много сульфатов и в
горячих водных
растворах,
просачивающихся из
глубин Земли.
11.
В Мексике не так давно обнаружили пещерус 15-метровыми кристаллами гипса!
(CaSO4 2Н2О)
Сульфат
Сульфаткальция
бария
12.
Применение H2SO41. В производстве минеральных удобрений
2. Как электролит в свинцовых аккумуляторах
3. Для получения различных минеральных кислот и солей
4. В нефтяной, металлообрабатывающей, текстильной, кожевенной и
др. отраслях промышленности
5. В пищевой промышленности (пищевая добавка Е513)
13.
Промышленное получение H2SO4S
SO2
1.
SO3
H2SO4
S+O2=SO2
2. 2SO2+O2=2SO3
3. SO3+H2O=H2SO4
14.
Серная кислотав природе
Кислые озёра
15.
Это одно изчудес
камчатской
природы
Существуют предположения, что кислотное озеро возникло
сравнительно недавно в результате извержения, произошедшего
незаметно для людей.
Тот, кто сумел достичь его подножия, просто обязан подняться на
кромку кратера.
Зрелище, которое открывается глазам, незабываемо:
двухсотметровый провал кратера, дымящееся зеленое озеро, буйство
красок на внутренних стенках.
В ясную ветреную погоду можно спуститься в кратер.
Это обитель «подземных духов»
16.
Озеро шириной 500 м и глубиной140 м состоит из прогретого до 40
градусов раствора серной и соляной
кислот средней концентрации
17.
Серная кислота –очень активная жидкость, особенно
концентрированная,
которая реагирует со
многими неорганическими веществами,
также она легко действует на
органические соединения:
обугливает бумагу,
сахар, древесину, т.е. соединения,
которые содержат в себе углерод.
Хранят ее в стеклянной таре,
а перевозят в стальных цистернах
ВЫВОД
18.
Нет кислоты, которая была бынужнее и применялась бы чаще,
чем серная.
Главным образом, ее применяют в
качестве полуфабриката;
многочисленные предприятия по
производству серной кислоты
перерабатывают ее далее в
различных процессах.
Не случайно, перспективные планы
развития химической промышленности
каждой страны предусматривают
увеличение производства серной
кислоты и числа требующихся для этого
многочисленных установок.
















 chemistry
chemistry