Similar presentations:
Аммиак. Соли аммония
1. Аммиак. Соли аммония
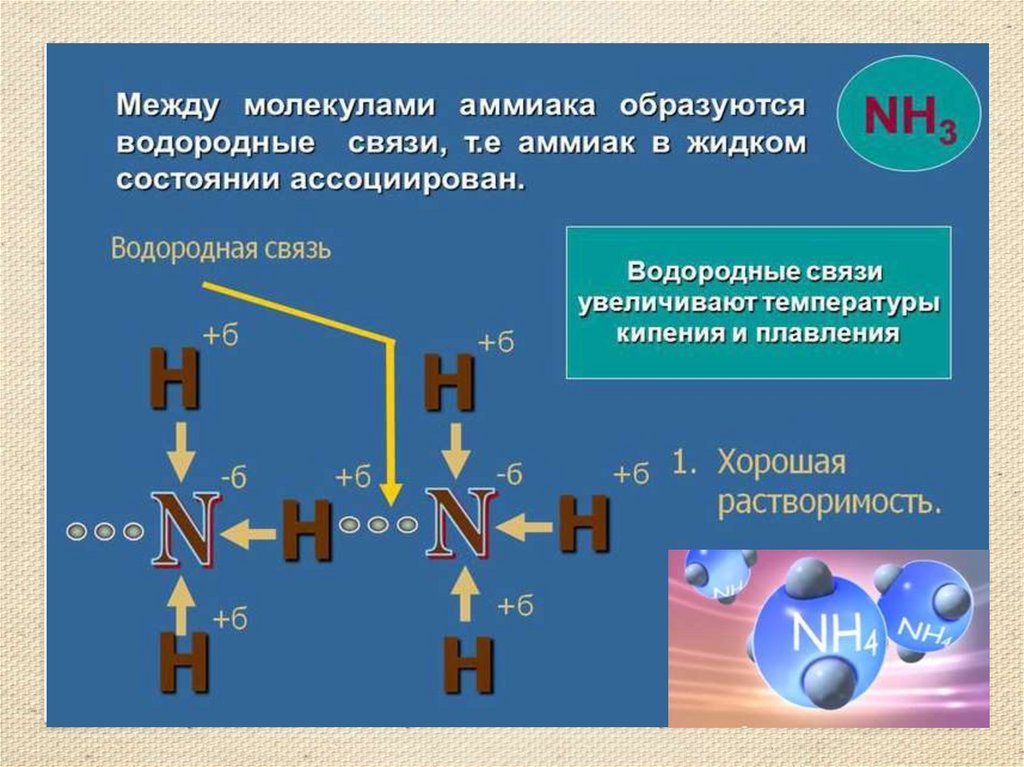
2.
3.
4.
5.
6.
7.
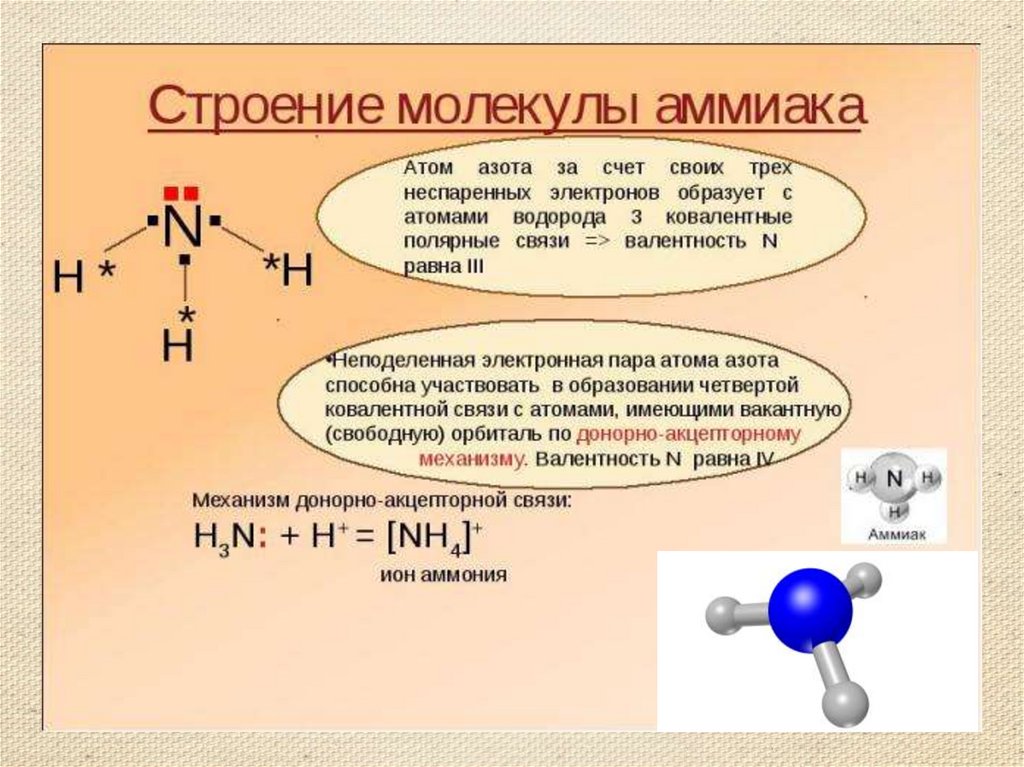
Строение молекулы аммиака.Структурная формула
Молекулярная формула аммиака NH3
Электронная формула
Масштабная модель
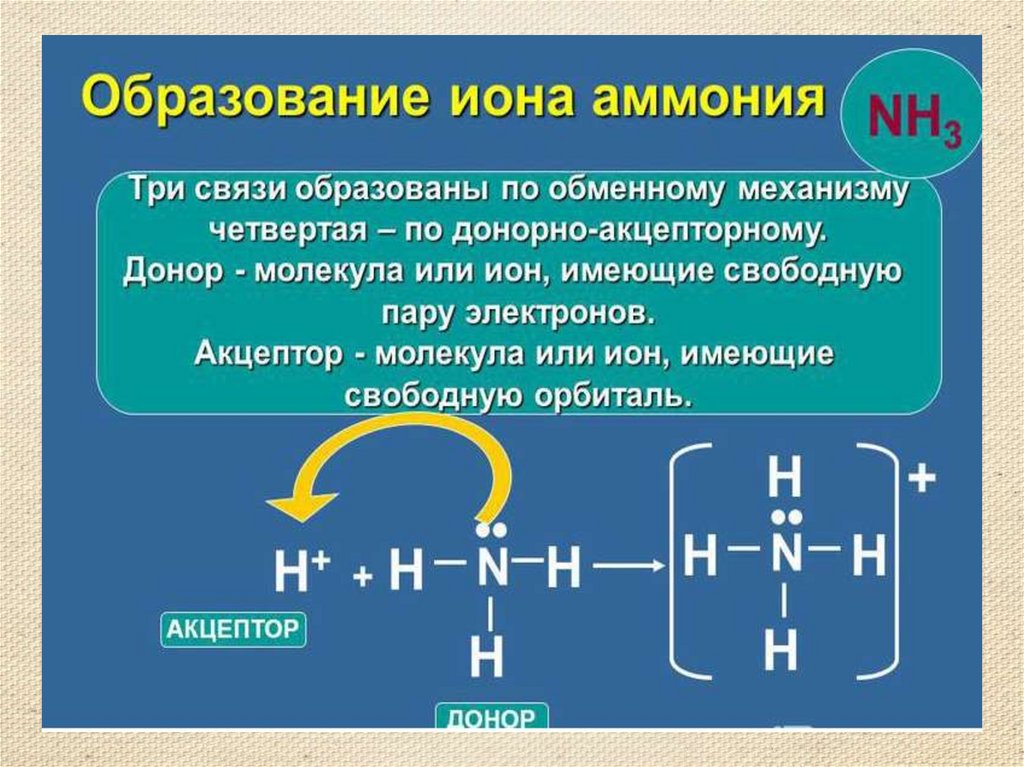
8.
9.
10.
11.
12.
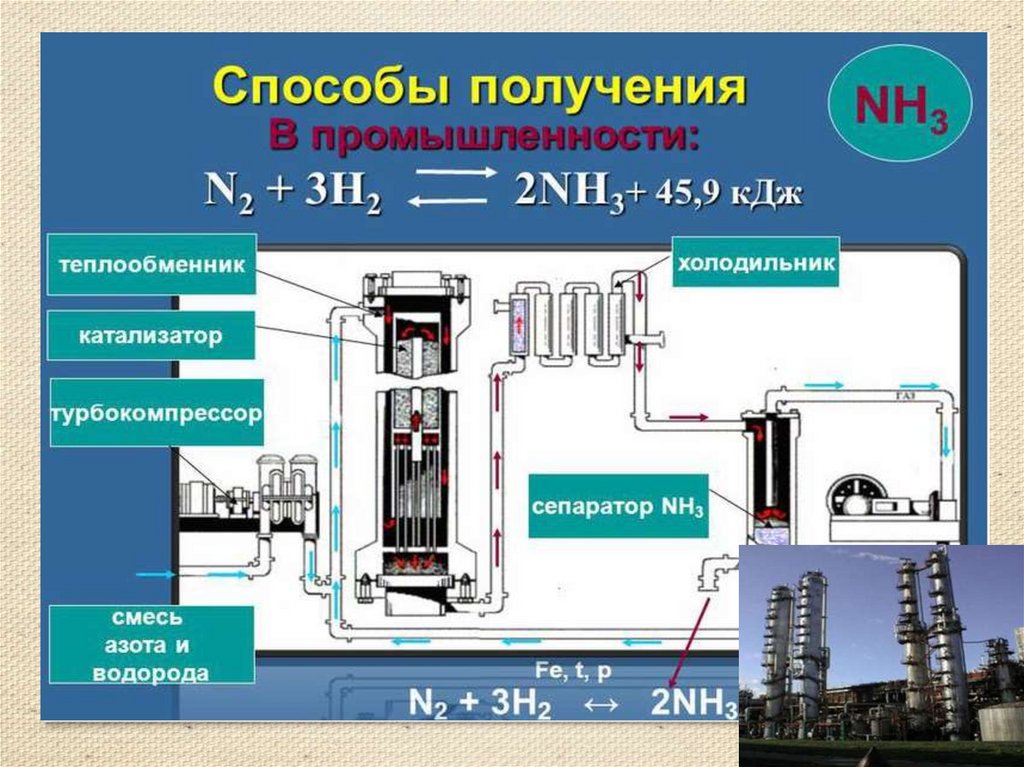
13. Получение аммиака
• Аммиак можно получить нагреванием смесисоли - хлорида аммония и гидроксида кальция.
При нагревании смеси происходит реакция
образования соли, аммиака и воды.
• 2NH4Cl + Ca(OH)2 = 2NH3 ↑ + CaCl2 +
2H2O
• Тщательно разотрем ступкой смесь соли и
основания и нагреем смесь.
• (аммиак - легкий газ).
14.
15.
16.
Химические свойства аммиака.Аммиак-восстановитель
Горение аммиака в кислороде
4NH3 + 3O2= 2N2 + 6H2O
Аммиак на воздухе не горит!
Но в чистом кислороде он сгорает, окисляясь до азота.
Осторожно нагреем раствор аммиака и подадим в горелку
кислород. Поднесем зажженную лучинку к отверстию горелки.
Аммиак загорается и горит желтовато- зеленым пламенем.
17.
18.
19.
Из сложных веществ аммиак реагируетс кислотами:
Аммиак NH3 взаимодействует с
концентрированными кислотами –
соляной HCl, азотной HNO3 и
серной H2SO4.
При добавлении кислоты к
раствору аммиака появляется
белый дым - выделяется соль -
NH3 + HCl = NH4Cl↑ хлорид аммония.
NH3 + HNO3 = NH4 NO3↓
нитрат аммония.
2NH3+ H2SO4 = (NH4)2SO4↓
сульфат аммония.
Аммиак взаимодействует со всеми растворимыми в воде
кислотами с образованием солей аммония


























 chemistry
chemistry








