Similar presentations:
Аммиак. Соли аммония
1. Аммиак. Соли аммония
2.
3.
4.
5.
Строение молекулы аммиака.Структурная формула
Молекулярная формула аммиака NH3
Электронная формула
6.
7.
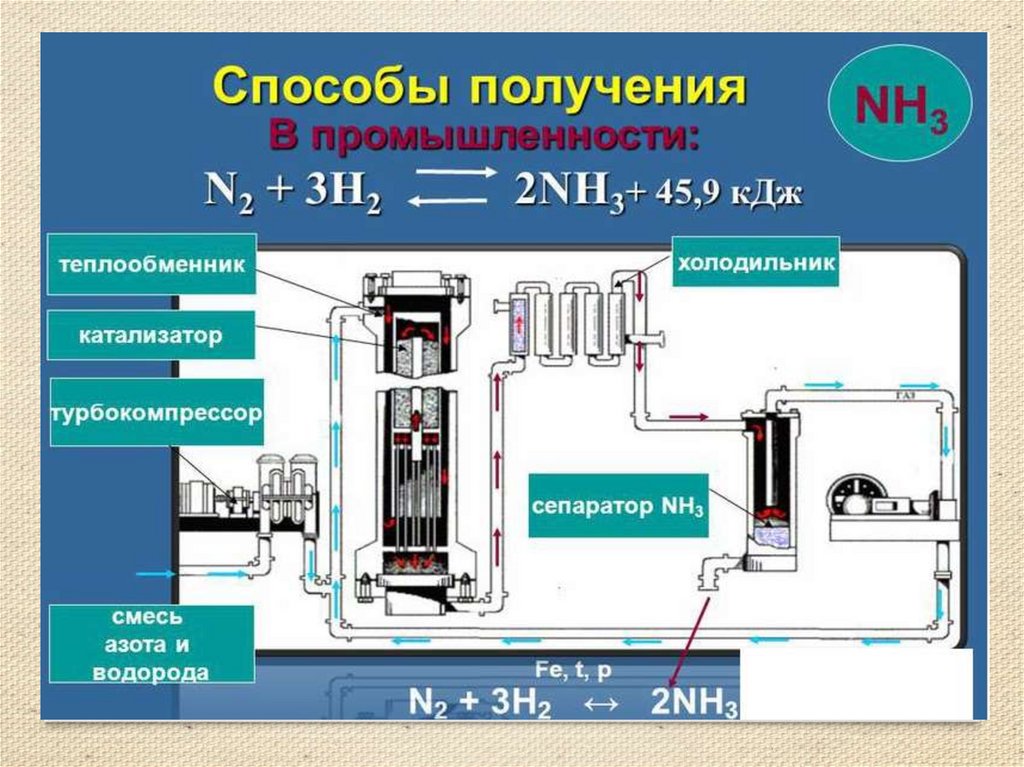
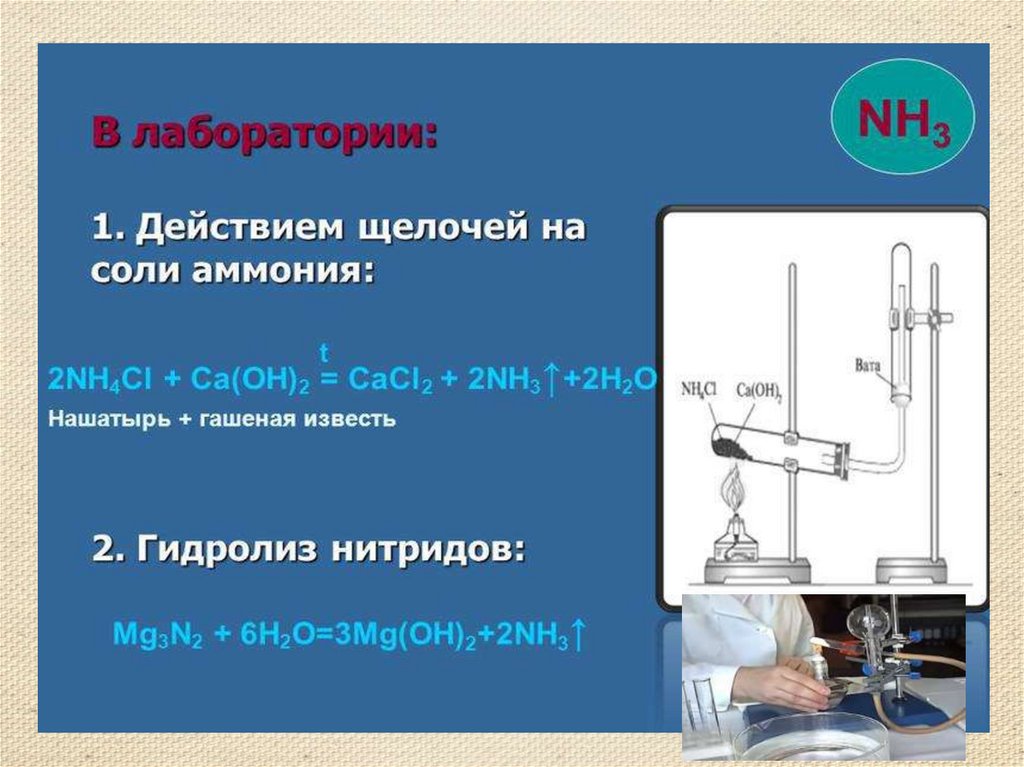
8. Получение аммиака
• Аммиак можно получить нагреванием смесисоли - хлорида аммония и гидроксида кальция.
При нагревании смеси происходит реакция
образования соли, аммиака и воды.
• 2NH4Cl + Ca(OH)2 = 2NH3 ↑ + CaCl2 +
2H2O
• Тщательно разотрем ступкой смесь соли и
основания и нагреем смесь.
• (аммиак - легкий газ).
9.
10.
11.
Химические свойства аммиакаАммиак-восстановитель
Горение аммиака в кислороде
4NH3 + 3O2 = 2N2 + 6H2O
Аммиак на воздухе не горит!
Но в чистом кислороде он сгорает, окисляясь до азота. Осторожно нагреем
раствор аммиака и подадим в горелку кислород. Поднесем зажженную
лучинку к отверстию горелки. Аммиак загорается и горит желтоватозеленым пламенем.
12.
Из сложных веществ аммиак реагируетс кислотами:
Аммиак NH3 взаимодействует с
концентрированными кислотами –
соляной HCl, азотной HNO3 и
серной H2SO4.
При добавлении кислоты к раствору
аммиака появляется белый дым выделяется соль NH3 + HCl = NH4Cl↑
хлорид аммония.
NH3 + HNO3 = NH4 NO3↓
нитрат аммония.
сульфат аммония.
NH3+ H2SO4 = (NH4)2SO4↓
Аммиак взаимодействует со всеми растворимыми в воде
кислотами с образованием солей аммония


















 chemistry
chemistry








