Similar presentations:
Аммиак. Соли аммония
1.
Аммиак.Соли аммония.
2.
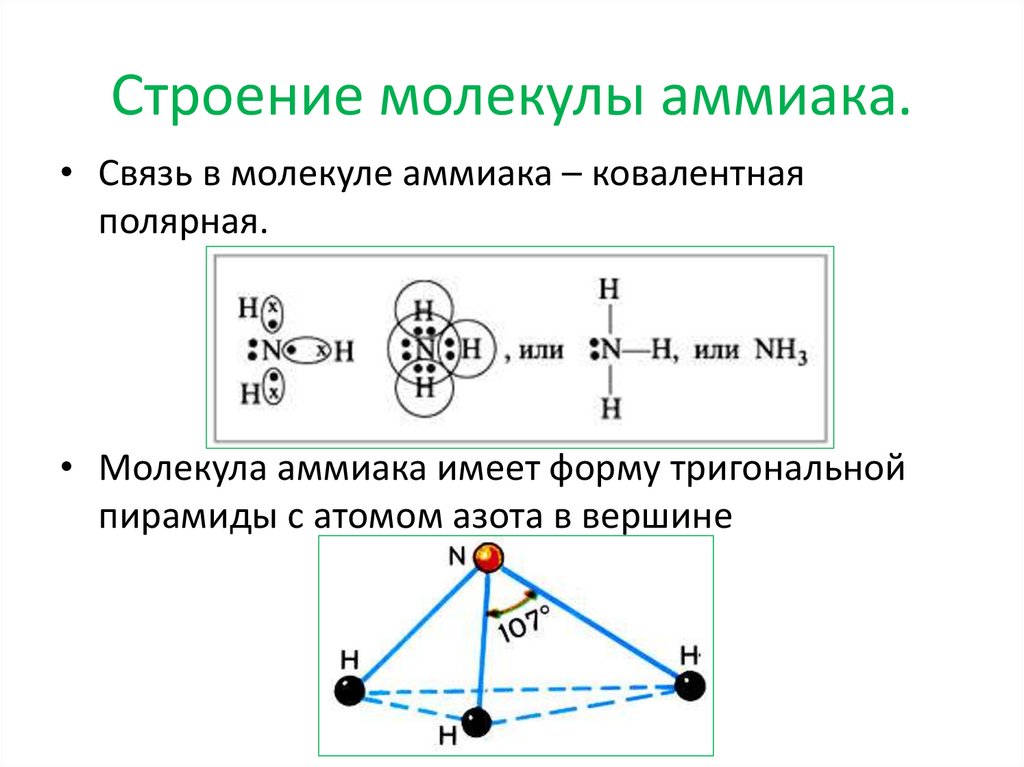
Строение молекулы аммиака.• Связь в молекуле аммиака – ковалентная
полярная.
• Молекула аммиака имеет форму тригональной
пирамиды с атомом азота в вершине
3.
Строение молекулы.Молекулы жидкого аммиака, как и молекулы
воды, связаны между собой
межмолекулярными водородными
связями:
4.
Физические свойства• бесцветный газ
• резкий характерный запах (запах
нашатырного спирта)
• вдвое легче воздуха
• хорошо растворим в воде
Внимание!
Пары аммиака оказывают раздражающее
действие на слизистые оболочки глаз и
органов дыхания, а также кожные покровы.
Это мы и воспринимаем как резкий запах.
5.
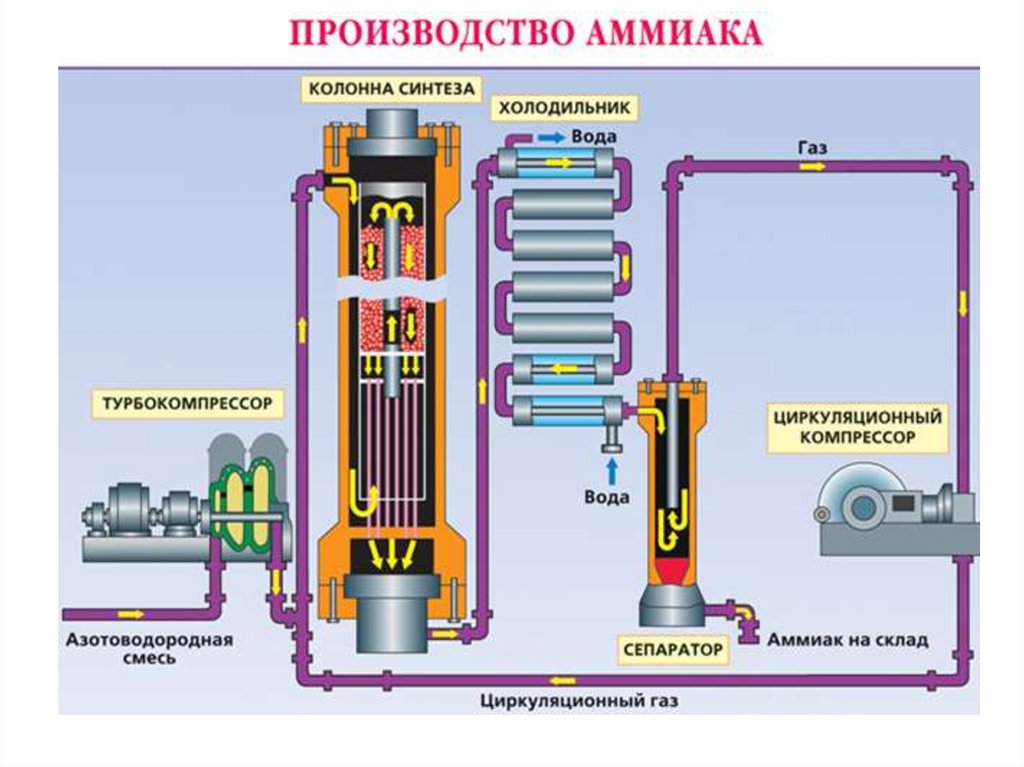
Получение1. В промышленности - прямое взаимодействие
водорода и азота:
t, р, кат.
N2(г) + 3H2(г)
2NH3(г) + 45,9 кДж
• Азотоводородная смесь сжимается в
турбокомпрессоре.
• В колонне синтеза газы реагируют в
присутствии катализатора (пористое железо).
• Образовавшийся аммиак отделяют от
непрореагировавших газов (возвращаются в
колонну синтеза) в холодильнике – принцип
циркуляции.
6.
7.
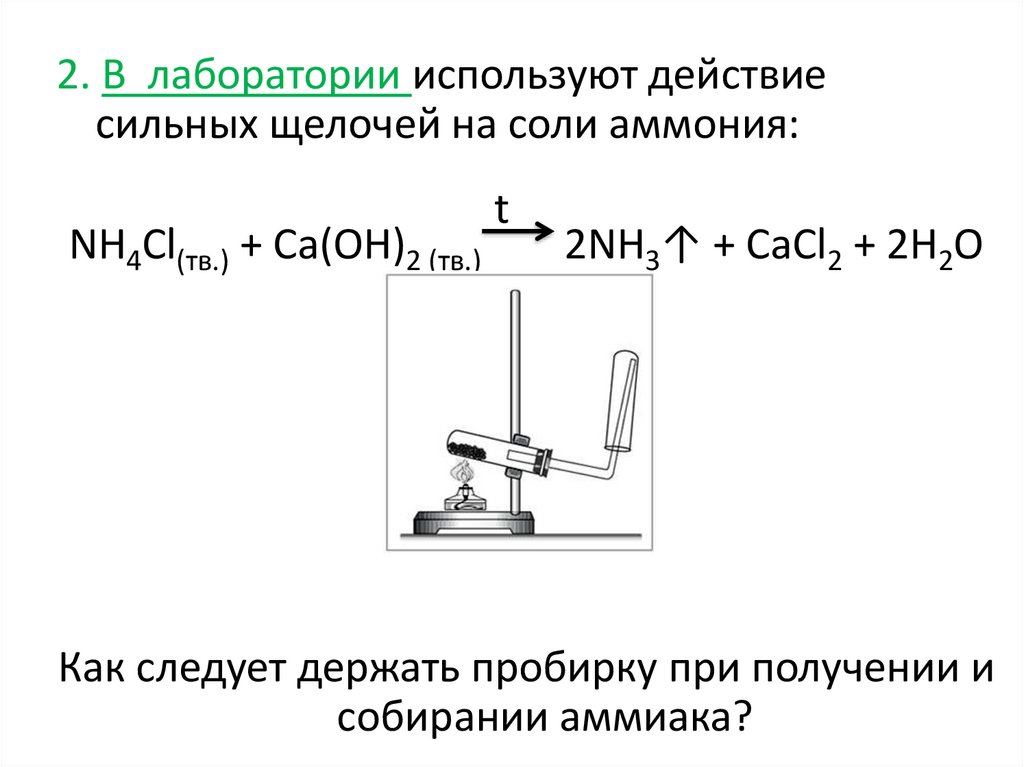
2. В лаборатории используют действиесильных щелочей на соли аммония:
NH4Cl(тв.) + Ca(OH)2 (тв.)
t
2NH3↑ + CaCl2 + 2H2O
Как следует держать пробирку при получении и
собирании аммиака?
8.
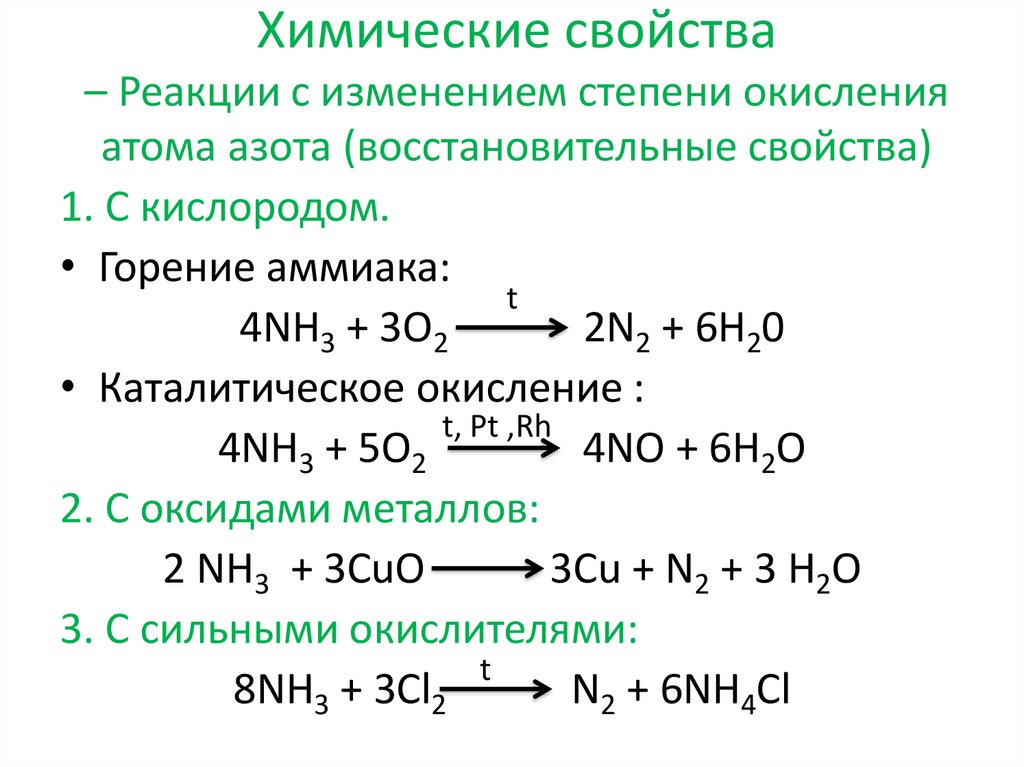
Химические свойства– Реакции с изменением степени окисления
атома азота (восстановительные свойства)
1. С кислородом.
• Горение аммиака:
t
4NH3 + 3O2
2N2 + 6H20
• Каталитическое окисление :
t, Pt ,Rh
4NH3 + 5O2
4NO + 6H2O
2. С оксидами металлов:
2 NH3 + 3CuO
3Cu + N2 + 3 H2O
3. С сильными окислителями:
t
8NH3 + 3Cl2
N2 + 6NH4Cl
9.
– Реакции без изменения степени окисленияатома азота (основные свойства)
1. С водой.
NH3 + H2O → NH3*H2O/ NH4OH
2. С кислотами.
NH3 + HCl → NH4Cl
! При взаимодействии с газообразным
хлороводородом образуется белый дым –
качественная реакция.
10.
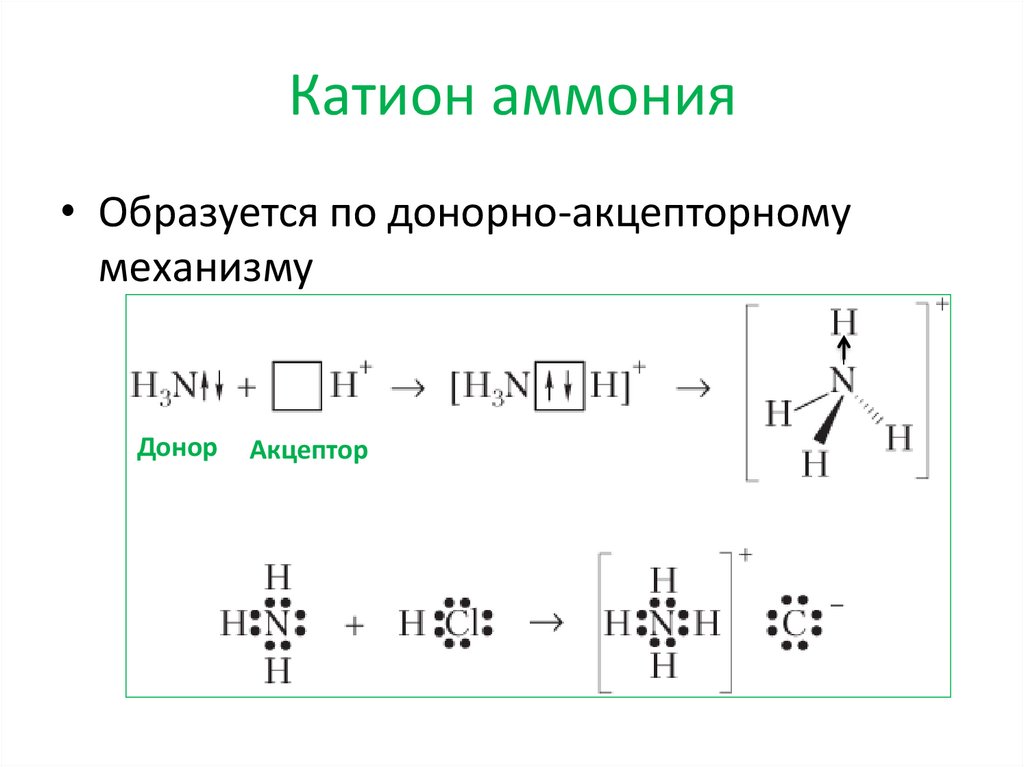
Соли аммония11.
Катион аммония• Образуется по донорно-акцепторному
механизму
Донор
Акцептор
12.
Физические свойства: кристаллическиевещества, хорошо растворимые в воде.
Получение
1 способ: Аммиак + кислота
NH3 + HNO3 → NH4NO3
2NH3 + H2SO4 → (NH4)2SO4
13.
Химические свойстваОБЩИЕ С СОЛЯМИ
1. Диссоциируют в воде:
NH4Cl → NH4+ + Cl2. С кислотами
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
3. С солями
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
Задание! Запишите уравнение реакции в полном и
сокращенном ионном виде.
14.
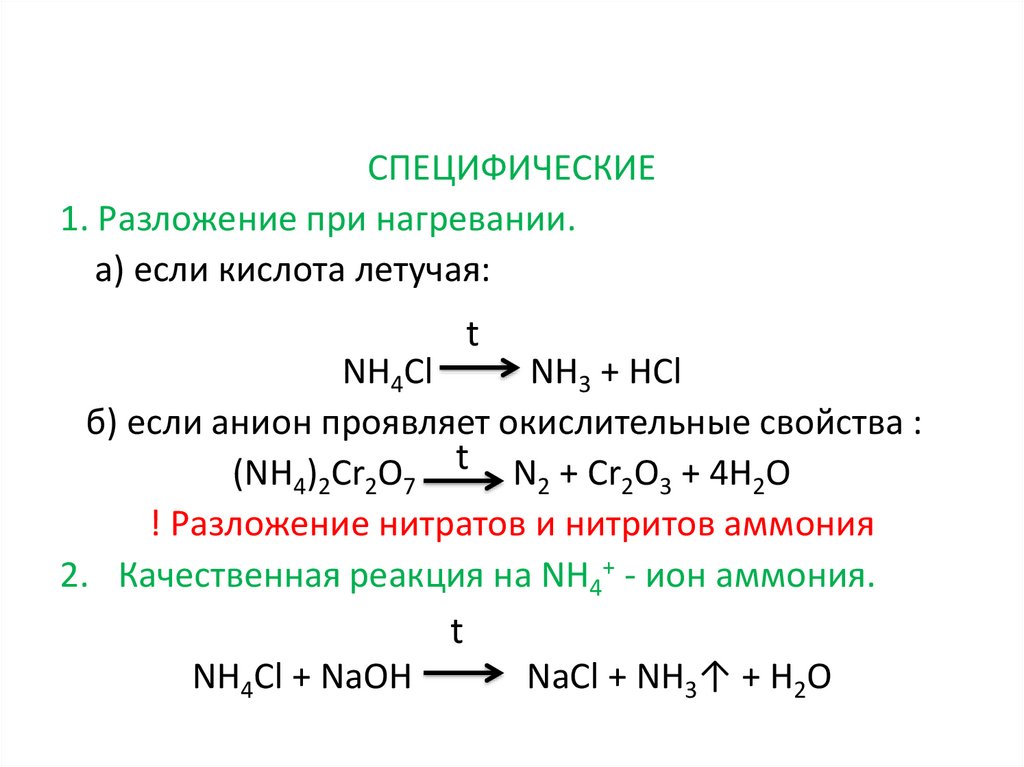
СПЕЦИФИЧЕСКИЕ1. Разложение при нагревании.
a) если кислота летучая:
t
NH4Cl
NH3 + HCl
б) если анион проявляет окислительные свойства :
(NH4)2Cr2O7 t N2 + Cr2O3 + 4Н2O
! Разложение нитратов и нитритов аммония
2. Качественная реакция на NH4+ - ион аммония.
t
NH4Cl + NaOH
NaCl + NH3↑ + Н2O








 chemistry
chemistry








