Similar presentations:
Подгруппа кислорода, химия, 9 класс
1.
Соединения серыТема: «Подгруппа кислорода», химия, 9 класс
2.
3.
SO2СЕРНИСТЫЙ ГАЗ
Нахождение в природе
Оксид серы (lV) – сернист ый газ,
являющийся одним из главных
загрязнит елей ат мосферного воздуха,
кислот ный оксид, очень хорошо
раст воримый в воде, образует слабую
сернист ую кислот у
4.
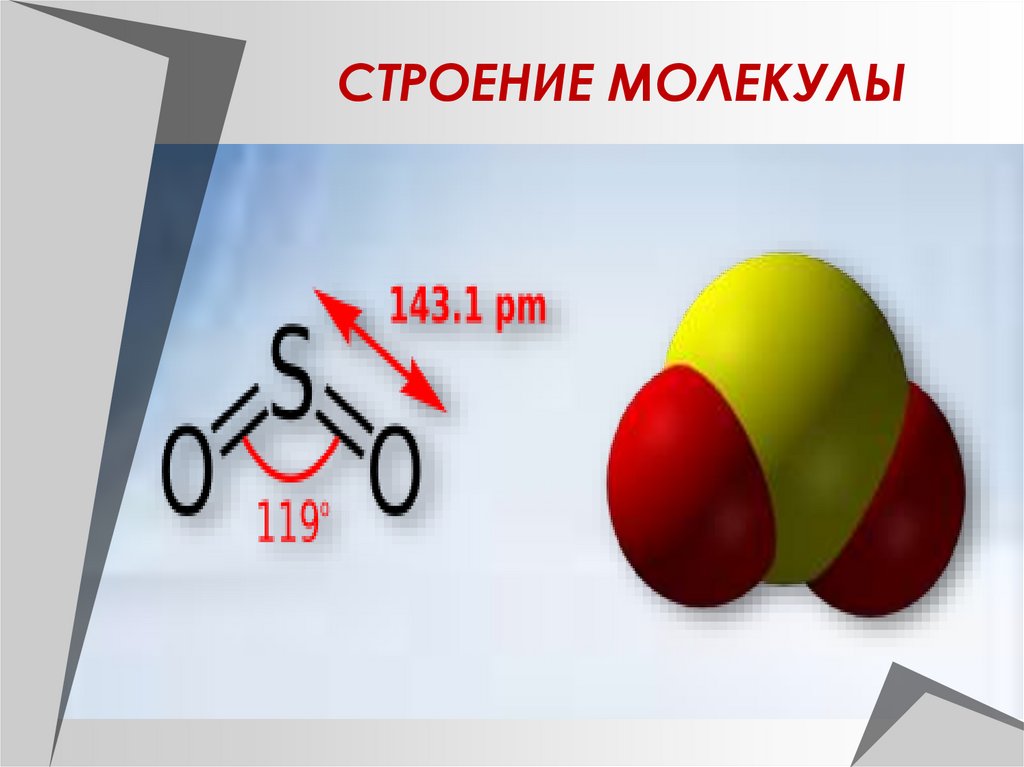
СТРОЕНИЕ МОЛЕКУЛЫ5.
ПОЛУЧЕНИЕВ промышленности: обжиг
сульфидов:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑
ZnS + O2 = ZnO + SO2
5
6.
ФИЗИЧЕСКИЕ СВОЙСТВАбесцвет ный газ с характ ерным резким
удушливым запахом (запах загорающейся
спички); хорошо раст воряет ся в воде с
образованием нест ойкой сернист ой
кислот ы; под давлением сжижает ся при
комнат ной т емперат уре; ядовит ;
обесцвечивает многие красит ели, убивает
микроорганизмы.
6
7.
Химические свойстваоксида серы (IV)
От носит ся к кислот ным оксидам.
Раст воряет ся в воде с образованием
сернист ой кислот ы (при обычных условиях
реакция обрат има):
SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфит ы:
SO2 + ___NaOH → Na2SO3 + H2O.
Химическая акт ивност ь SO2 весьма велика.
Наиболее ярко выражены восст ановит ельные
свойст ва SO2, ст епень окисления серы в
таких реакциях повышает ся:
SO2 + Br2 + __H2O → H2SO4 + __HBr,
__SO2 + O2 → __SO3 (т ребует ся кат ализат ор
V2O5 и т емперат ура 450°С),
(расст авьт е коэффициент ы!!!)
8.
Химические свойстваоксида серы (IV)
Данная реакция являет ся качест венной реакцией на
сульфит -ион SO32- и на SO2 (обесцвечивание
фиолет ового раст вора).
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
В присут ст вии сильных восст ановит елей SO2
способен проявлят ь окислит ельные свойст ва.
Например, для извлечения серы их от ходящих газов
мет аллургической промышленност и используют
восст ановление SO2 оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноват ист ой кислот ы:
PH3 + SO2 → H(PH2O2) + S↓
Проявляет как свойст ва окислит еля, т ак
и восст ановит еля:
9.
Оксид серы (IV)ПРИМЕНЕНИЕ
В пищевой промышленност и
использует ся как консервант (Е220)
. Используют ся при производст ве
многих продукт ов и
полуфабрикат ов, а т акже для
дезинфекции т ары. Негат ивно
влияет на функции почек.
Раздражит ель дыхат ельных пут ей,
может вызват ь прист уп аст мы;
10.
Сернистая кислотаH2SO3
Неуст ойчивая двухосновная кислот а средней
силы, сущест вует лишь в разбавленных
водных раст ворах (в свободном сост оянии
не выделена):
SO2 + H2O ⇆ H2SO3 ⇆ H+ + HSO3- ⇆ 2H+ +
SO32-.
11.
Соли ее – сульфит ы, раст воримые изних т олько соли щелочных мет аллов.
Сульфит ы - эт о средние соли (CaSO3),
но ест ь и кислые – гидросульфит ы
(NaHSO3).
Сульфит ы и гидросульфит ы реагируют
с сильными кислот ами с образованием
сернист ого газа
K2SO3 + __HNO3 __KNO3 + SO2 + H2O
(расставьте коэффициенты!!! - ОВР)
12.
Применениесернистой кислоты H2SO3
Сернист ая кислот а и её соли применяют как
восст ановит ели, для беления шерст и, шелка
и других мат ериалов, кот орые не
выдерживают от беливания с помощью
сильных окислит елей (хлора).
Сернист ую кислот у применяют при
консервировании плодов и овощей.
Гидросульфит кальция Са(HSO3)2
(сульфит ный щелок) используют для
переработ ки древесины в т ак называемую
сульфит ную целлюлозу (раст вор
гидросульфит а кальция раст воряет лигнин —
вещест во, связывающее волокна целлюлозы,
в результ ат е чего волокна от деляют ся друг от
друга; обработ анную т аким образом
древесину используют для получения
бумаги).
13.
14.
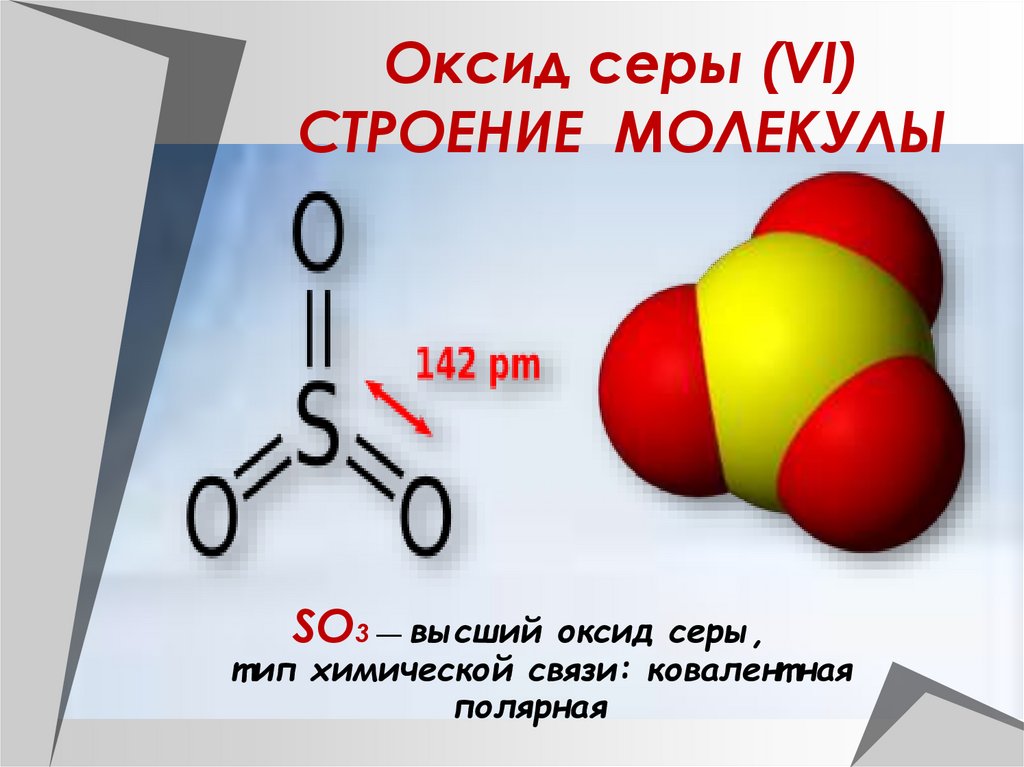
Оксид серы (VI)СТРОЕНИЕ МОЛЕКУЛЫ
SO3 — высший оксид серы,
т ип химической связи: ковалент ная
полярная
15.
Оксид серы (VI)Физические свойства
В обычных условиях легколет учая
бесцвет ная жидкост ь с удушающим
запахом. При т емперат урах ниже
16,9 °C заст ывает с образованием
смеси различных крист аллических
модификаций т вёрдого SO3.
15
16.
ХИМИЧЕСКИЕ СВОЙСТВАПроявляет т олько свойст ва окислит еля:
__SO3 + H2S → __SO2 + H2O
Раст воряет ся в 100%-й серной кислот е,
образуя олеум:
H2SO4 (100 %) + SO3 → H2S2O7
(расставьте коэффициенты!!!)
Проявляют свойст ва т ипичного кислот ного
оксида:
16
17.
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА SO3характ еризует ся сильными окислит ельными
свойст вами, восст анавливает ся, обычно, до
сернист ого ангидрида:
__SO3 + _P→ P2O5 + __SO2
__SO3 + H2S → __SO2 + H2O
__SO3 + __KI → SO2 + I2 + K2SO4.
При взаимодейст вии с хлороводородом
образует ся хлорсульфоновая кислот а:
SO3 + HCl → HSO3Cl
Также присоединяет хлор, образуя
тионилхлорид:
SO3 + Cl2 + __SCl2 → __SOCl2
(расст авьт е коэффициент ы!!!)
17
18.
ПРИМЕНЕНИЕ ОКСИДОВСЕРЫ –
САМОСТОЯТЕЛЬНО!!!
ДЗ: параграф 15 – до серной
кислот ы; подгот овит ься к
практ ической работ е – ст р
86
















 chemistry
chemistry








