Similar presentations:
Пероксид водорода
1.
2.
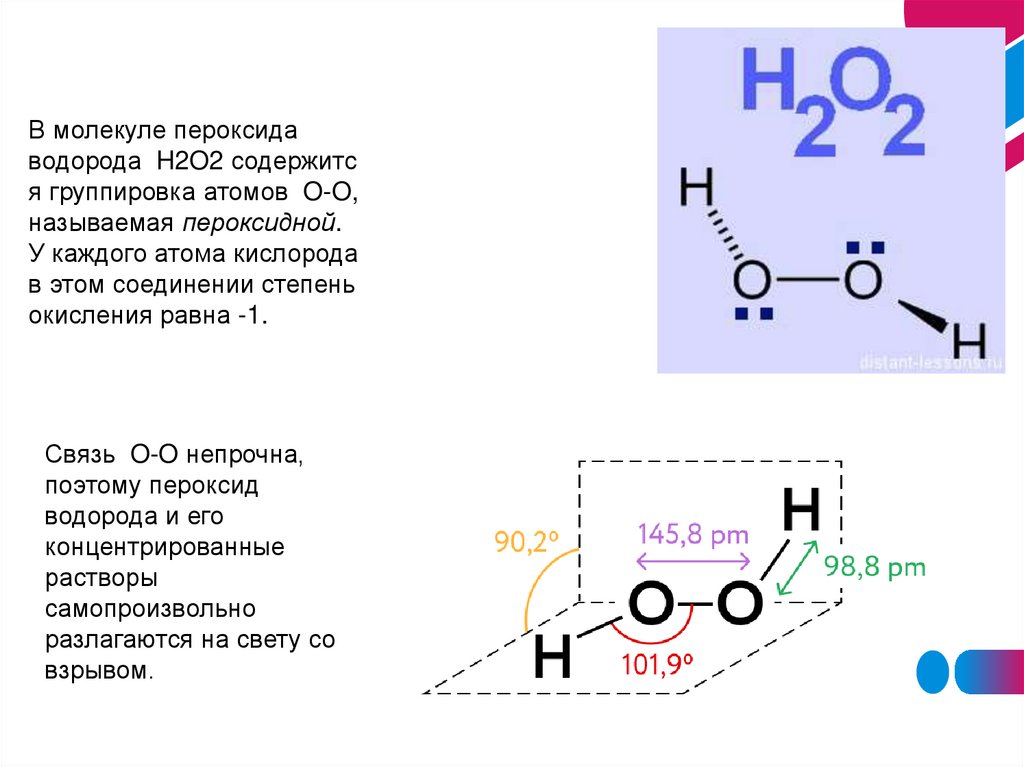
В молекуле пероксидаводорода H2O2 содержитс
я группировка атомов O-O,
называемая пероксидной.
У каждого атома кислорода
в этом соединении степень
окисления равна -1.
Связь O-O непрочна,
поэтому пероксид
водорода и его
концентрированные
растворы
самопроизвольно
разлагаются на свету со
взрывом.
3.
4.
а) Кислотно-основные свойстваПероксид водорода проявляет слабые кислотные свойства и
диссоциирует по двум ступеням:
Пероксид водорода является чуть более сильной кислотой, чем вода.
Пероксиды металлов и аммония можно рассматривать как "соли" этой
слабой кислоты. В присутствии щёлочи кислотно-основное равновесие в
растворе смещается в сторону образования гидропероксид-ионов OOH-.
Так как в водных растворах H2O2 ведет себя как очень слабая кислота,
реакцию взаимодействия, например, гидроксида бария с пероксидом
водорода, приводящую к образованию пероксида бария BaO2, можно
рассматривать как реакцию нейтрализации:
5.
б) Окислительно-восстановительные свойстваВ окислительновосстановительных реакциях
пероксид водорода может
проявлять как окислительные,
так и восстановительные
свойства, в зависимости от
условий. Это связано с тем, что
оба атома кислорода в молекуле
H2O2 находятся в
промежуточной степени
окисления -1. Стоит отметить,
что наиболее характерными для
пероксида водорода являются
окислительные свойства.
Восстановителем пероксид
водорода может быть только в
реакциях с сильными
окислителями.
Принимая электрон на внешний
уровень (выступая в качестве
окислителя), кислород переходит
в степень окисления -2,
например:
6.
Отдавая электрон, O^-1 переходит в степень окисления 0,превращаясь в молекулярный кислород O2 и проявляя
восстановительные свойства, например:
7.
В лаборатории пероксид водорода обычно получают,действуя разбавленной серной кислотой на пероксид
бария:
В промышленности пероксид водорода изначально получали
электролизом серной кислоты или раствора сульфата аммония
в серной кислоте. В результате этого процесса образуется
надсерная кислота H2S2O8, гидролиз которой приводит к
образованию пероксида и серной кислоты:
Впоследствии был разработан так называемый
"антрахиноновый процесс"; в этом процессе формально идёт
окисление водорода кислородом воздуха с катализом
алкилпроизводными антрахинона.
8.
Пероксид водорода благодаря своим сильным окислительнымсвойствам широко используется в быту, в медицине, в
промышленности. Его применяют в производстве
отбеливателей, для получения различных неорганических и
органических пероксидов, для получения антисептических
средств, в том числе для обработки гнойных ран, при
производстве соков и молочной продукции для дезинфекции
технологических поверхностей и упаковки, для реставрации
картин, написанных масляными красками с использованием
свинцовых белил.







 chemistry
chemistry








