Similar presentations:
Пероксид водорода
1.
2. Пероксид водорода
Перокси́д водоро́да(перекись водорода), H2O2
— простейший
представитель пероксидов.
Бесцветная жидкость с
«металлическим» вкусом,
неограниченно растворимая
в воде, спирте и эфире.
Концентрированные водные
растворы взрывоопасны.
Пероксид водорода является
хорошим растворителем. Из
воды выделяется в виде
неустойчивого
кристаллогидрата
H2O2•2H2O.
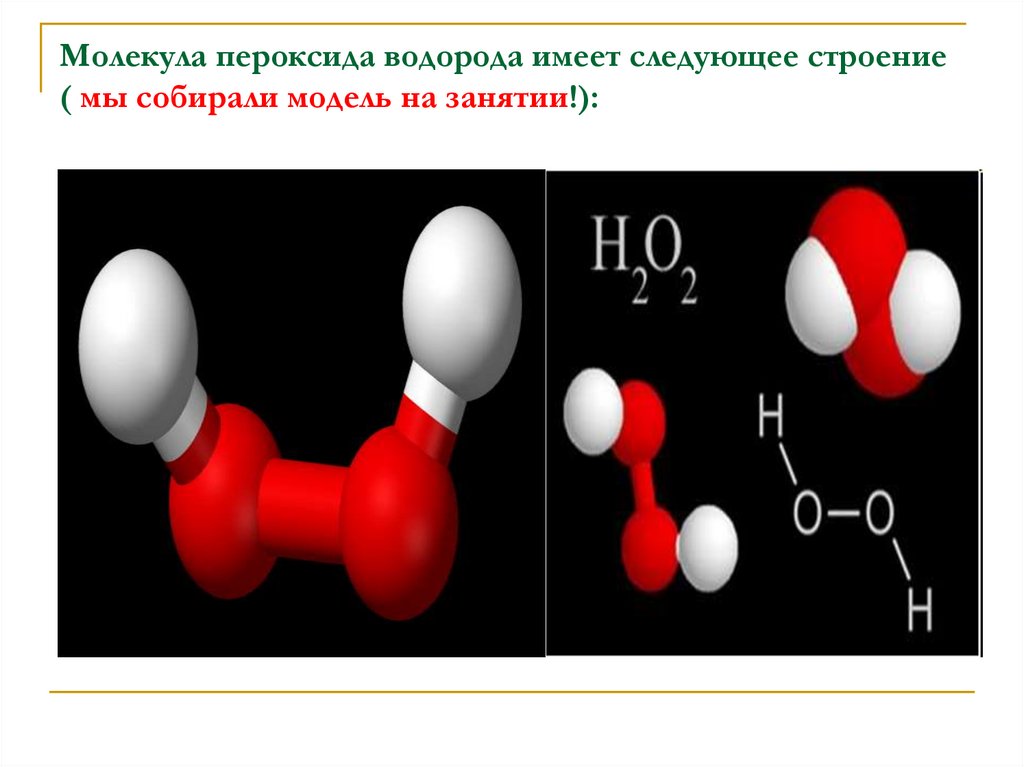
3. Молекула пероксида водорода имеет следующее строение ( мы собирали модель на занятии!):
4. Получение
Пероксид водорода получаютсяв промышленности по реакции с
участием органических веществ.
Ценным побочным продуктом
этой реакции является ацетон.
В лабораторных условиях для
получения пероксида водорода
используют реакцию
BaO (оксид бария) +
H2SO4 (серная кислота)
→ H2O2 + BaSO4
Концентрирование и очистку
пероксида водорода проводят
осторожной перегонкой.
5. Химические свойства
Разлагается на кислород и воду при нагревании, поддействием ультрафиолетового излучения, а также в
присутствии ионов переходных металлов и серебра:
2Н2O2 → 2H2O + O2
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет очень слабые кислотные
свойства.
Пероксидная группа -O-O- входит в состав многих веществ.
Такие вещества называют пероксидами, или пероксидными
соединениями. К ним относятся пероксиды металлов
(Na2O2, BaO2 и др.), которые можно рассматривать как
соли пероксида водорода. Кислоты, содержащие
пероксидную группу, называют пероксокислотами,
например, пероксомонофосфорная H3PO5 и
пероксидосерная H2S2O8 кислоты.
6. Окислительно-восстановительные свойства
Пероксид водорода обладает сильными окислительными, а такжевосстановительными свойствами.
Пероксид водорода восстанавливает соли золота и серебра, а также
кислород при реакции с водным раствором перманганата калия в
кислой среде.
При действии сильных окислителей H2O2 проявляет
восстановительные свойства, выделяя свободный кислород:
O22– – 2e– → O2
Реакцию KMnO4 (марганцовка) с Н2O2 используют в химическом
анализе для определения содержания Н2O2.
7. Применение
Благодаря своим сильным окислительным свойствампероксид водорода нашёл широкое применение в быту и в
промышленности, где используется, например, как
отбеливатель на текстильном производстве и при
изготовлении бумаги. Применяется как ракетное топливо —
в качестве окислителя или как однокомпонентное (с
разложением на катализаторе). Используется в
аналитической химии, в медицине, в качестве
пенообразователя при производстве пористых материалов, в
производстве дезинфицирующих и отбеливающих средств. В
промышленности пероксид водорода также находит свое
применение в качестве катализатора (ускорителя
химических реакций). В медицине растворы пероксида
водорода применяются как антисептическое средство. При
контакте с поврежденной кожей и слизистыми пероксид
водорода под влиянием фермента каталазы распадается с
выделением кислорода, что способствует сворачиванию
крови и создает неблагоприятные условия для развития
микроорганизмов (противомикробное средство).
8. Экспериментальная часть
Цель работы: провести исследование температурызамерзания растворов пероксида водорода разной
концентрации.
9. Задачи:
определить температурызамерзания растворов
пероксида водорода;
изучить области применения
пероксида водорода.
10. Температура замерзания водных растворов перекиси водорода (водорода пероксида, пергидроля)
Массовая доляперекиси
Температура
замерзания, °С
водорода, %
20
–14,6
30
35
–25,7
–33,0
40
–41,4
11.
Результат исследования: В зависимости отконцентрации перекиси водорода изменяется
температура ее замерзания. Исходя из этого
свойства, перекись водорода можно использовать
как добавку к жидкостям для омывания стекол. Также
можно заменить реагенты, которыми посыпаю улицу
зимой, на растворы пероксида водорода. Или
пероксид водорода можно добавлять в резервуры
для хранения воды, чтобы она дольше не замерзала
в наших северных широтах.
12. Заключение
Возможно, в будущем перекись водорода будетиметь еще более широкое применение,
благодаря многим своим свойствам. Прежде
всего, благодаря своей невысокой цене.
Надеемся, что после наших исследований
многие узнают об огромных возможностях,
которые предоставляет нам такой знакомый
пероксид водорода…













 chemistry
chemistry








