Similar presentations:
Водород. Пероксид водорода. Вода
1.
ВОДОРОДПЕРОКСИД ВОДОРОДА
ВОДА
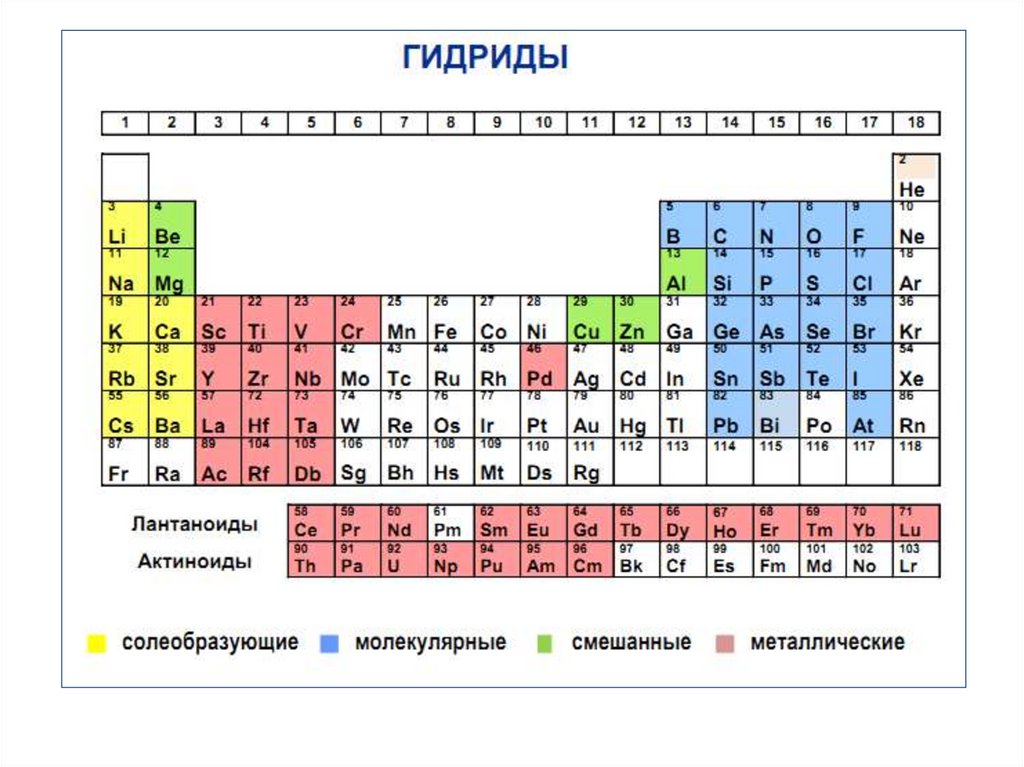
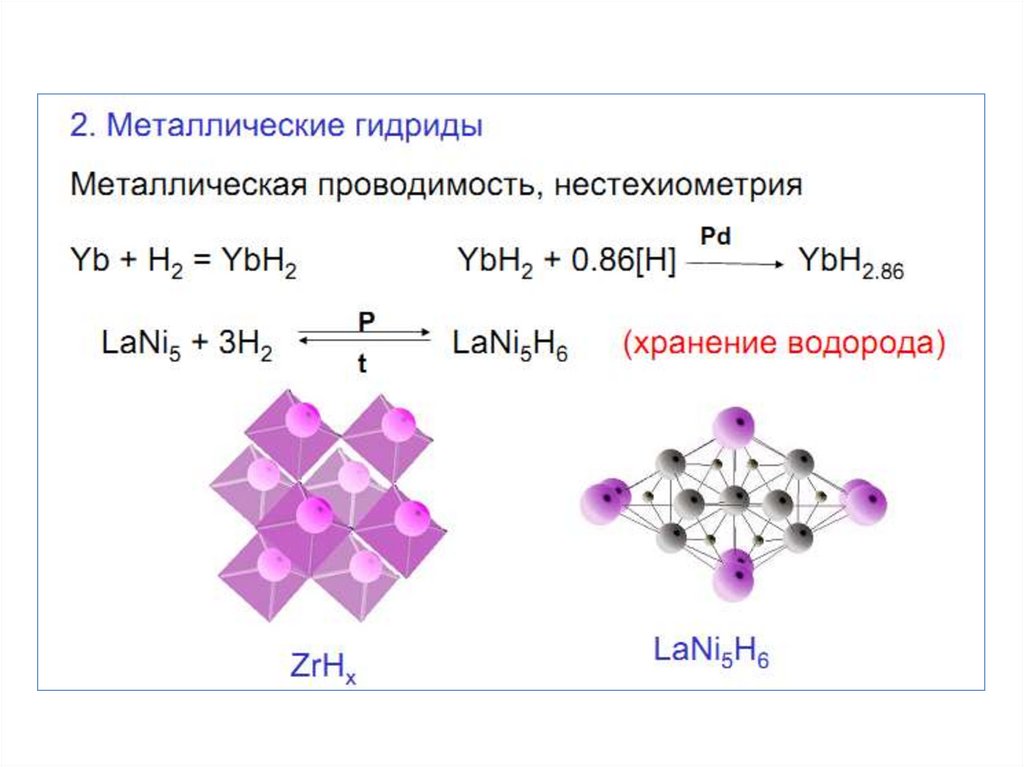
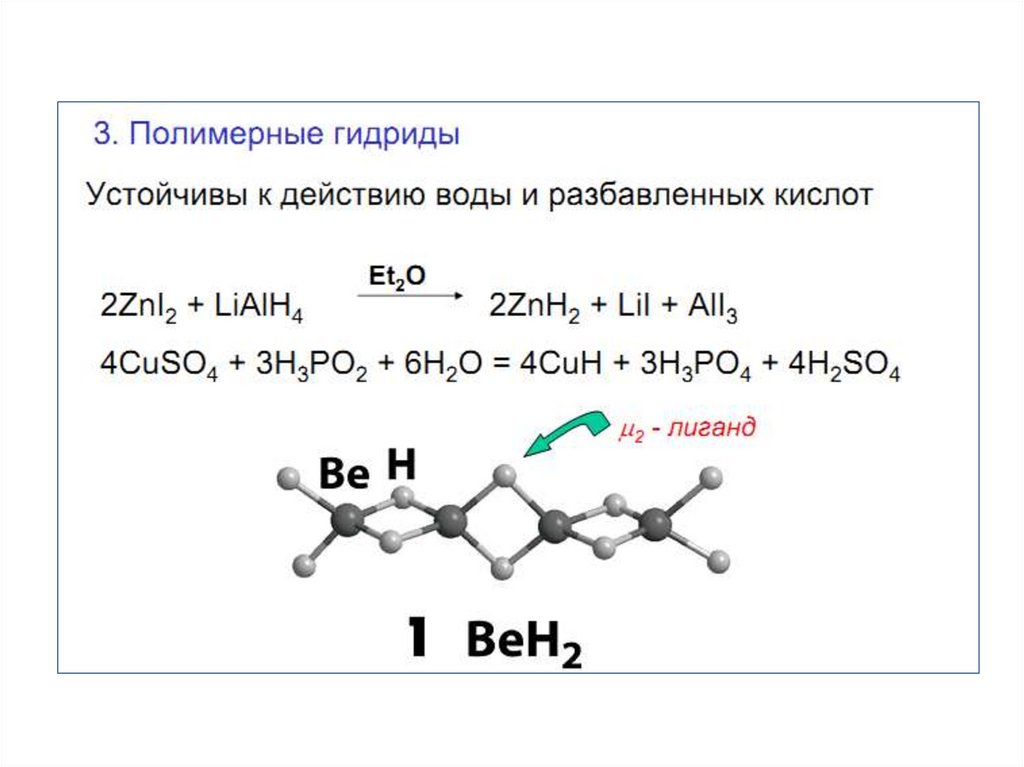
2. ВОДОРОД В ПС
3. Водород
4.
5.
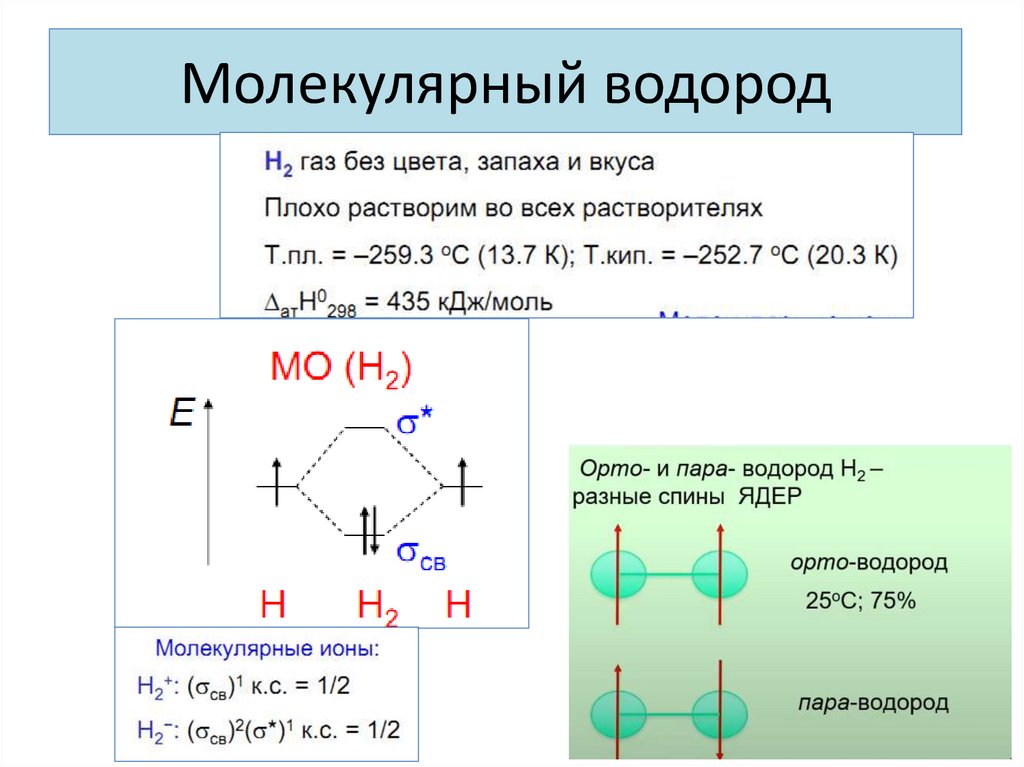
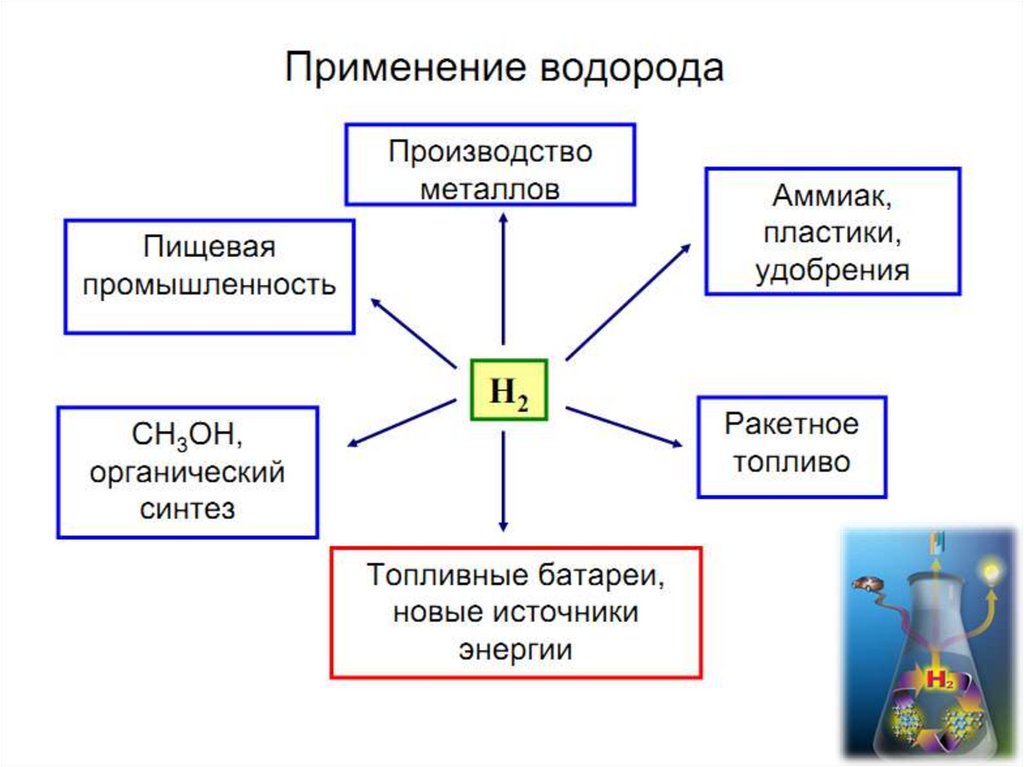
6. Молекулярный водород
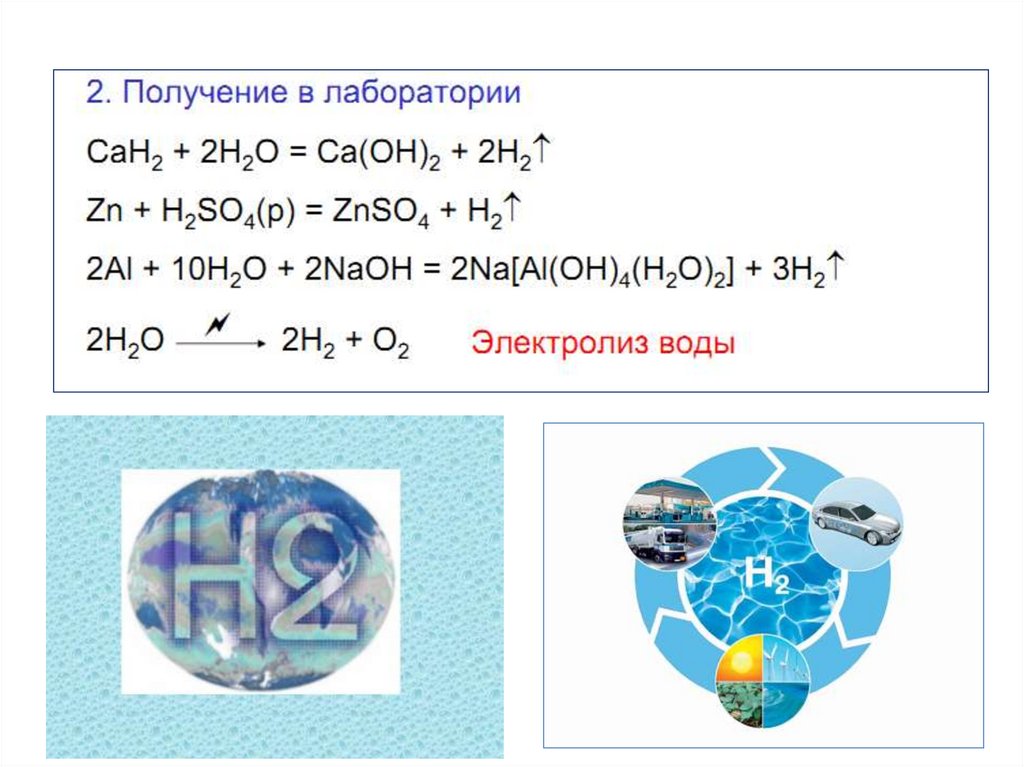
7. Получение водорода
8.
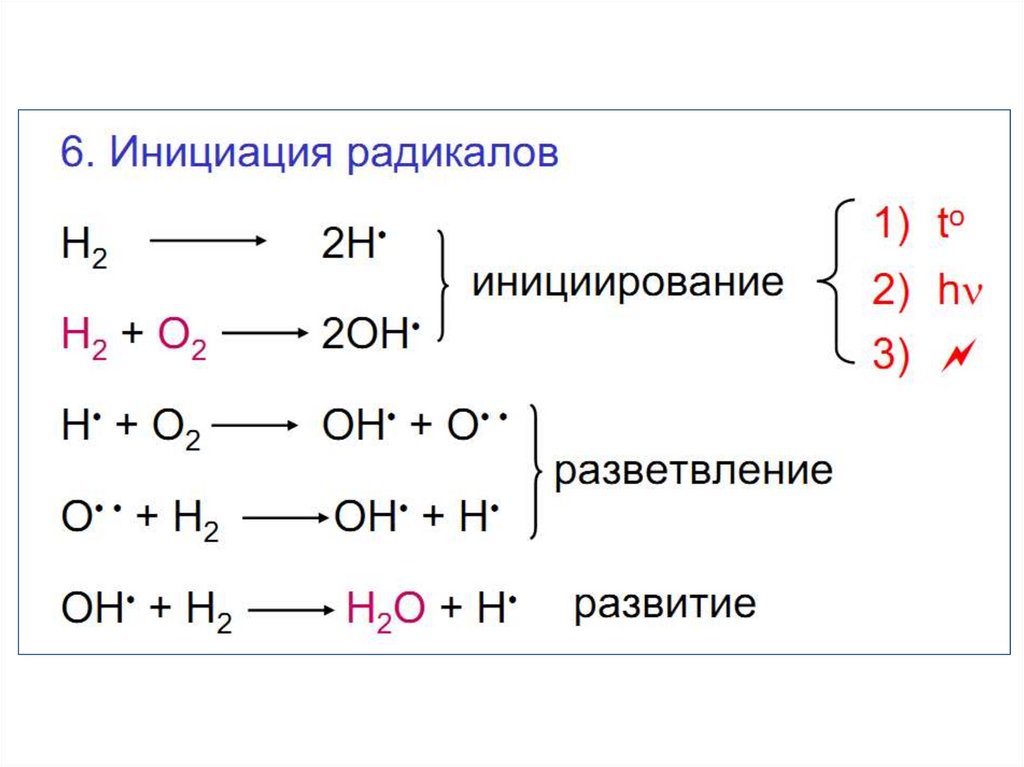
9. Свойства водорода
10.
11.
12.
13.
14.
15.
16.
17.
18.
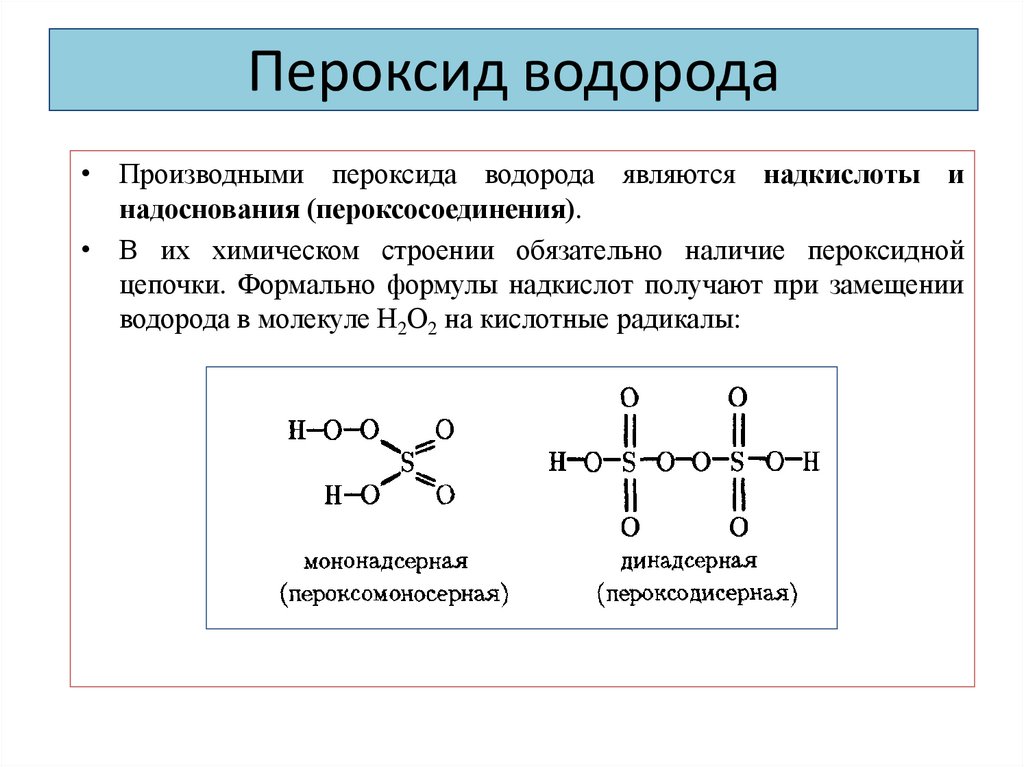
2HSO4 – 2е- = H2S2O8; H2S2O8 + 2Н2О = 2H2SO4 + Н2О219. Пероксид водорода
• Производными пероксида водорода являются надкислоты инадоснования (пероксосоединения).
• В их химическом строении обязательно наличие пероксидной
цепочки. Формально формулы надкислот получают при замещении
водорода в молекуле Н2О2 на кислотные радикалы:
20.
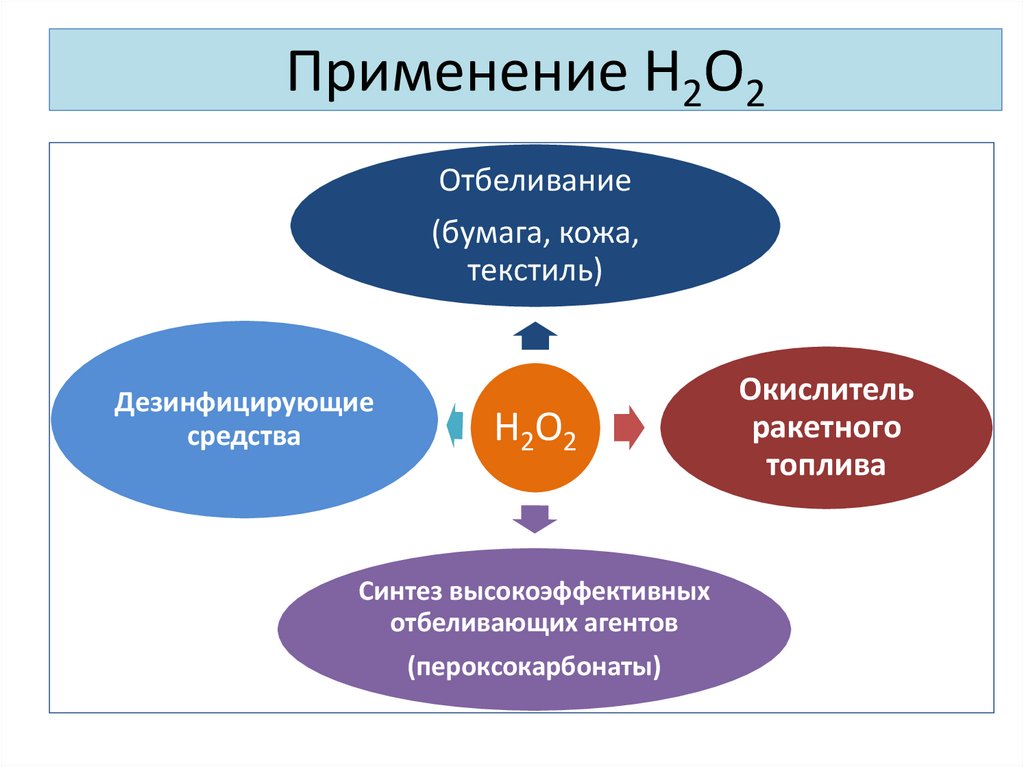
21. Применение Н2О2
Отбеливание(бумага, кожа,
текстиль)
Дезинфицирующие
средства
Н 2О 2
Синтез высокоэффективных
отбеливающих агентов
(пероксокарбонаты)
Окислитель
ракетного
топлива
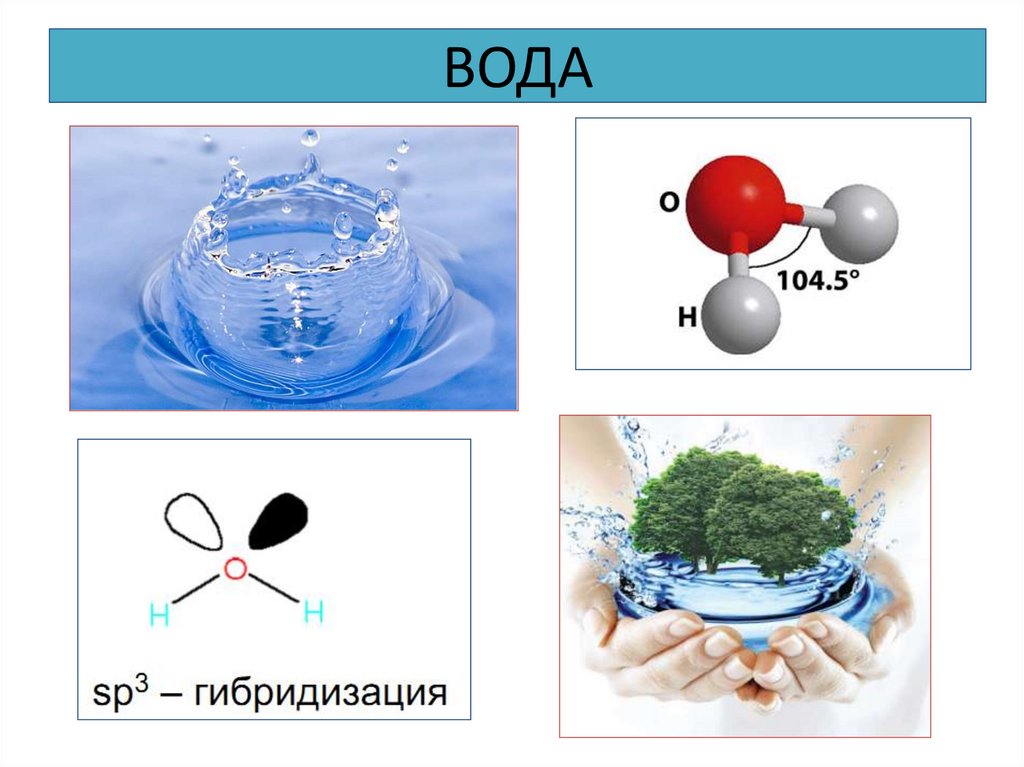
22. ВОДА
23.
24. Тяжелая вода D2O (tпл = 3,813С, tкип = 101,43С)
Тяжелая вода D2O(tпл = 3,813 С, tкип = 101,43 С)
• Бесцветная гигроскопичная жидкость,
более вязкая чем обычная вода;
растворяющая способность ниже чем у
обычной воды.
• Химические свойства Н2О и D2O
одинаковы, но все реакции с участием D2O
и в D2O как растворителе протекают
медленнее, чем для Н2О.
• Содержится в природных водах - массовое
соотношения D2О: Н2О = 1:5500















 chemistry
chemistry








