Similar presentations:
Анализ 3% раствора водорода пероксида
1. Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям по фармацевтической химии для студентов 3 курса
Анализ 3% раствораводорода пероксида
2.
Водорода пероксида от 7,5 до 11 г(в зависимости от фактического содержания
H2O2 в исходном препарате)
Натрия бензоата 0,05 г
Воды очищенной до 100 мл
3.
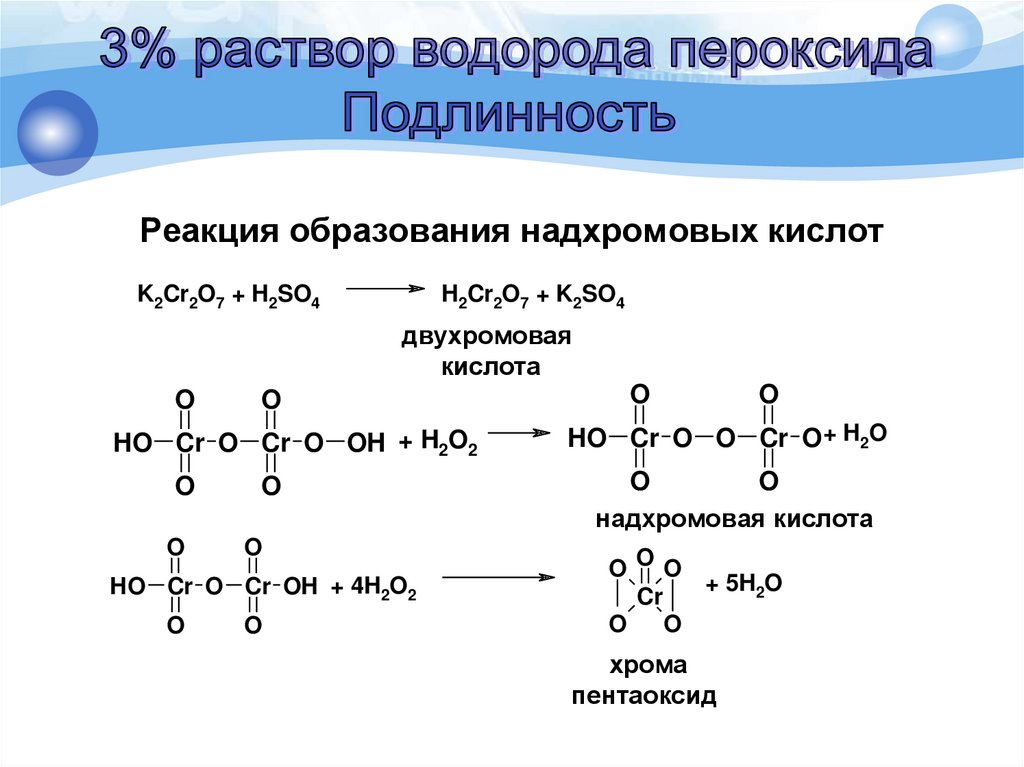
Реакция образования надхромовых кислотМетодика. К 1 мл препарата прибавляют 0,2 мл
серной кислоты разведенной 16%, 2 мл эфира,
0,2 мл 5% раствора калия дихромата и
взбалтывают. Эфирный слой окрашивается
в синий цвет.
4.
Реакция образования надхромовых кислотK2Cr2O7 + H2SO4
H2Cr2O7 + K2SO4
двухромовая
кислота
O
O
HO Cr O Cr O OH + H2O2
O
O
O
O
HO Cr O Cr OH + 4H2O2
O
O
O
O
+ H2O
HO Cr O O Cr OH
O
O
надхромовая кислота
OOO
+ 5H2O
Cr
O
O
хрома
пентаоксид
5.
Реакция образования надхромовых кислотокрашивание
эфирного
слоя в синий
цвет
6.
Перманганатометрический метод5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2О
H2O2 –2ē → 2H+ + O2
Методика. 10 мл препарата помещают в мерную колбу
вместимостью 100 мл и доводят объем раствора водой до
метки. К 10 мл полученного раствора прибавляют 5 мл
серной кислоты разведенной 16% и титруют 0,02М
раствором калия перманганата до слабо розового
окрашивания.
1 мл 0,02М раствора калия перманганата соответствует
0,001701 г водорода пероксида, которого в препарате
должно быть 2,7-3,3%.
7.
Перманганатометрический методТитрант: 0,02 М раствор калия перманганата.
Титруют без индикатора до слабо-розового
окрашивания.
Содержание водорода пероксида (С) в процентах в
препарате рассчитывают по формуле:
C(%)
TH
2O 2
KMnO 4
VKMnO K 100
4
a факт .
Фактическую навеску рассчитывают по формуле:
a факт .
10 10
1мл
100
8.
9.
Навескупрепарата
помещают
в мерную
колбу
10.
Доводятобъем
раствора в
мерной
колбе водой
до метки
11.
Раствортщательно
перемешивают
12.
Навеску разведенияпомещают в колбу
для титрования
13.
Прибавляют серную кислоту разведенную 16%14.
Титруют 0,02М раствором калия перманганатадо слабо розового окрашивания
15.
Окраска раствора в конце титрования16.
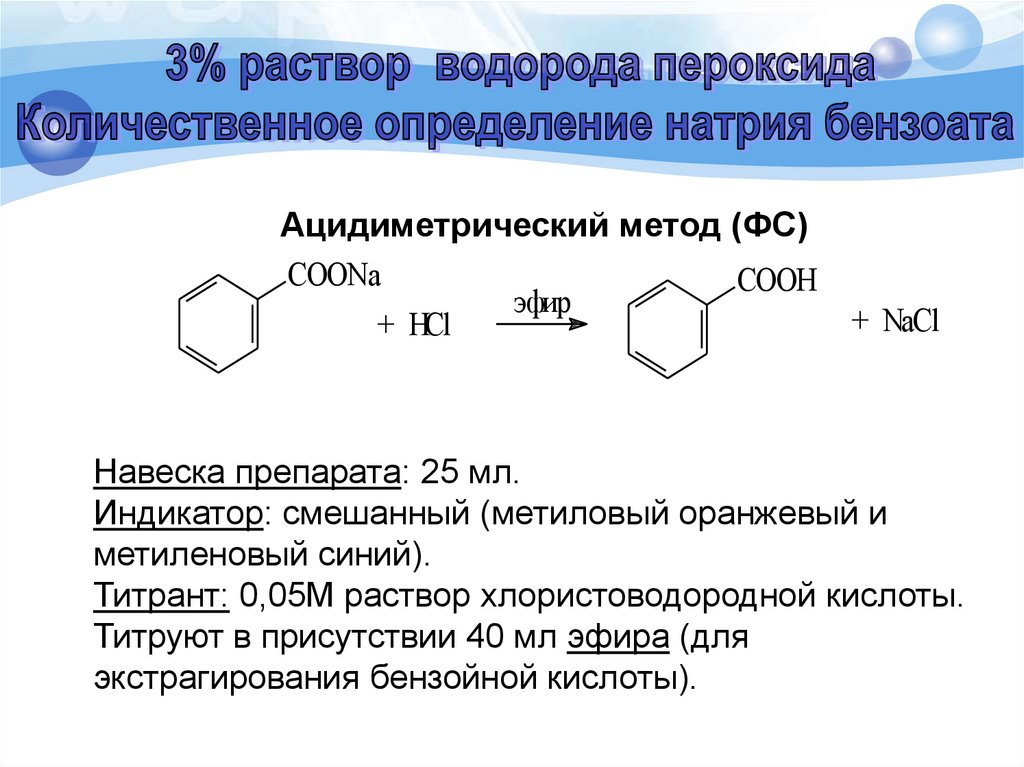
Ацидиметрический метод (ФС)COONa
+ HCl
эфир
COOH
+ NaCl
Навеска препарата: 25 мл.
Индикатор: смешанный (метиловый оранжевый и
метиленовый синий).
Титрант: 0,05М раствор хлористоводородной кислоты.
Титруют в присутствии 40 мл эфира (для
экстрагирования бензойной кислоты).
17.
Недостатки методики ФС:• нечеткий переход окраски индикатора не позволяет
точно фиксировать точку эквивалентности;
• на титрование расходуется около 1,7 мл титранта, что
не обеспечивает требуемую точность анализа;
• в методике используется токсичный и огнеопасный
реагент (эфир).
В связи с этим необходима разработка новых методик
количественного определения натрия бензоата
в 3% растворе водорода пероксида.
18.
Спектрофотометрический методМетодика разработана на кафедре фармацевтической химии факультета
очного обучения.
Преимущества методики:
• простота;
• экономичность;
• чувствительность;
• точность.
Методика. 1 мл препарата помещают в фарфоровую чашку, добавляют 5 мл
0,1М раствора натрия гидроксида и выпаривают на кипящей водяной бане
досуха. Сухой остаток количественно переносят водой в мерную колбу
вместимостью 50 мл, доводят объем раствора водой до метки и
перемешивают. У полученного раствора измеряют оптическую плотность на
спектрофотометре при 224 нм в кювете с толщиной слоя 1 см. В качестве
раствора сравнения используют 0,01М раствор натрия гидроксида.
Параллельно
измеряют
оптическую
плотность
раствора
рабочего
стандартного образца (РСО) натрия бензоата.
19.
Спектрофотометрический методПриготовление раствора РСО натрия бензоата. Около 0,05 г (точная
навеска) натрия бензоата (ФС 42-2458-94) помещают в мерную колбу
вместимостью 100 мл, растворяют в 50 мл воды, доводят объем раствора
водой до метки и перемешивают. 1 мл полученного раствора помещают в
мерную колбу вместимостью 50 мл, прибавляют 5 мл 0,1М раствора натрия
гидроксида, доводят объем раствора водой до метки и перемешивают.
Содержание натрия бензоата в препарате в процентах (Х) вычисляют по
формуле:
A ao
X
Ao
A – оптическая плотность испытуемого раствора;
Аo – оптическая плотность раствора РСО натрия бензоата;
аo – навеска РСО натрия бензоата, г.
20.
Навеску препарата помещают в фарфоровую чашку21.
Прибавляют 5 мл 0,1М раствора натрия гидроксида22.
Выпаривают на кипящей водяной бане досуха23.
Сухой остатокколичественно
переносят водой
в мерную колбу
вместимостью
50 мл
24.
Доводятобъем
раствора в
мерной
колбе водой
до метки
25.
Растворперемешивают
26.
У полученного раствора измеряют оптическую плотность наспектрофотометре при 224 нм в кювете с толщиной слоя 1 см. В качестве
раствора сравнения используют 0,01М раствор натрия гидроксида
27.
Параллельно измеряют оптическую плотность растворарабочего стандартного образца натрия бензоата
28.
1. Беликов, В.Г. Фармацевтическая химия / 4-е изд., перераб. и доп. – М.,МЕДпрессинформ", 2008. – 613 с.
2. Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос.
Федерации. – 10-е изд. – М.: Медицина, 1968. – 1079 с.
3. Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос.
Федерации. – 11-е изд., доп. – М.: Медицина, 1987. Вып. 1. – 336 с.
4. Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос.
Федерации. – 11-е изд., доп. – М.: Медицина, 1989. Вып. 2. – 400 с.
5. Государственная фармакопея Российской Федерации [Текст]. – 12-е изд. –
М.: Науч. центр экспертизы средств мед. применения, 2007. – Ч. 1. – 696 с.
6. Практическое руководство к лабораторным занятиям по фармацевтической
химии для студентов III курса / Т.И. Ярыгина, О.Л. Визгунова, В.А. Дубовик и
др. / под ред. Л.М. Коркодиновой – Пермь, 2011. – 102 с.
7. Руководство к лабораторным занятиям по фармацевтической химии: учеб.
пособие / Э.Н. Аксенова, О.П. Андрианова, А.П. Арзамасцев и др. / под. ред.
А.П. Арзамасцева. – 3-е изд., перераб. и доп. – М., Медицина, 2001. – 384
с. : ил.1.
8. Ярыгина
Т.И.
Количественное
определение
натрия
бензоата
спектрофотометрическим методом в растворе перекиси водорода [Текст] /
Т.И. Ярыгина, О.Е. Саттарова // Фармация. – 2010. - №5. - С. 10-12.
29. Иллюстрированные методики подготовили:
Саттарова Ольга Евгеньевна,доцент кафедры фармацевтической
химии факультета очного обучения
ГБОУ ВПО ПГФА,
кандидат фармацевтических наук,
директор Центра дистанционного обучения.
Ярыгина Татьяна Ивановна,
профессор кафедры фармацевтической химии
факультета очного обучения ГБОУ ВПО ПГФА,
доктор фармацевтических наук.



























 chemistry
chemistry








