Similar presentations:
Предмет физической химии
1. Предмет физической химии
2. Учебная литература
Курс физической химии: В 2-х т. Т 1./ Под ред.Я.И. Герасимова. Изд. 2. М.: Химия. 1969.
Стромберг А.Б., Семченко Д.П. Физическая
химия. М.: Высшая школа. 1999 (1988).
Зимон А. Д. Физическая химия. М. : Агар, 2006.
Горшков В. И. Основы физической химии / В. И.
Горшков, И. А. Кузнецов. - М.: БИНОМ.
Лаборатория знаний, 2011.
Белик В.В., Киенская К.И. Физическая и
коллоидная химия. М. : Академия, 2007.
3. Методическая и справочная литература
Краткийсправочник
физико-химических
величин / Под ред. А.А. Равделя, А.М.
Пономаревой- СПб.: Иван Федоров, 2002.
Калинина Л.А. Лабораторный практикум по
физической химии. Методические указания к
лабораторным работам. Часть 1. ВятГУ, 2003.
Калинина Л.А. Лабораторный практикум по
физической химии. Часть 2. Уч. Пособие, ВятГУ,
2008.
Фоминых Е.Г. Физическая химия: Уч. Пособие,
ВятГУ, 2014.
4. Физическая химия (ФХ) – наука о применении теоретических и экспериментальных методов физики для решения химических проблем.
• Химические превращения сопровождаютсяили инициируются физическими явлениями.
• ФХ рассматривает химические процессы в
неразрывной
связи
с
физическими
явлениями.
• Задача ФХ – установить эти взаимосвязи и
дать их количественное описание.
5.
Основные разделы ФХХимическая термодинамика (ХТД)
На основе всеобщих термодинамических законов рассматривает
особенности тепло- и массообмена при протекании химических
реакций.
Практические приложения ХТД:
Термохимия
Учение о химическом равновесии
Учение о фазовых равновесиях
Учение о растворах
Электрохимия
Химическая кинетика и катализ
Квантовая химия и строение вещества
6. Химическая термодинамика
Основные понятияхимической термодинамики
7.
• ХТД изучает взаимные превращения массы и энергии(в форме теплоты и работы) при протекании
химических реакций.
Термодинамический подход к описанию реакций позволяет
1) установить
возможность
(невозможность)
осуществления
химической реакции в заданных условиях;
2) предсказать
направление
самопроизвольного
протекания
процесса;
3) определить предел протекания процесса (условия достижения
химического
равновесия).
Объект изучения термодинамики – термодинамическая
система (ТДС). ХТД рассматривает только макроскопические
системы.
ТДС – тело или группа тел, отделенные от окружающего
мира реальной или мысленной поверхностью.
8.
ТДСГомогенная
–
система,
свойства которой одинаковы в
любой точке или изменяются
плавно и непрерывно
Открытая
–
обмен
веществом и энергией
Изолированная
Гетерогенная
–
система,
состоящая
из
нескольких
гомогенных частей или фаз.
На поверхности раздела фаз
свойства системы изменяются
скачкообразно.
Закрытая
–
только энергией
обмен
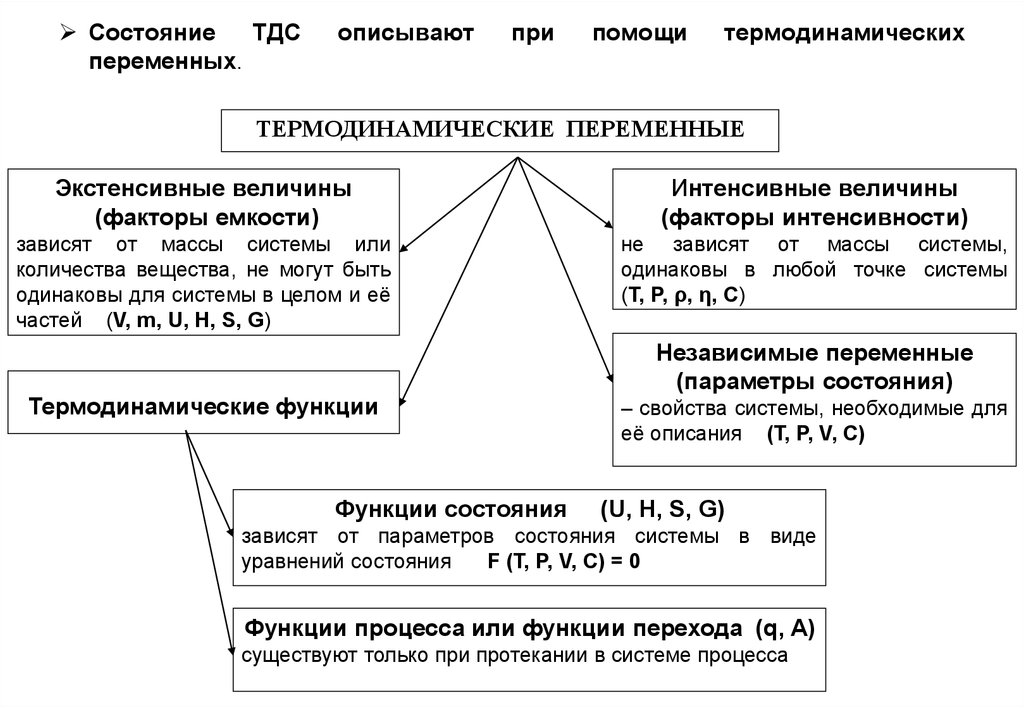
9. Состояние ТДС описывают при помощи термодинамических переменных.
СостояниеТДС
переменных.
описывают
при
помощи
термодинамических
ТЕРМОДИНАМИЧЕСКИЕ ПЕРЕМЕННЫЕ
Экстенсивные величины
(факторы емкости)
Интенсивные величины
(факторы интенсивности)
зависят от массы системы или
количества вещества, не могут быть
одинаковы для системы в целом и её
частей (V, m, U, H, S, G)
не зависят от массы системы,
одинаковы в любой точке системы
(Т, P, ρ, η, C)
Термодинамические функции
Функции состояния
Независимые переменные
(параметры состояния)
– свойства системы, необходимые для
её описания (Т, P, V, C)
(U, H, S, G)
зависят от параметров состояния системы в виде
уравнений состояния
F (Т, P, V, C) = 0
Функции процесса или функции перехода (q, A)
существуют только при протекании в системе процесса
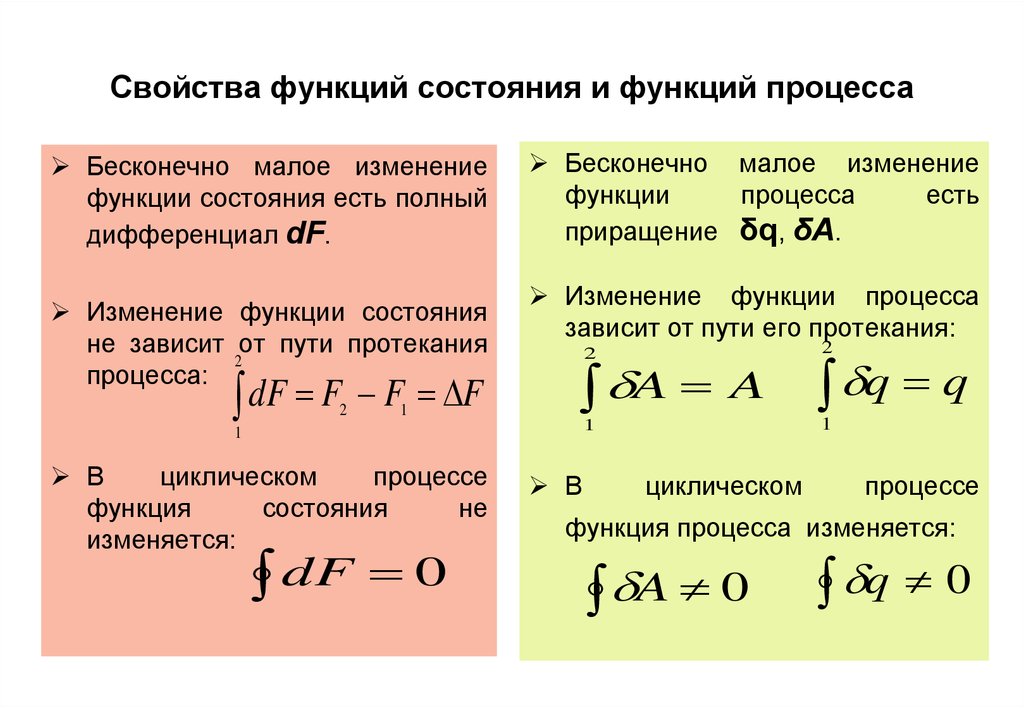
10. Свойства функций состояния и функций процесса
Бесконечно малое изменениефункции состояния есть полный
дифференциал dF.
Изменение функции состояния
не зависит от пути протекания
2
процесса:
dF F2 F1 F
Бесконечно малое изменение
функции
процесса
есть
приращение δq, δA.
Изменение функции процесса
зависит от пути его протекания:
A
dF 0
A
1
1
В
циклическом
процессе
функция
состояния
не
изменяется:
2
2
В
циклическом
q q
1
процессе
функция процесса изменяется:
A 0
q 0
11. Теплота и работа – два способа передачи энергии.
Теплота – энергия передается за счет хаотического движениячастиц.
q > 0 – теплота поглощается системой – эндотермический
процесс
q < 0 – теплота выделяется из системы – экзотермический
процесс
Работа (A или W)– энергия передается за счет направленного
движения макрообъектов.
А < 0 – работа совершается внешними силами над системой
А > 0 – работу совершает сама система
А = АМЕХ + АПОЛ
АМЕХ = PΔV – механическая работа, т. е. работа расширения или
сжатия газа
АПОЛ – полезная работа (химическая, электрическая, магнитная,
сил поверхностного натяжения и др.)
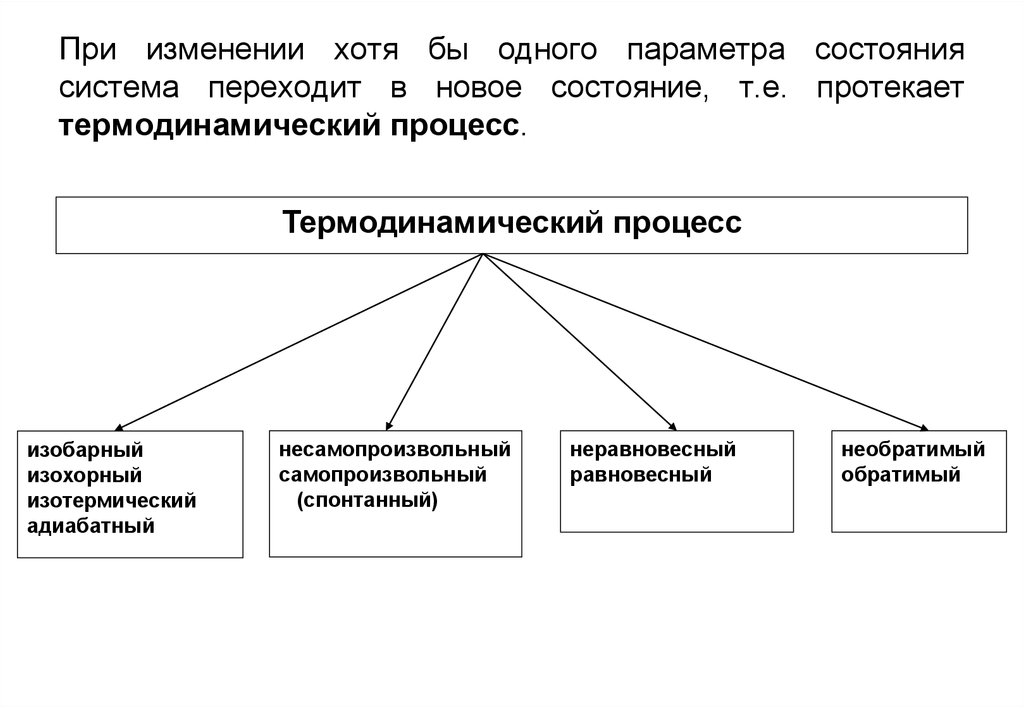
12. При изменении хотя бы одного параметра состояния система переходит в новое состояние, т.е. протекает термодинамический процесс.
Термодинамический процессизобарный
изохорный
изотермический
адиабатный
несамопроизвольный
самопроизвольный
(спонтанный)
неравновесный
равновесный
необратимый
обратимый
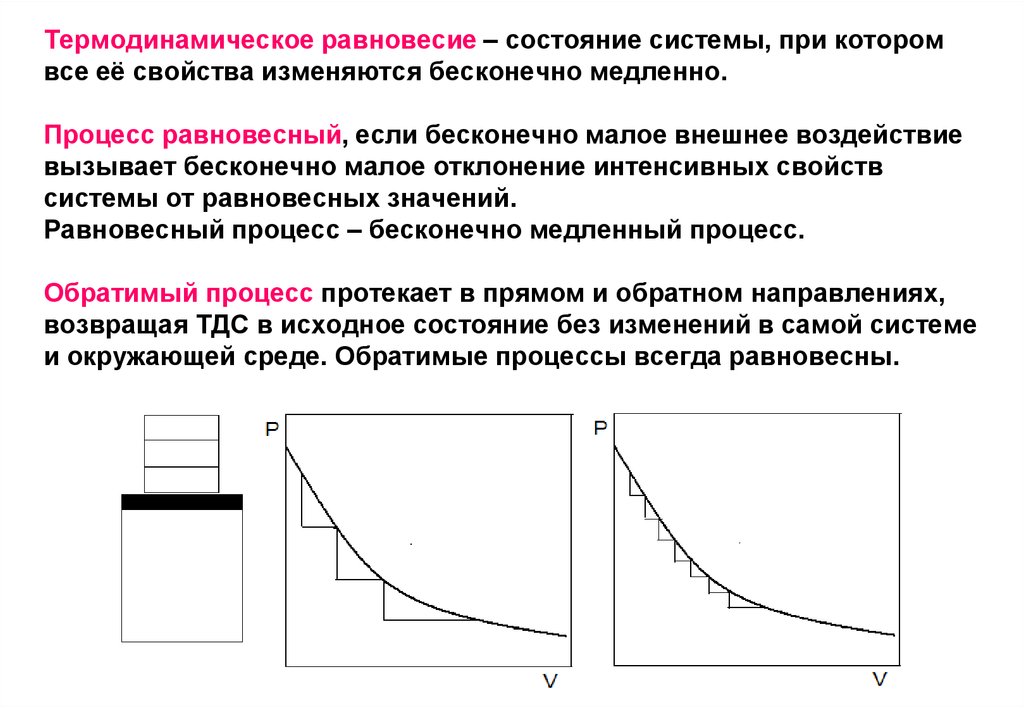
13. Термодинамическое равновесие – состояние системы, при котором все её свойства изменяются бесконечно медленно. Процесс равновесный, если
Термодинамическое равновесие – состояние системы, при которомвсе её свойства изменяются бесконечно медленно.
Процесс равновесный, если бесконечно малое внешнее воздействие
вызывает бесконечно малое отклонение интенсивных свойств
системы от равновесных значений.
Равновесный процесс – бесконечно медленный процесс.
Обратимый процесс протекает в прямом и обратном направлениях,
возвращая ТДС в исходное состояние без изменений в самой системе
и окружающей среде. Обратимые процессы всегда равновесны.
14. Первое начало термодинамики
I закон термодинамики- закон сохранения энергии для
тепловых процессов, в которых энергия передается в виде
теплоты и работы.
Вечный двигатель первого рода не существует.
В изолированной системе различные формы энергии
переходят друг в друга в строго эквивалентных
количествах, т. е. внутренняя энергия изолированной
системы постоянна.
Внутренняя энергия – суммарная энергия ТДС, включающая
кинетическую энергию движения всех видов частиц и
потенциальную энергию их взаимодействия.
Внутренняя энергия закрытой системы есть разность
теплоты, подводимой к системе, и работы, которую
совершает система U = q – A .
15.
dU = δq – δA − дифференциальная форма2
2
2
1
1
1
(1)
dU q A
∆U = q – A − интегральная форма
(2)
∆U = q – Aпол− Амех = q – Aпол− PΔV = Q − PΔV
(3)
Q = q – Aпол − тепловой эффект реакции по Кирееву (4)
Aпол = 0 → Q = q
dU = δQ – PdV − дифференциальная форма
∆U = Q – PΔV − интегральная форма
(5)
(6)
16. Теплота и работа в различных процессах dU = δQ – PdV (5)
1) Изохорный процесс V=constdV=0
dU = δQV
ΔU = QV
- в изохорном
процессе вся теплота, подводимая к системе,
расходуется на увеличение её внутренней энергии;
- тепловой эффект изохорного процесса не зависит от пути
процесса, т.к. равен изменению функции состояния внутренней
энергии
δАмех=PdV
Амех=0
- в изохорном процессе нельзя получить механическую работу
17. dU = δQ – PdV (5)
2) Изобарный процесс P=const2
2
2
1
1
1
dU Q P dV
Q U U P V V
U PV U PV H
2
2
1
2
2
1
1
1
2
H1
Q P H
- тепловой эффект изобарного процесса не зависит от пути процесса, т.к.
равен изменению функции состояния энтальпии
Энтальпия – внутренняя энергия расширенной системы:
H U PV
H U PV U nRT
n изменение числа молей газообразных веществ
δАмех= PdV
→
Амех= PΔV
18. dU = δQ – PdV (5)
3) Изотермический процесс Т=constdU = 0 – внутренняя энергия идеального газа зависит
только от температуры.
δQ = PdV
QT AМЕХ
V2
P1
dV
PdV nRT
nRT ln
nRT ln
V1
P2
1
1 V
2
2
PV nRT
P1V1 P2V 2
- в изотермическом процессе вся теплота, подводимая к системе,
идет на совершение механической работы
19. dU = δQ – PdV (5)
3) Адиабатный процесс Q=constQ 0
dU PdV AМЕХ
U AМЕХ
- в адиабатном процессе работа совершается за счет убыли
внутренней энергии системы
АМЕХ dU C V dT C V T2 T1
2
2
1
1
dU C V dT
C V изохорная теплоемкость
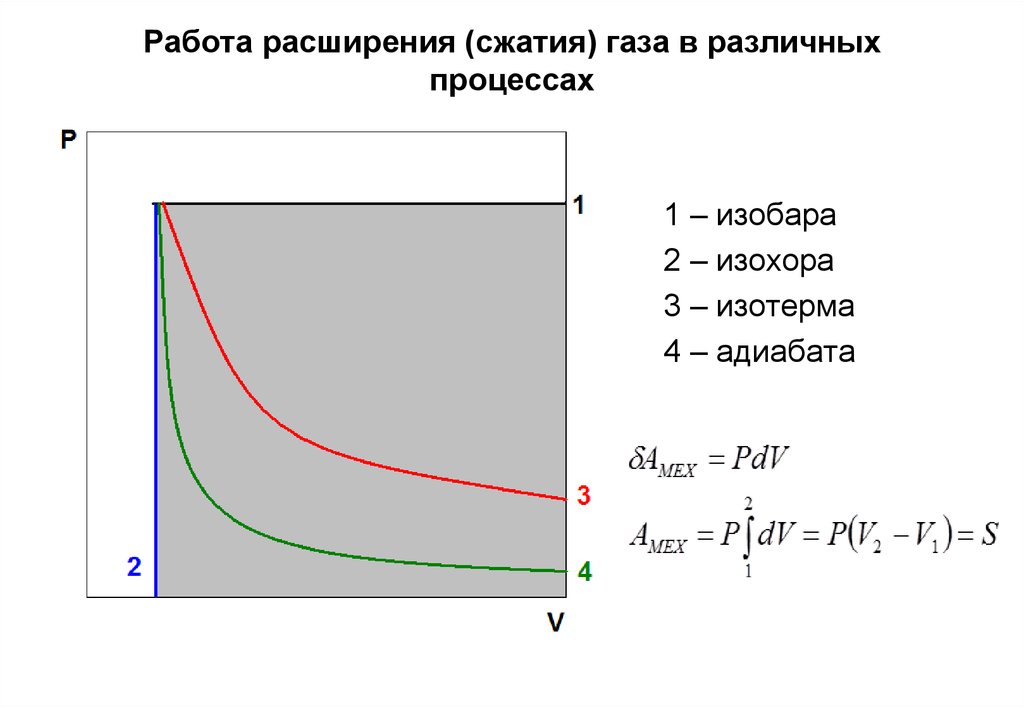
20. Работа расширения (сжатия) газа в различных процессах
1 – изобара2 – изохора
3 – изотерма
4 – адиабата















 physics
physics








