Similar presentations:
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
1.
Характеристика химическогоэлемента на основании его
положения в
Периодической системе
Д.И. Менделеева
2.
Описывать элемент1.7 пунктам
следует по
3.
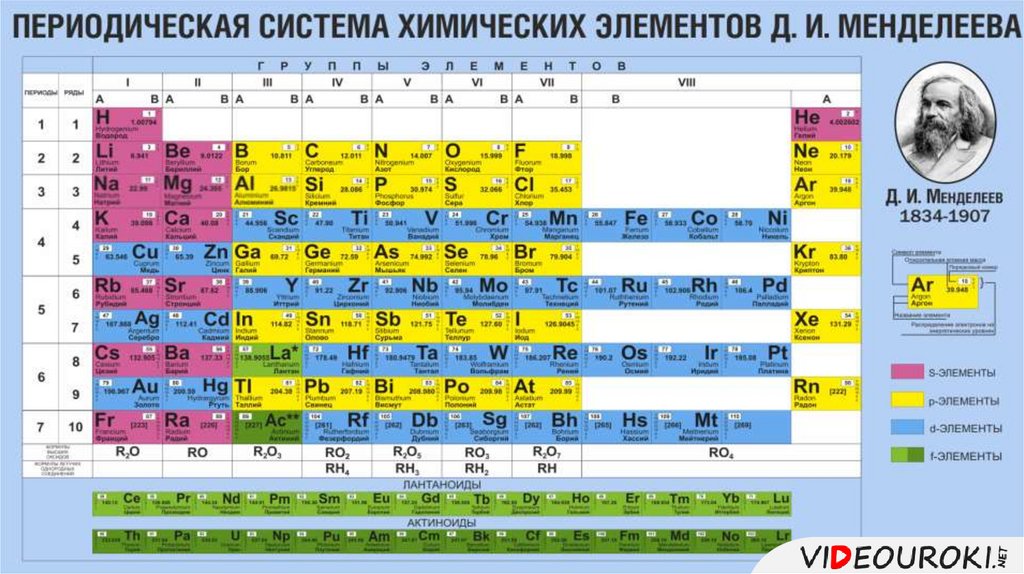
Положение элемента в1.
ПС и строение атома
4.
Характер простоговещества (металл
или
1.
неметалл)
5.
Сравнение свойствпростого вещества со
свойствами простых
1.
веществ, образованных
соседними по подгруппе
элементами
6.
Сравнение свойствпростого вещества со
свойствами простых
1.
веществ, образованных
соседними по периоду
элементами
7.
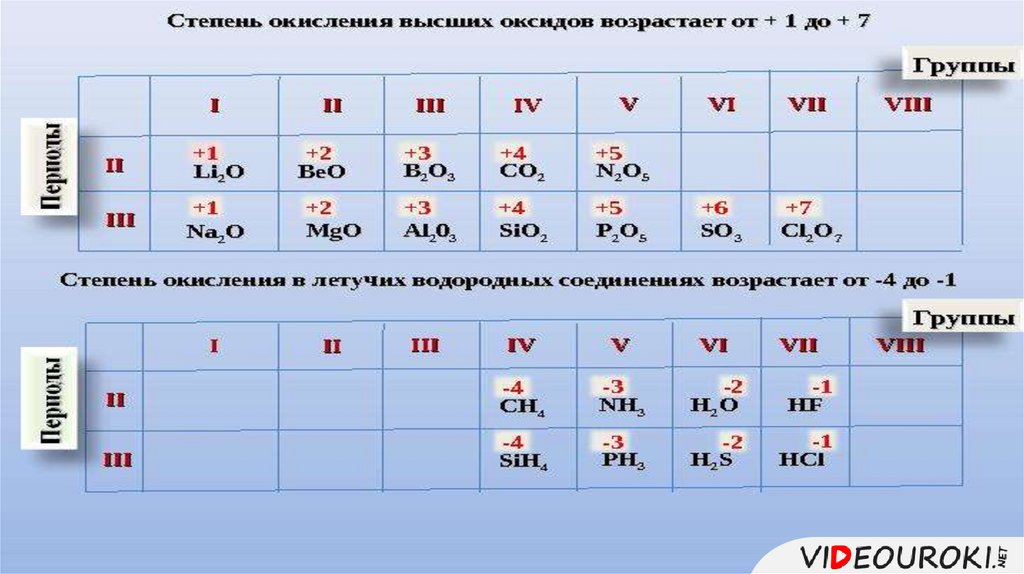
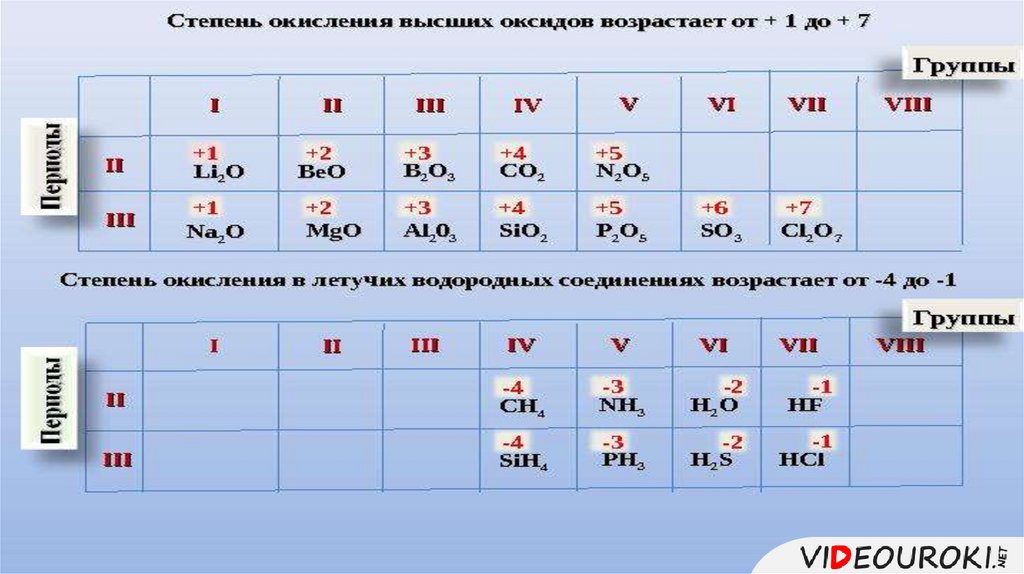
Состав высшего оксида,его характер 1.
(основный,
кислотный, амфотерный)
8.
Состав высшегогидроксида, его характер
(кислородсодержащая
1.
кислота, основание,
амфотерный гидроксид)
9.
Состав летучеговодородного1.соединения
(для неметаллов)
10.
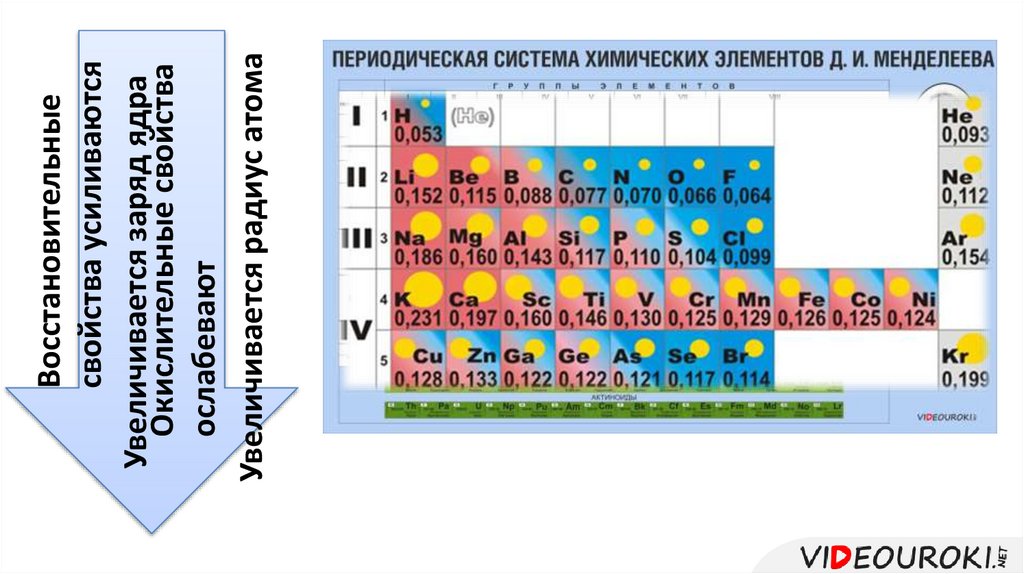
Восстановительныесвойства усиливаются
Увеличивается заряд ядра
Окислительные свойства
ослабевают
Увеличивается радиус атома
11.
12.
ОкислительныеВосстановительные
свойства
свойства
Уменьшается
радиус
атома
Увеличивается
заряд
ядра
усиливаются
ослабевают
13.
14.
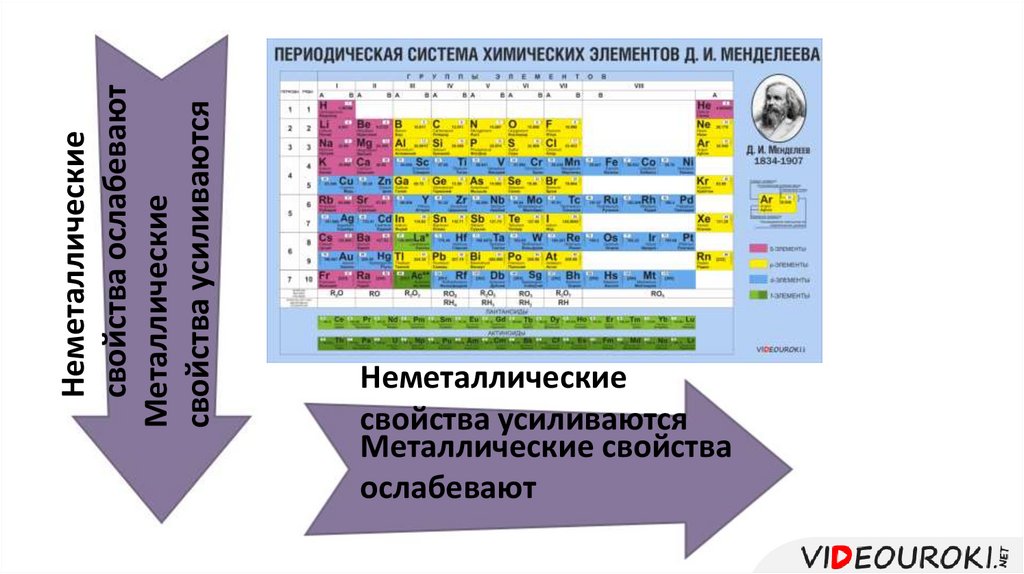
Неметаллическиесвойства ослабевают
Металлические
свойства усиливаются
Неметаллические
свойства усиливаются
Металлические свойства
ослабевают
15.
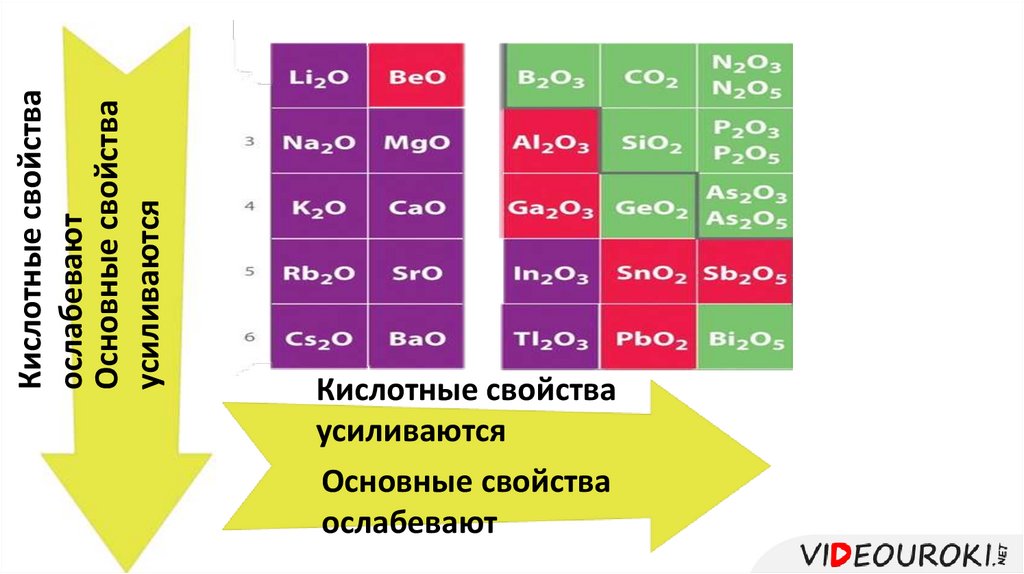
Кислотные свойстваослабевают
Основные свойства
усиливаются
Кислотные свойства
усиливаются
Основные свойства
ослабевают
16.
11Na
22,989
17.
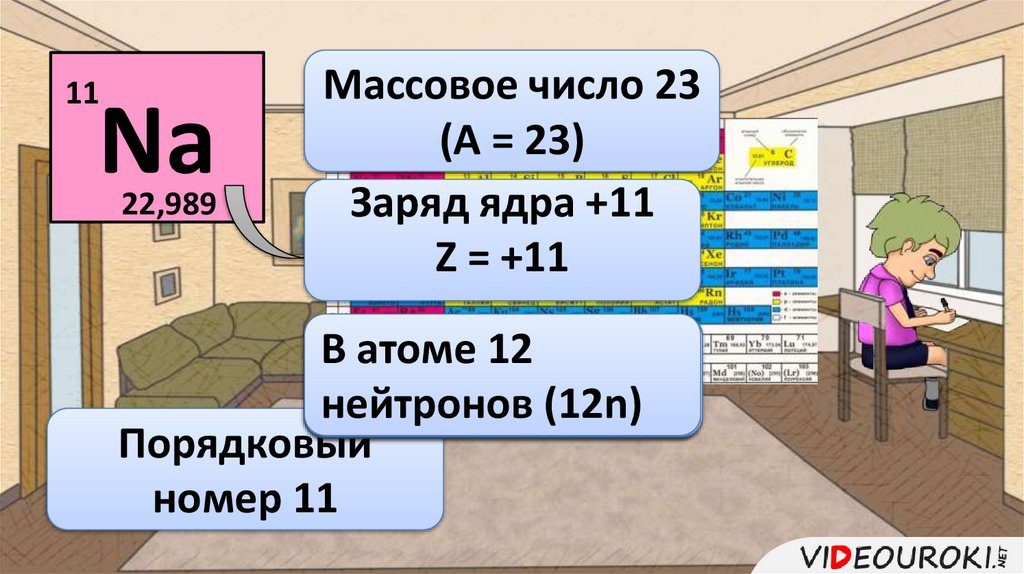
11Na
22,989
Массовое число 23
(А = 23)
Заряд ядра +11
Z = +11
В атоме
= 12
A – 11
Z
ВNатоме
нейтронов
23 – 11 =(12n)
12 ē)
электронов
(11
Порядковый
номер 11
18.
ВосстановительныеМеталл свойства
11
Na
22,989
Na ) ) )
2 8 1
19.
Металлическая химическая связьМеталлическая кристаллическая решетка
Металлический блеск
Пластичность
Тепло и – электропроводность
20.
21.
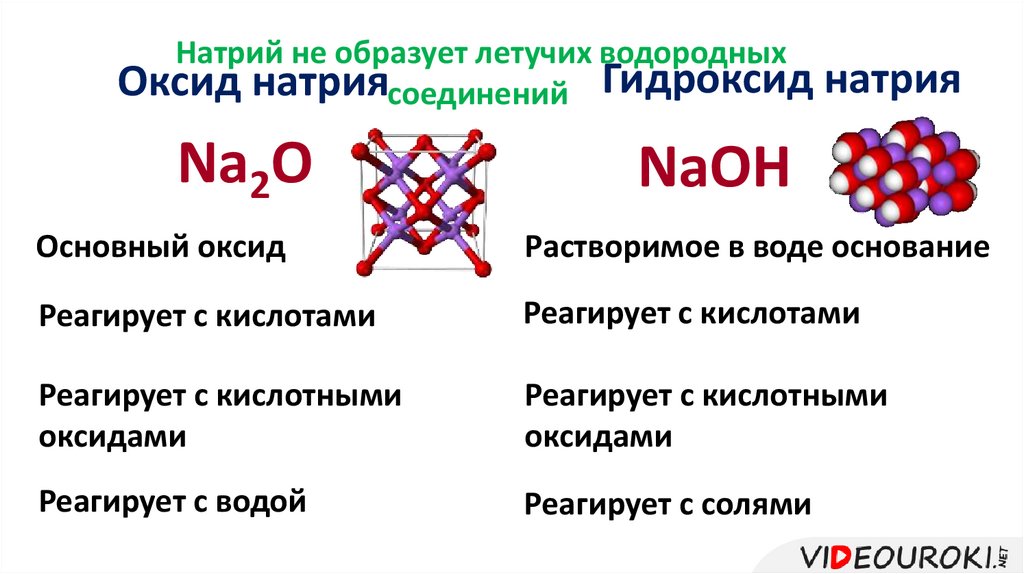
Натрий не образует летучих водородныхОксид натриясоединений Гидроксид натрия
Na2O
NaOH
Основный оксид
Растворимое в воде основание
Реагирует с кислотами
Реагирует с кислотами
Реагирует с кислотными
оксидами
Реагирует с кислотными
оксидами
Реагирует с водой
Реагирует с солями
22.
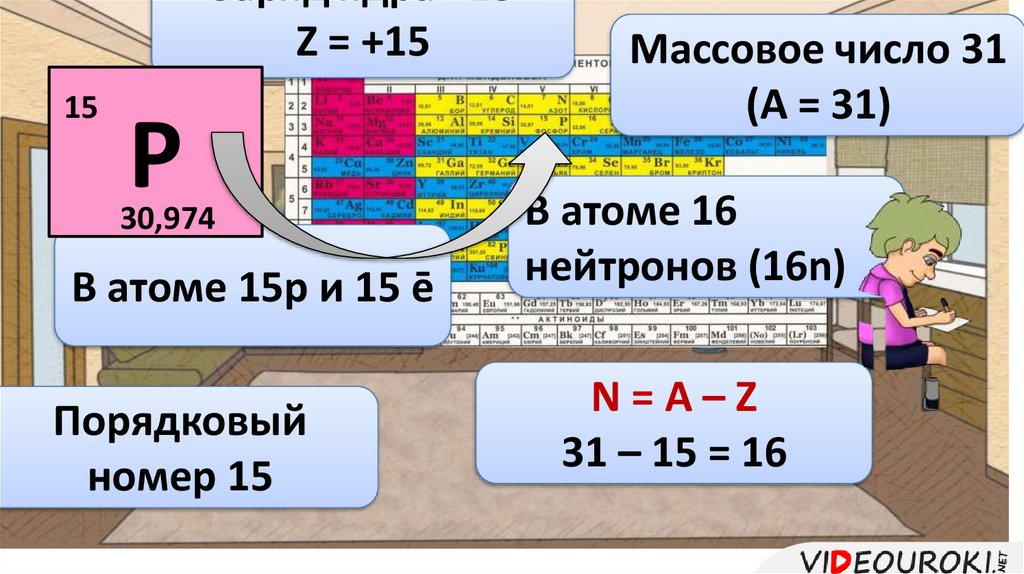
Заряд ядра +15Z = +15
15
Р
30,974
В атоме 15р и 15 ē
Порядковый
номер 15
Массовое число 31
(А = 31)
В атоме 16
нейтронов (16n)
N=A–Z
31 – 15 = 16
23.
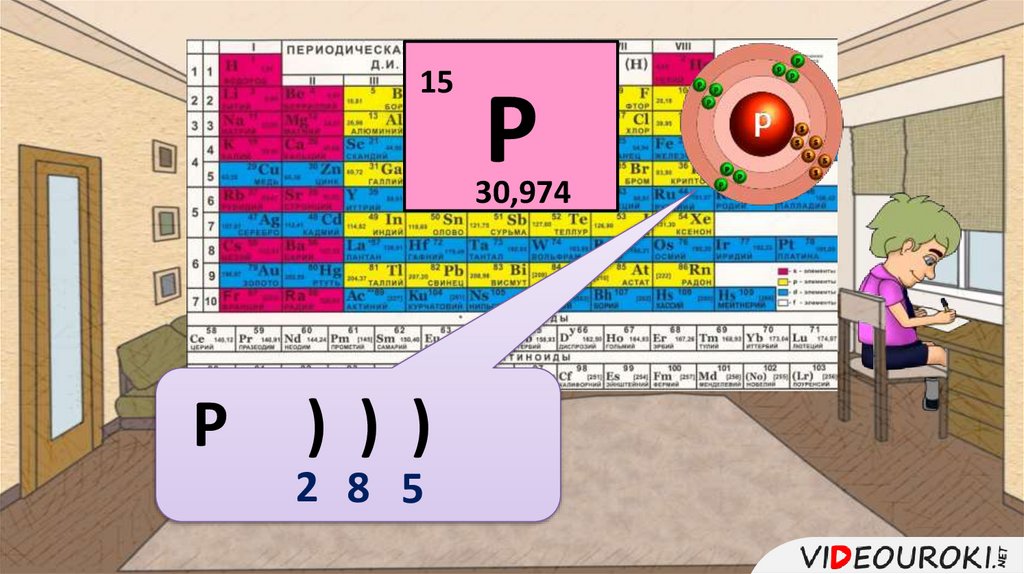
15Р
30,974
Р
) ) )
2 8 5
24.
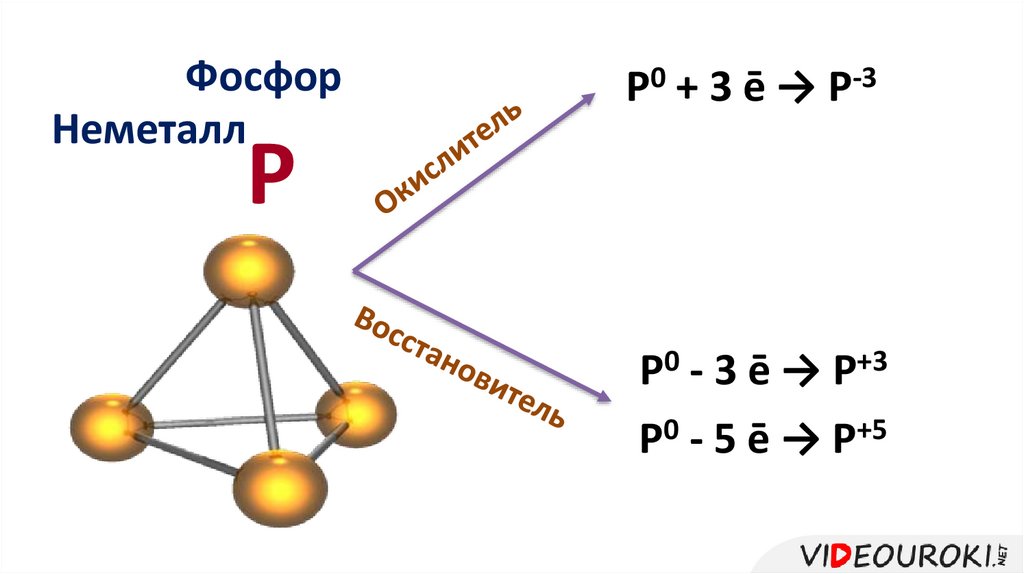
ФосфорНеметалл
Р0 + 3 ē → Р-3
Р
Р0 - 3 ē → Р+3
Р0 - 5 ē → Р+5
25.
Фосфор – неметаллХарактерно явление аллотропии
Белый фосфор
Красный фосфор
Чёрный фосфор
26.
27.
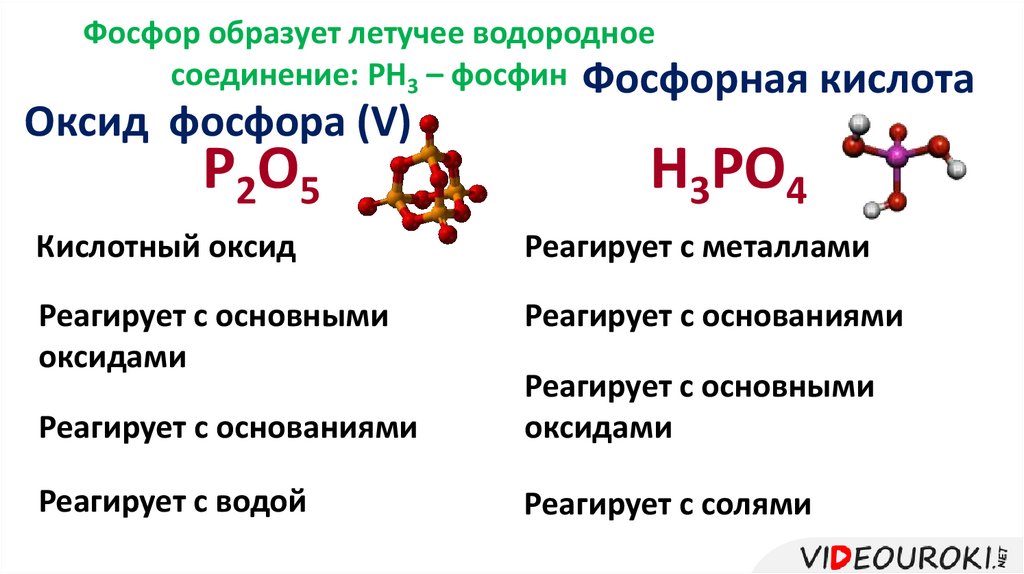
Фосфор образует летучее водородноесоединение: РН3 – фосфин Фосфорная кислота
Оксид фосфора (V)
P2O5
H3PO4
Кислотный оксид
Реагирует с металлами
Реагирует с основными
оксидами
Реагирует с основаниями
Реагирует с основаниями
Реагирует с основными
оксидами
Реагирует с водой
Реагирует с солями













 chemistry
chemistry








