Similar presentations:
Периодический закон и Периодическая система химических элементов Д.И. Менделеева
1.
Лекция на тему:«Периодический закон
и Периодическая система
химических элементов
Д.И. Менделеева»
Малахова М.И., преподаватель химии
ГБПОУ ВО «Россошанский колледж мясной и молочной промышленности»
2.
План• 1. Открытие Периодического закона
• 2. Периодическая таблица химических
элементов Д.И.Менделеева
• 3. Зависимость свойств химических
элементов от их положения в
периодической таблице
3.
Открытие Периодическогозакона
Открытию периодического закона
предшествовало накопление знаний о веществах и
свойствах. По мере открытия новых химических
элементов, изучения состава и свойств их соединений
появлялись первые попытки классифицировать
элементы по каким-либо признакам. В общей
сложности до Д.И. Менделеева было предпринято
более 50 попыток классификации химических
элементов. Ни одна из попыток не привела к созданию
системы, отражающей взаимосвязь элементов,
выявляющей природу их сходства и различия,
имеющей предсказательный характер.
4.
Открытие Периодического законаВ основу своей работы по классификации
химических элементов Д.И. Менделеев положил два их
основных и постоянных признака:
• величину атомной массы и
• свойства образованных химическими элементами
веществ.
Он выписал на карточки все известные сведения об
открытых и изученных в то время химических элементах
и их соединениях. Сопоставляя эти сведения, учёный
составил естественные группы сходных по свойствам
элементов. При этом он обнаружил, что свойства
элементов в некоторых пределах изменяются линейно
(монотонно усиливаются или ослабевают), затем после
резкого скачка повторяются периодически, т.е. через
определённое число элементов встречаются сходные.
5.
Что же было обнаружено?При переходе от лития к фтору происходит
закономерное ослабление металлических свойств и
усиление неметаллических.
При переходе от фтора к следующему по
значению атомной массы элементу натрию происходит
скачок в изменении свойств (Nа повторяет свойства
Li)
За Na следует Mg, который сходен с Ве - они
проявляют металлические свойства. А1, следующий за
Mg, напоминает В. Как близкие родственники, похожи
Si и С; Р и N; S и О; С1 и F.
При переходе к следующему за С1 элементу К
опять происходит скачок в изменении и химических
свойств.
6.
Периодический законД.И. Менделеева
Если написать ряды один под другим так,
чтобы под литием находился натрий, а под
неоном – аргон, то получим следующее
расположение элементов:
Li Be B C N O
Na Mg Al Si P S
F Ne
Cl Ar
При таком расположении в вертикальные
столбики попадают элементы, сходные по
своим свойствам.
6
7.
Первый вариантПериодической таблицы
На основании своих наблюдений 1
марта 1869 г. Д.И. Менделеев
сформулировал периодический
закон, который
в начальной своей
формулировке звучал так:
«свойства простых тел, а
также формы и свойства
соединений элементов
находятся в периодической
зависимости от величин
атомных весов элементов»
7
8.
Периодическая таблица Д.И. МенделееваУязвимым моментом периодического закона
сразу после его открытия было объяснение причины
периодического повторения свойств элементов с
увеличением относительной атомной массы их
атомов. Более того, несколько пар элементов
расположены в Периодической системе с
нарушением увеличения атомной массы. Например,
аргон с относительной атомной массой 39,948
занимает 18-е место, а калий с относительной
атомной массой 39,102 имеет порядковый номер 19.
Ar
18
К
аргон
калий
39,948
39,102
19
9.
Периодический закон Д.И. МенделееваТолько с открытием строения атомного ядра и
установлением физического смысла порядкового
номера элемента стало понятно, что в Периодической
системе расположены в порядке увеличения
положительного заряда их атомных ядер. С этой
точки зрения никакого нарушения в
последовательности элементов 18Ar – 19K, 27Co – 28Ni,
52Te – 53I, 90Th – 91Pa не существует. Следовательно,
современная трактовка Периодического закона звучит
следующим образом:
Свойства химических элементов и
образуемых ими соединений находятся в
периодической зависимости от величины
заряда их атомных ядер.
10.
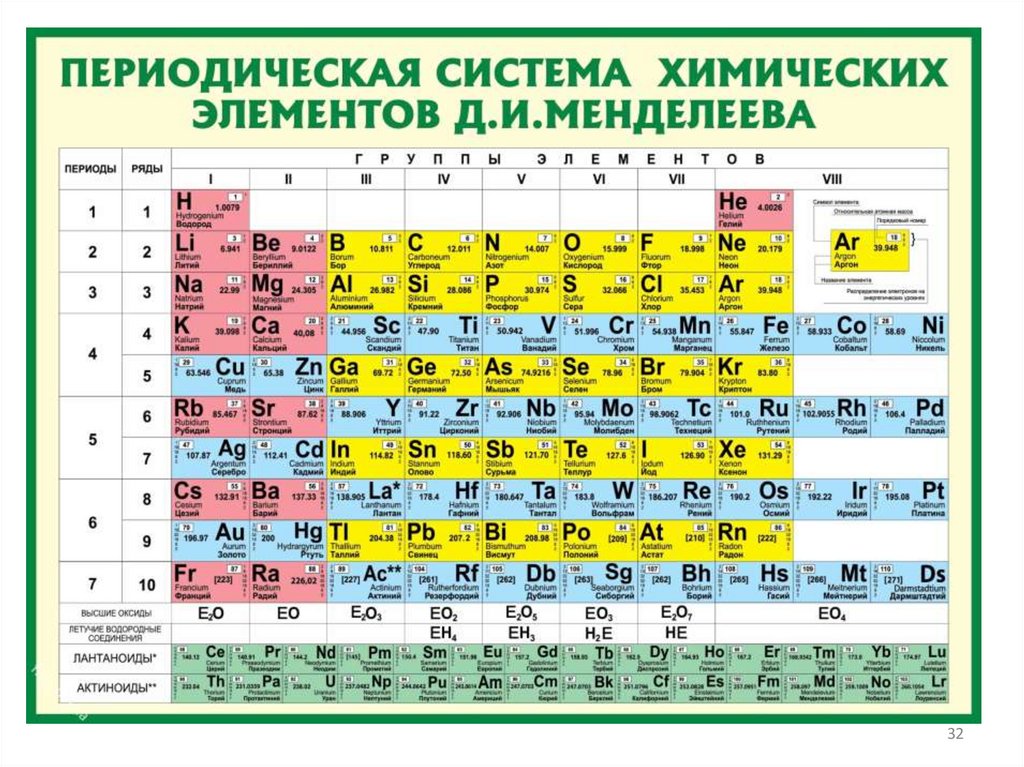
Периодическая таблица химическихэлементов
Открытый Д. И. Менделеевым закон и
построенная на основе закона периодическая
система элементов - это важнейшее
достижение химической науки.
11.
19Р
30,974
ФОСФОР
11
12.
1213.
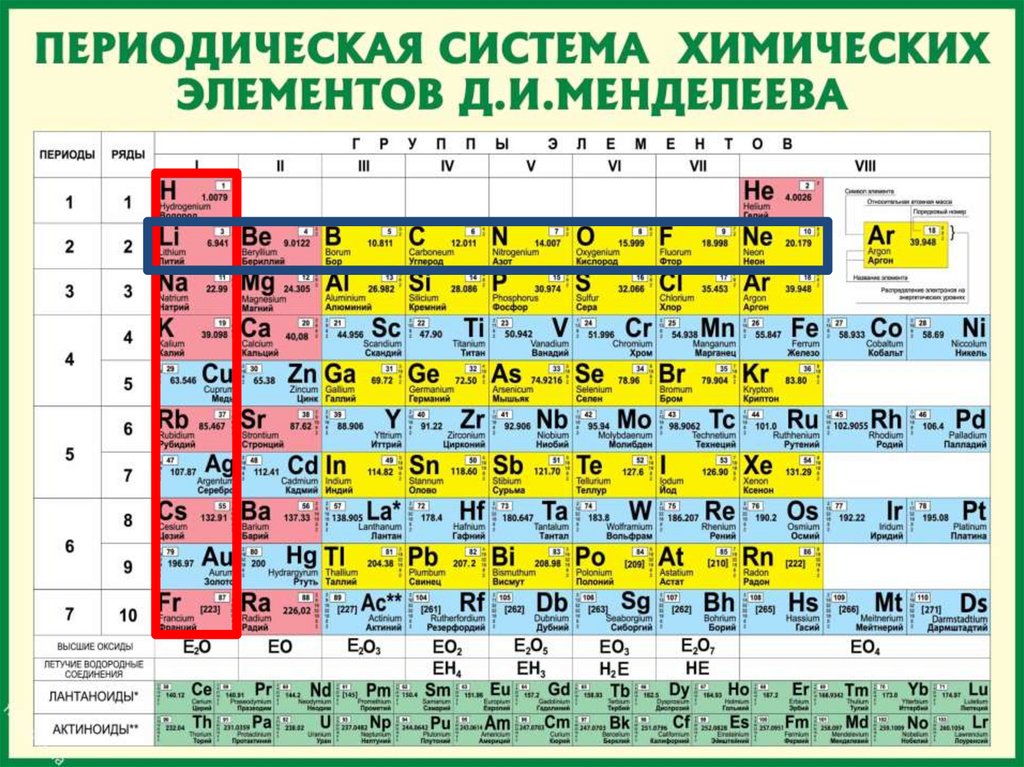
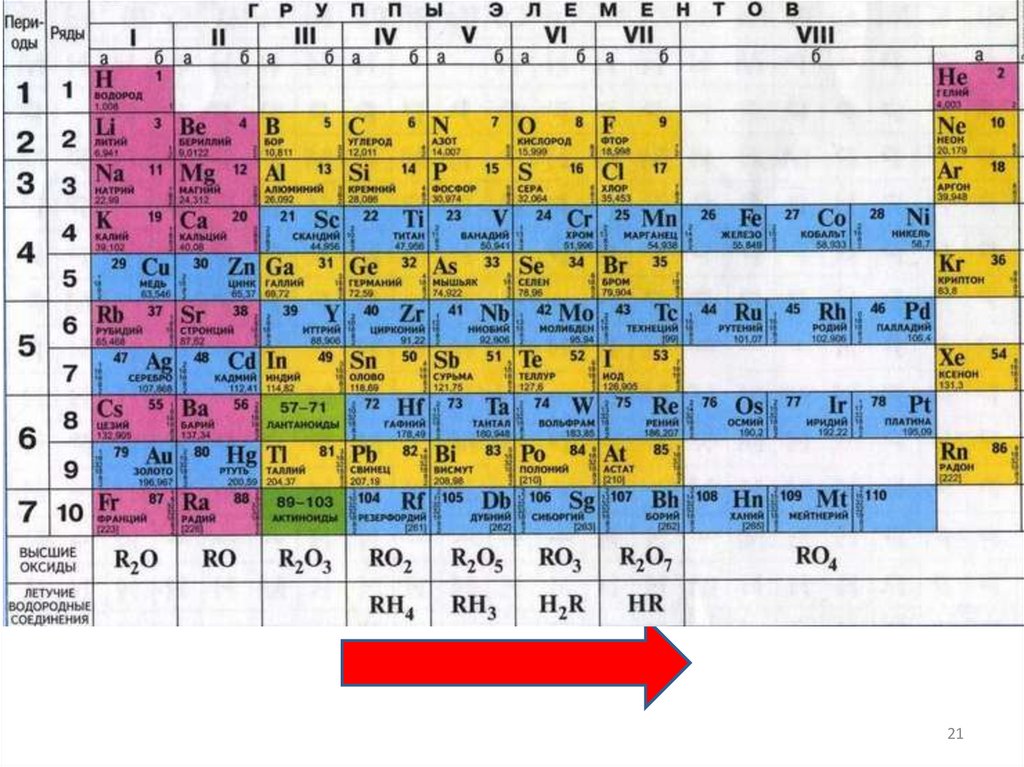
ПериодыПериоды
горизонтальные
ряды
химических элементов, всего 7 периодов.
Периоды делятся на малые (I,II,III) и большие
(IV,V,VI), VII-незаконченный.
13
14.
ПериодыКаждый период (за исключением первого)
начинается типичным металлом (Li, Nа, К,
Rb, Cs, Fr) и заканчивается благородным
газом (Не, Ne, Ar, Kr, Хе, Rn), которому
предшествует типичный неметалл.
14
15.
Группывертикальные столбцы
элементов с одинаковым
числом электронов на
внешнем электронном
уровне, равным номеру
группы.
15
16.
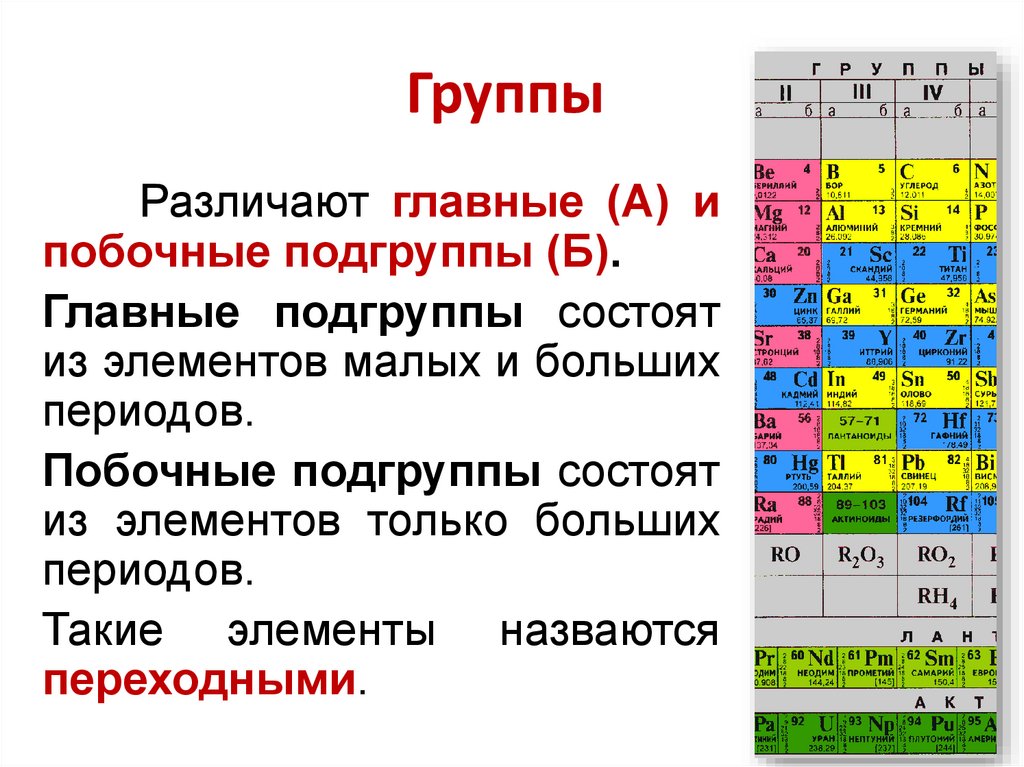
ГруппыРазличают главные (А) и
побочные подгруппы (Б).
Главные подгруппы состоят
из элементов малых и больших
периодов.
Побочные подгруппы состоят
из элементов только больших
периодов.
Такие элементы назваются
переходными.
16
17.
1718.
Периодическая таблицахимических элементов
Запомнить!!!
Номер периода = число энергетических
уровней атома.
Номер группы = число внешних электронов
атома.
(Для элементов главных подгрупп)
18
19.
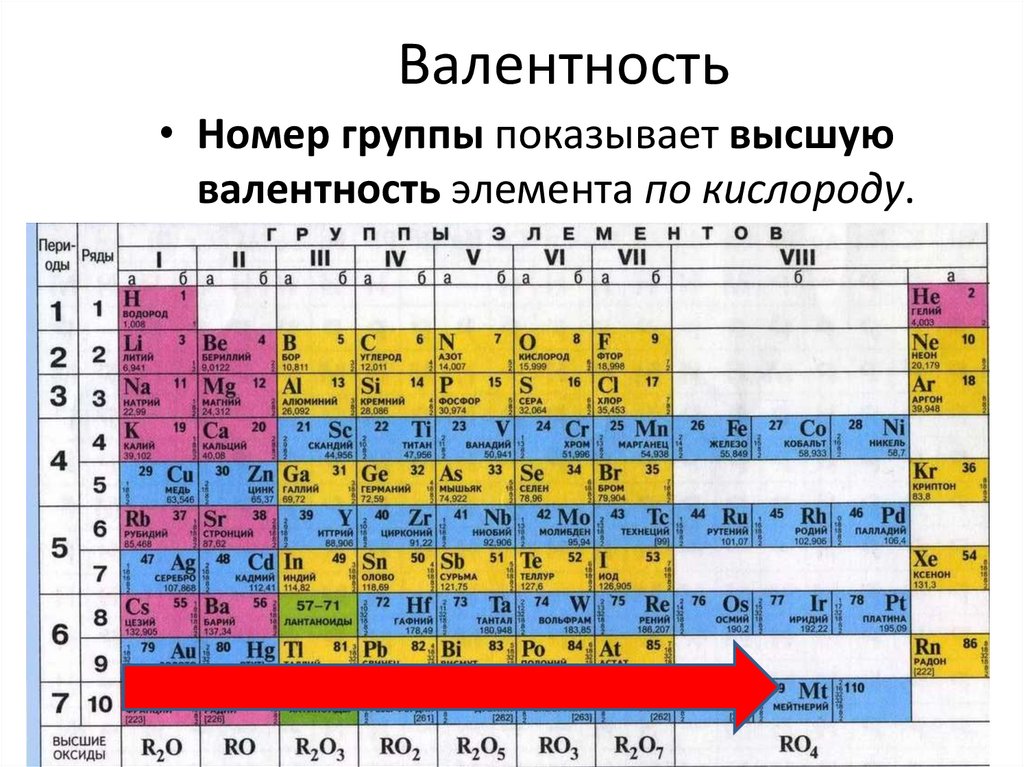
Валентность• Номер группы показывает высшую
валентность элемента по кислороду.
19
20.
Валентность• Элементы IV, V, VI и VII групп образуют
летучие водородные соединения.
• Номер группы показывает валентность
элемента в соединениях с водородом.
8-№группы
20
21.
2122.
Задание:• Назовите в каком периоде и в
какой группе, подгруппе
находятся следующие
химические элементы:
• Натрий, Медь, Углерод, Сера,
Хлор, Хром, Железо, Бром
22
23.
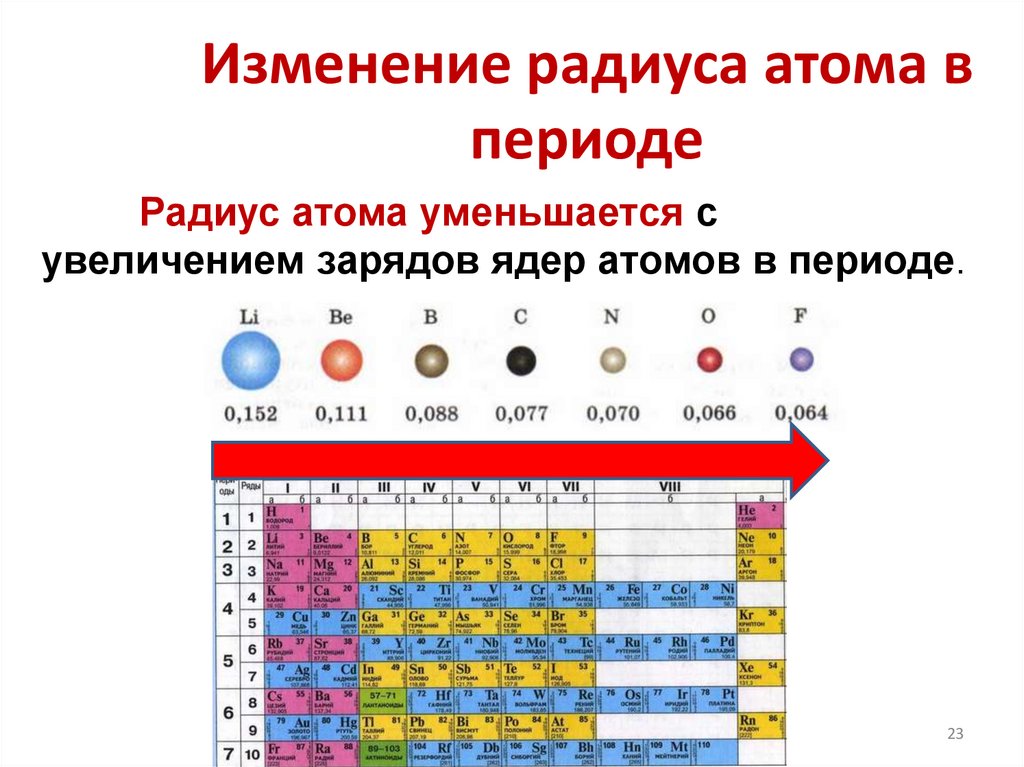
Изменение радиуса атома впериоде
Радиус атома уменьшается с
увеличением зарядов ядер атомов в периоде.
23
24.
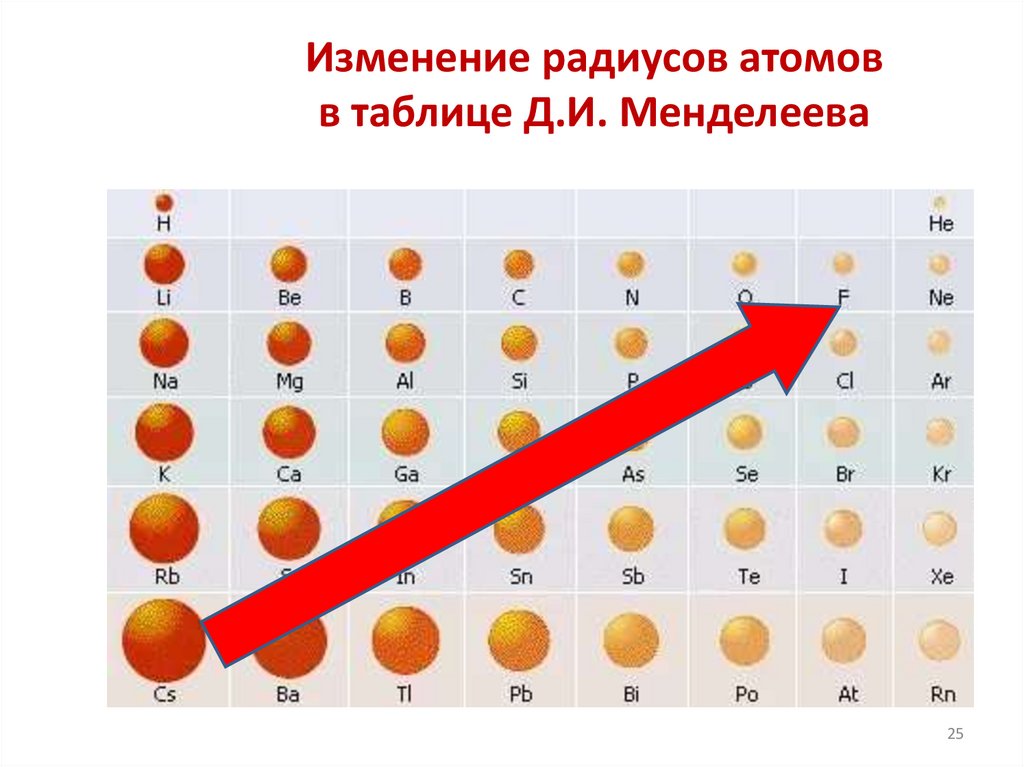
Изменение радиуса атома впериоде
В одной группе с увеличением номера
периода атомные радиусы возрастают.
24
25.
Изменение радиусов атомовв таблице Д.И. Менделеева
25
26.
Задание:Сравните радиусы следующих
химических элементов:
• Литий, натрий, калий
• Кислород, Сера, селен
• Йод, Хлор, фтор
26
27.
2728.
ЭлектроотрицательностьЭлектроотрицательность - это
способность атома притягивать
электронную плотность.
Электроотрицательность в периоде
увеличивается с возрастанием
заряда ядра химического элемента, то
есть слева направо.
28
29.
• Электроотрицательность вгруппе увеличивается с
уменьшением числа
электронных слоев атома
(снизу вверх).
• Самым
электроотрицательным
элементом является фтор (F),
а наименее
электроотрицательным –
франций (Fr).
29
30.
ОТНОСИТЕЛЬНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬАТОМОВ
Н
2,1
Li
Be
В
С
N
О
0,98
1,5
2,0
2,5
3,07
3,5
F
4,0
Na
Mg
Al
Si
P
S
Сl
0,93
1,2
1,6
1,9
2,2
2,6
3,0
К
Ca
Ga
Ge
As
Se
Br
0,91
1,04
1,8
2,0
2,1
2,5
2,8
Rb
Sr
In
Sn
Sb
Те
I
0,89
0,99
1,5
1,7
1,8
2,1
2,6
30
31.
Задание:Сравните ЭО следующих
химических элементов:
• Натрий и кислород
• Углерод и водород
• Кислород и фтор
31
32.
3233.
Окислительно-восстановительныесвойства
Восстановительные свойства атомов способность терять электроны при
образовании химической связи.
Окислительные свойства атомов способность принимать электроны при
образовании химической связи.
33
34.
Окислительно-восстановительныесвойства
В главных подгруппах снизу вверх, в
периодах – слева направо
окислительные свойства простых
веществ элементов возрастают, а
восстановительные свойства,
соответственно, убывают.
34
35.
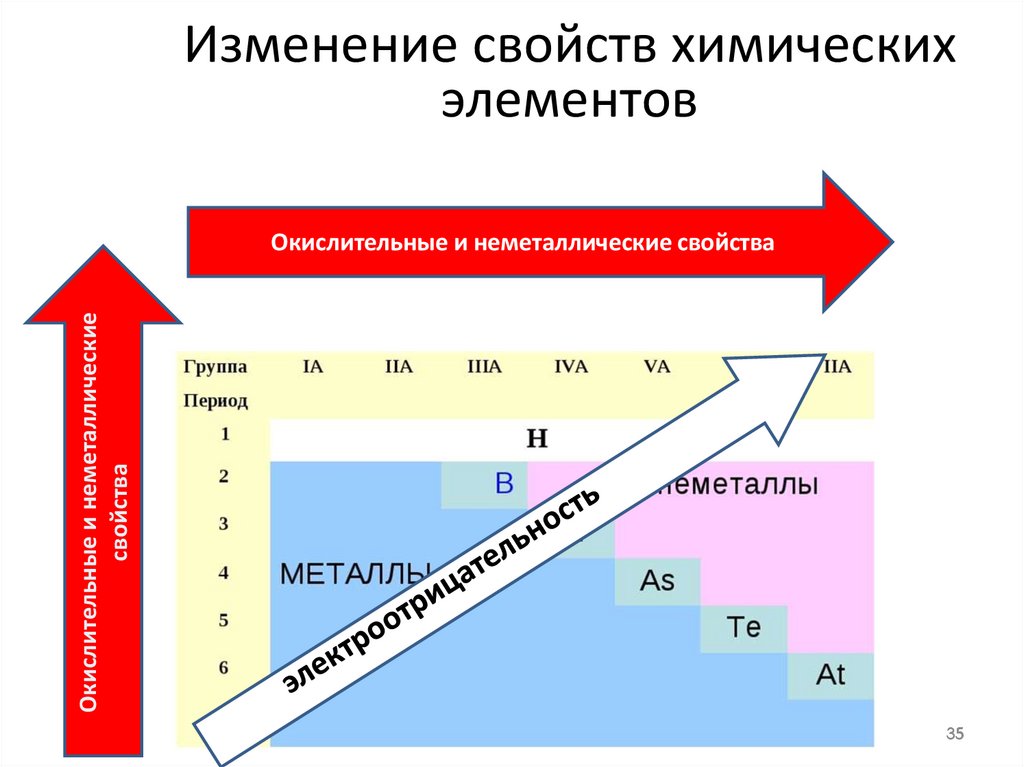
Изменение свойств химическихэлементов
Окислительные и неметаллические
свойства
Окислительные и неметаллические свойства
35
35
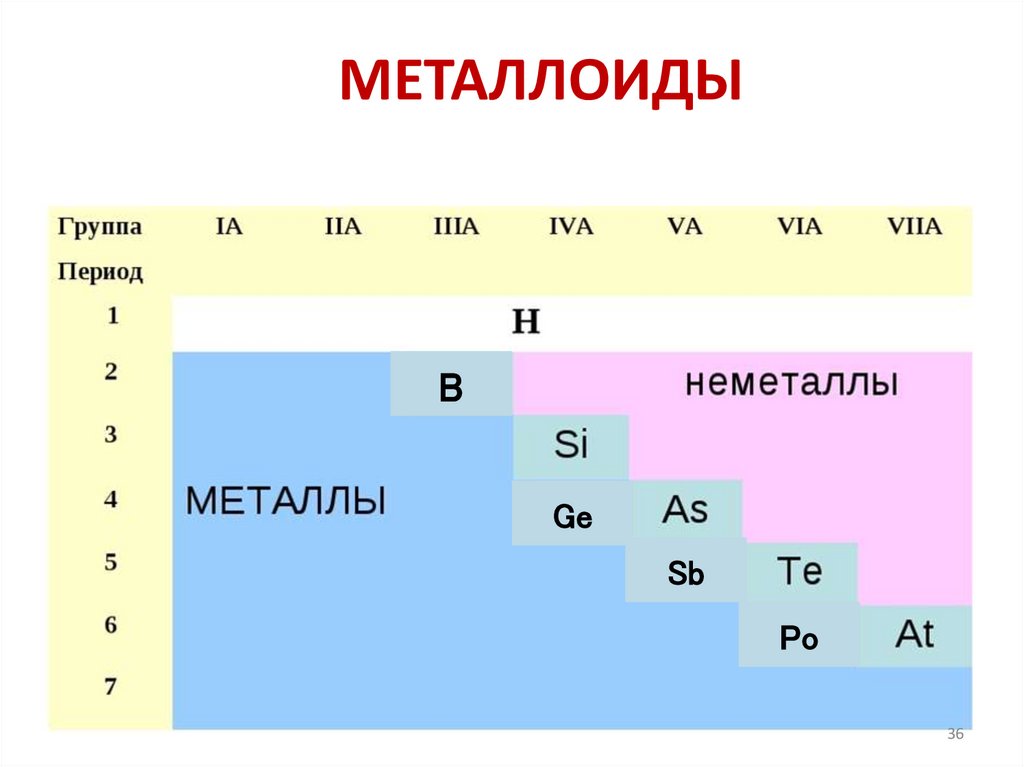
36.
МЕТАЛЛОИДЫB
Ge
Sb
Po
36
37.
МЕТАЛЛОИДЫ• По своим химическим свойствам
полуметаллы являются неметаллами, но по
типу проводимости относятся к
проводникам.
37
38.
Значение Периодического закона и Периодической системыД. И. Менделеева
Периодический закон :
- Основа современной химии;
- Его открытие дало мощнейший толчок в развитии физических и
химических знаний;
- Были разработаны теории строения атома и химической связи.
Благодаря Периодической системы Д. И. Менделеева :
- Сложилось современное понятие о химическом элементе;
- Были уточнены представления о простых веществах и соединениях;
- Появление периодической системы открыло новую, научную эру в
истории химии и ряде смежных наук появилась стройная система, на
основе которой стало возможным обобщать, делать выводы,
предвидеть.
39.
Домашнее задание• Учить записи в тетради.
• О.С. Габриелян, И.Г. Остроумов. Химия.
Учебник для СПО. М., Академия, 2014
стр. 31 - 37





























 chemistry
chemistry








