Similar presentations:
Периодический закон и периодическая система химических элементов Д.И. Менделеева
1. ТЕМА №2: ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. Менделеева
Рассматриваемые вопросы:1. Периодический закон и Периодическая система
химических элементов Д.И. Менделеева.
2. Свойства химических элементов Периодической
системы.
2.
1. Периодический закон и система химическихэлементов Д.И. Менделеева
Периодический закон: Свойства химических элементов, а
также формы и свойства образуемых ими соединений
находятся в периодической зависимости от величины
заряда ядер их атомов.
Элементы располагаются в порядке возрастания заряда ядер
их атомов, но не линейно, а периодами (уровнями).
Электронный уровень имеет конечную емкость.
3.
При последовательном увеличении зарядов атомных ядерпериодически
повторяется
конфигурация
электронных
оболочек и, следовательно, периодически повторяются
химические свойства элементов.
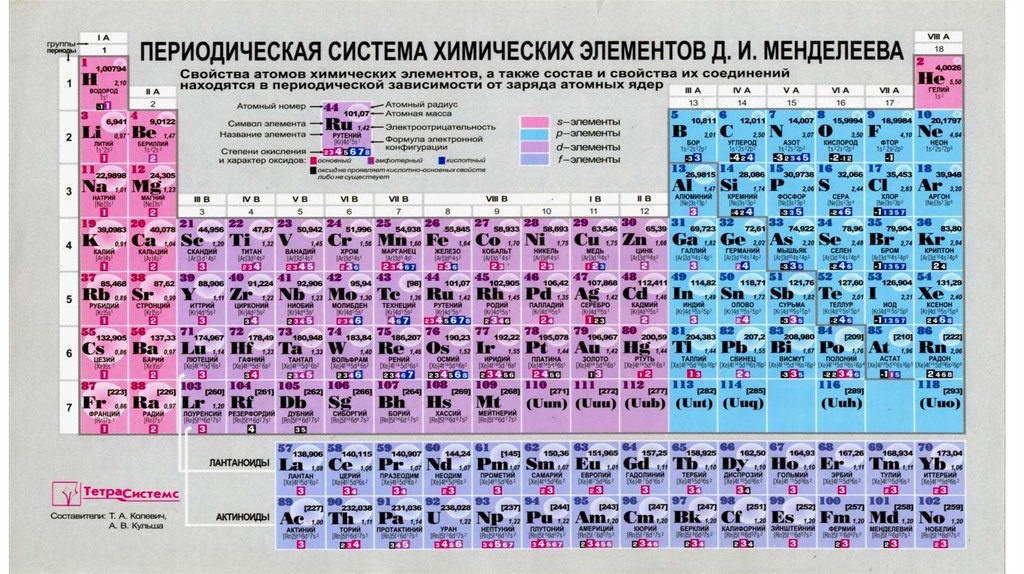
Графическим изображением закона является таблица, которая
называется Периодическая система химических элементов
(ПСЭ) Д.И. Менделеева.
Структура таблицы: 7 периодов; 8 групп (2 группы:
лантаноиды и актиноиды).
4.
5.
Период – горизонтальный ряд элементов, электроннаяконфигурация которых изменяется от ns1 до ns2np6
(кроме 1 периода).
Номер периода совпадает со значением главного квантового
числа (n), а также показывает число энергетических уровней,
на которых расположены электроны, для атомов любого
элемента данного периода.
В периоде с увеличением заряда ядра атомов и числа
электронов на внешнем энергетическом уровне наблюдается
постепенное изменение свойств от металлических к
типично неметаллическим.
6.
В зависимости от того, какой энергетический подуровеньзаполняется электронами последним, различают 4 типа
элементов:
• s-элементы –s-подуровень;
• p-элементы – p-подуровень;
• d-элементы – d-подуровень;
• f-элементы – f – подуровень.
7.
Группа – вертикальный ряд элементов, имеющих сходноеэлектронное строение внешних энергетических подуровней.
Номер группы показывает число валентных электронов, т.е.
число электронов, которые могут участвовать в образовании
химических связей.
Группы делятся на:
-главные подгруппы (А) (s- и p-элементы);
-побочные подгруппы (В) (d- и f-элементы).
8.
2. Свойства химических элементов Периодической системыСвойствами, закономерно изменяющимися по периодам и
группам являются: атомные радиусы, сродство к электрону,
энергия ионизации, электроотрицательность, степень
окисления и др.
l
r l
2
Эффективный радиус – условная величина,
равная половине расстояния между центрами
двух смежных атомов, если представить, что в
кристалле или молекуле атомы имеют форму
шаров и соприкасаются друг с другом.
9.
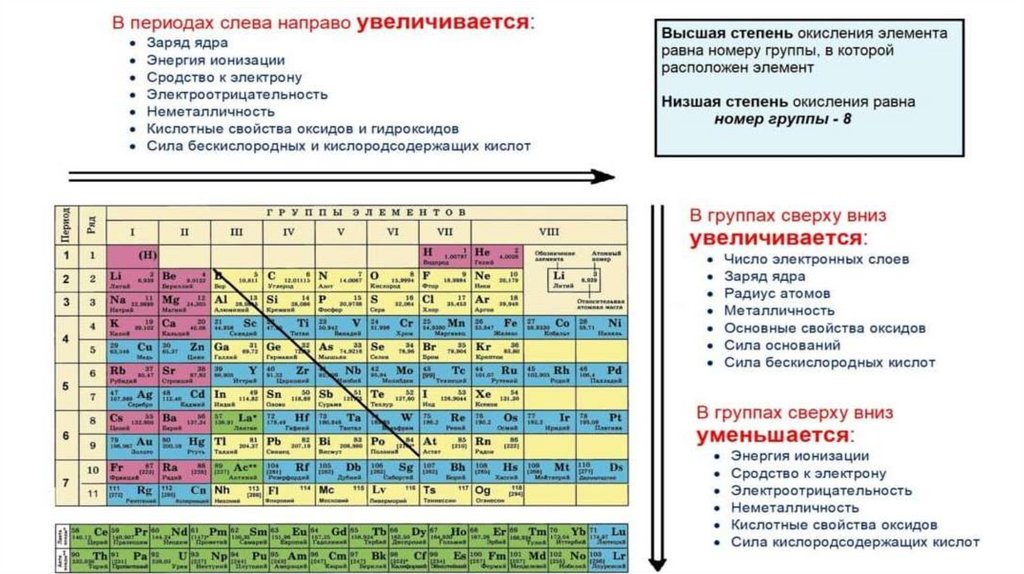
Вгруппах
(сверху
вниз)
атомные
радиусы
увеличиваются, так как возрастает количество энергетических
уровней.
В периодах (слева направо) атомные радиусы
уменьшаются.
Это связано с тем, что постепенно
увеличивается
количество
электронов
(соответственно
увеличивается заряд ядра), а это приводит к увеличению сил
кулоновского притяжения электронов к ядру, то есть
происходит сжатие электронной оболочки.
10.
Окислительная и восстановительная активностьОкислительная
активность
(АО)
определяется
способностью атома присоединять электроны от другого атома
(окислительные свойства или неметаллические).
Cl +1e = Cl
0
Восстановительная
активность
(ВА)
определяется
способностью атома отдавать электроны другому атому
(восстановительные свойства или металлические).
Na
0–
+
1e = Na
11.
Количественной мерой ВА является энергия ионизацииатома.
Количественной мерой ОА является энергия сродства к
электрону.
Энергия ионизации
(Еион) – минимальная энергия,
необходимая для отрыва наиболее слабосвязанного электрона
от невозбужденного атома. В результате чего образуются
положительно заряженные ионы:
Атом + Еион Ион + е+
12.
У элементов одного периода при переходе от щелочногометалла к инертному газу (слева направо) заряд ядра
постепенно возрастает, радиус атома уменьшается, энергия
ионизации
увеличивается,
а
следовательно
восстановительные свойства ослабевают.
По группе (сверху вниз) энергия ионизации уменьшается,
так как радиус растет и соответственно восстановительные
свойства увеличиваются.
13.
Способность атома образовывать отрицательно заряженныеионы характеризуется энергией сродства к электрону (Еср) – это
энергетический эффект присоединения электрона к нейтральному
атому
Атом + е Ион + Еср.
Сродство к электрону атомов металлов близко к нулю или
отрицательно, т.е. для большинства металлов присоединение
электронов энергетически невыгодно, для неметаллов оно всегда
положительно.
По
периоду
(слева
направо)
Еср
увеличивается,
окислительные свойства усиливаются. По группе (сверху вниз)
Еср уменьшается, окислительные свойства ослабевают.
14.
Электроотрицательность (ЭО или ) условная величина,характеризующая способность атома в химическом соединении
притягивать к себе электроны. Для практической оценки этой
способности атома введена условная относительная шкала ЭО.
Чем более типичным металлом является элемент, тем
ниже его ЭО.
Чем более типичным неметаллом является элемент, тем
больше его ЭО.
Наиболее электроотрицательным элементом является фтор, а
наименее электроотрицательным – франций.
По периоду с ростом порядкового номера элемента ЭО
возрастает, а по группе, как правило, ЭО убывает.













 chemistry
chemistry








