Similar presentations:
Периодический закон и Периодическая система химических элементов Д.И. Менделеева
1. Периодический закон и Периодическая система химических элементов Д.И.Менделеева
9 КЛАСС2. Предпосылки открытия Периодического закона Д.И.Менделеева
Работы ученых-предшественников Д.И.МенделееваКлассификация Берцелиуса
Триады Деберейнера (1816 г.)
Спираль Шанкуртуа (1862 г.)
Октавы Ньюлендсена (1865 г.)
Таблица Мейера (1864 г.)
3. Классификация Берцелиуса
?Химические
элементы
металлы
неметаллы
Вывод: классификация Берцелиуса несовершенна.
4. Классификация Деберейнера
Закон триад1817 год
Обнаруживает интересную математическую закономерность: масса
атома среднего элемента в каждой триаде равна
среднеарифметической величине из масс атомов крайних.
5. Октавы Ньюлендса
Опубликовал таблицу элементов, назвав её1865 год
«законом октав». Заслуга Ньюлендса: он первый
подметил повторяемость свойств элементов на
восьмом элементе, привлёк внимание к этому
числу. Но: произвольно переставлял элементы и
даже помещал по 2 на одно место. Не учел
возможности открытия новых элементов.
6. Открытие Д.И.Менделеевым Периодического закона
Д.И.Менделеев:Взял за основу атомные массы элементов,
расположил их в порядке возрастания атомных масс
Приписал порядковый номер каждому элементу
Увидел, что свойства элементов периодически повторяются
Известно было 63 элемента, у 20 исправил атомные массы, 29-предсказал
7. Работая над созданием ПСХЭ, Д.И.Менделеев сделал следующее:
1) сопоставил между собой и несходныеэлементы, сравнивал естественные группы
и располагал элементы в порядке
возрастания их атомных масс. Понял, что
свойства меняются не монотонно, а
периодически.
8. Работая над созданием ПСХЭ, Д.И.Менделеев сделал следующее:
2) Атомные веса некоторых элементов не были точноопределены. Изменил атомный вес у 20 химических элементов.
Считалось, что Ar (Be)= 13,5
Li (7)
металл
Be (?)
B (11)
амфотерн.
Неметалл
Ar (Be) = (7+11) / 2 = 9
9. Работая над созданием ПСХЭ, Д.И.Менделеев сделал следующее:
3) переставил местами Ar и K, Co и Ni, Te и I.Причем, сделал это вопреки возрастанию
атомного веса, т.е. противореча самому
себе. Учитывал вертикальное сходство
элементов в свойствах.
10. Работая над созданием ПСХЭ, Д.И.Менделеев сделал следующее:
4) предсказывает существование 12неизвестных в то время науке элементов, а
для трех из них дает подробное описание их
свойств, а также свойств их соединений и
даже тех способов, при помощи которых
они впоследствии могут быть получены.
11. Укрепители периодического закона
открывает галлий, предсказанный Д.И. Менделеевым пятью годами
раньше как элемент под названием
«экаалюминий»
Лекок де Буабодранфранцузский ученый
1875 год
(«эка» — следующий за)
12. Укрепители периодического закона
открывает скандий «экабор» по Д. И. Менделееву«Нет никакого сомнения, что в скандии
открыт экабор. Так подтверждаются самым
наглядным образом мысли русского химика,
позволившие не только предвидеть
Ларс Нильсонсуществование названного простого тела, но
шведский ученый и наперёд указать его важнейшие свойства»
/Л.Нильсон/
1879 год
13. Укрепители периодического закона
1886г. немецкий ученый
открывает германий —
«экасилиций» по Д. И.
Менделееву
Клеменс Винклернемецкий ученый
«Вряд ли может существовать более яркое
доказательство справедливости учения о
периодичности элементов, чем открытие до сих пор
гипотетического экасилиция; оно составляет, конечно,
более чем простое подтверждение смелой теории, оно знаменует собою выдающееся расширение
химического поля зрения, гигантский шаг в области
познания» /К. Винклер/
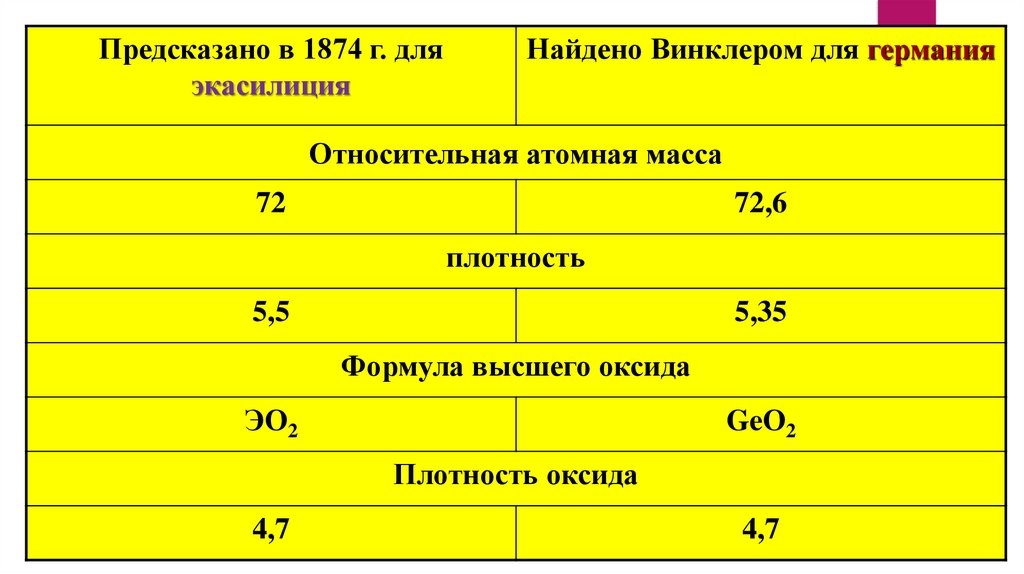
14.
Предсказано в 1874 г. дляэкасилиция
Найдено Винклером для германия
Относительная атомная масса
72
72,6
плотность
5,5
5,35
Формула высшего оксида
ЭО2
GeО2
Плотность оксида
4,7
4,7
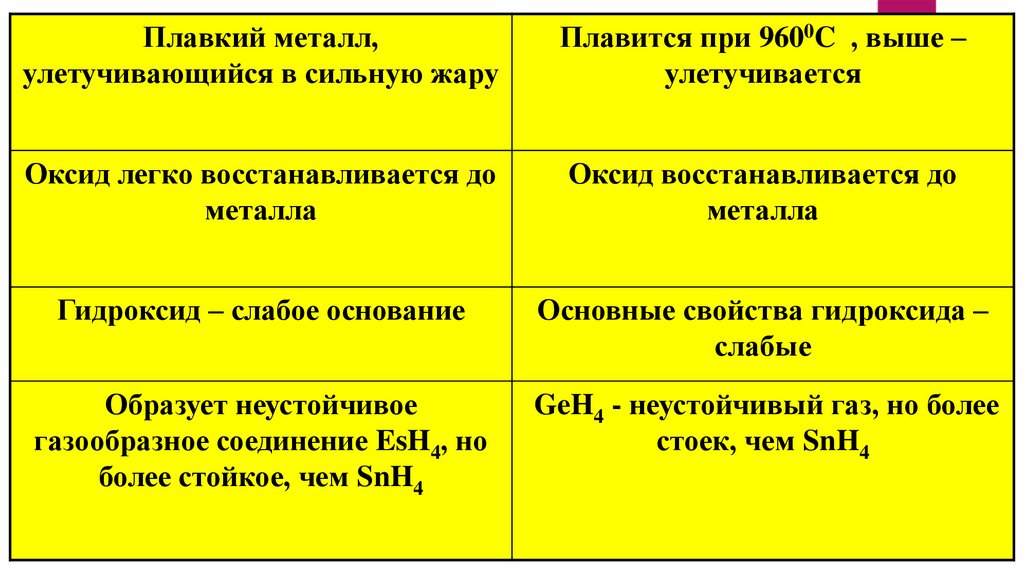
15.
Плавкий металл,улетучивающийся в сильную жару
Плавится при 9600C , выше –
улетучивается
Оксид легко восстанавливается до
металла
Оксид восстанавливается до
металла
Гидроксид – слабое основание
Основные свойства гидроксида –
слабые
Образует неустойчивое
газообразное соединение EsH4, но
более стойкое, чем SnH4
GeH4 - неустойчивый газ, но более
стоек, чем SnH4
16. Формулировки Периодического закона
Свойства химических элементов и образованных ими веществнаходятся в периодической зависимости от относительных
атомных масс элементов
Свойства химических элементов и образованных ими веществ
находятся в периодической зависимости от зарядов их атомных
ядер
Свойства химических элементов и образованных ими веществ
находятся в периодической зависимости от строения внешних
энергетических уровней атомов элементов
17. Значение Периодического закона и Периодической системы химических элементов Д. И. Менделеева
Дали начало современной химии, сделав ее единой целостнойнаукой. Химия перестала быть описательной наукой.
Подтвердили наиболее общие законы развития природы.
Лежат в основе решения современных задач химической науки и
промышленности.
С учетом Периодической системы химических элементов ведутся
работы по получению новых полимерных и полупроводниковых
материалов, жаропрочных сплавов, веществ с заданными
свойствами, по использованию ядерной энергии, исследуются
недра Земли, Вселенная...
18. Значение Периодического закона Д.И.Менделеева
Периодический закон – один из основных законов природы, основасовременной химии
ПЗ и ПСХЭ позволили предсказать существование новых еще не
открытых элементов
ПЗ помогает ученым синтезировать новые химические элементы
ПЗ подтвердил общие законы природы
Д.И.Менделеев: «Периодическому закону будущее не грозит
разрушением, а только надстройка и развитие обещаются»
19. Современное содержание Периодического закона
Свойства химических элементов и образованных ими веществнаходятся в периодической зависимости от периодичности в изменении
строения внешних энергетических слоев атомов химических элементов
Li +3 ) )
Na +11 ) ) )
K +19) ) ) )
2 1
2 8 1
2 8 8 1
Физический смысл ПЗ
Число электронов на последнем уровне периодически повторяется,
поэтому периодически повторяются и свойства элементов и их
соединений
20.
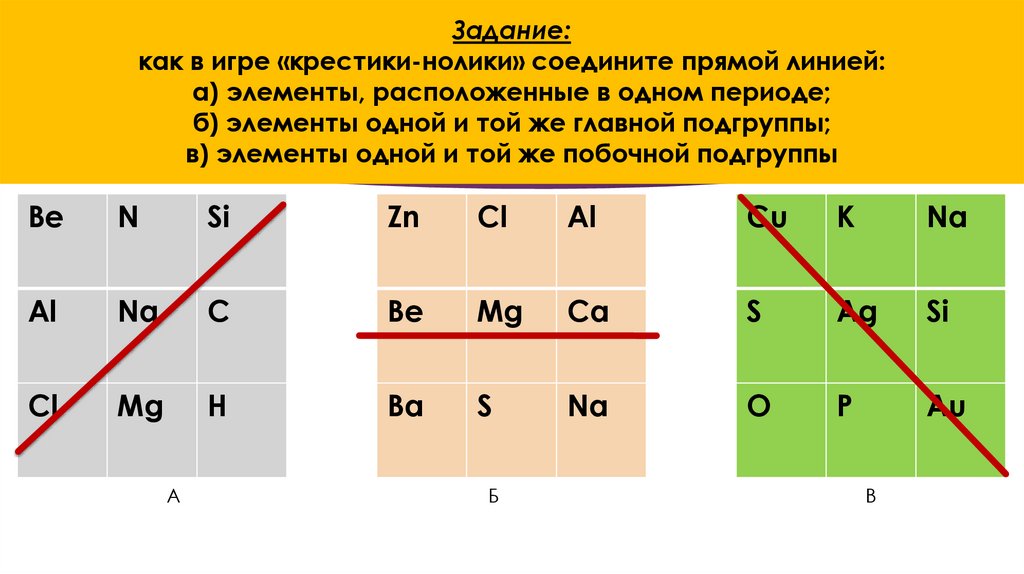
21. Проверим свои знания
22. Задание: как в игре «крестики-нолики» соедините прямой линией: а) элементы, расположенные в одном периоде; б) элементы одной и
той же главной подгруппы;в) элементы одной и той же побочной подгруппы
Be
N
Si
Zn
Cl
Al
Cu
K
Na
Al
Na
C
Be
Mg
Ca
S
Ag
Si
Cl
Mg
H
Ba
S
Na
O
P
Au
А
Б
В
23.
Проверим свои знанияЗадание 1: Составьте схемы строения электронных
оболочек следующих атомов:
Вариант 1: натрия
Вариант 2: лития
Это металлы или неметаллы? В чем особенности их
строения? В чем их сходство? Чем они отличаются?
Какой из металлов в каждой группе наиболее активен?
Почему?
24. Подведем итоги
В периоде с возрастанием заряда ядра атома:1) R атома уменьшается;
2) увеличивается число электронов на внешнем уровне (от 1 до 8);
3) число энергетических уровней постоянно;
4) увеличивается электроотрицательность;
5) металлические свойства ослабляются, а неметаллические усиливаются;
6) основный характер соединений химических элементов ослабевает, а
кислотный – усиливается.
25. Подведем итоги
В группе с возрастанием заряда ядра атома:1) постоянно число электронов на внешнем уровне;
2) число энергетических уровней увеличивается;
3) R атома увеличивается
4) уменьшается электроотрицательность
5)металлические свойства (в главной подгруппе) усиливаются,
неметаллические ослабляются;
6) основный характер соединений химических элементов усиливается,
а кислотный – ослабевает.
26. ДОМА
Записи в тетрадяхРасписать строение атома №
15






















 chemistry
chemistry








