Similar presentations:
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
1. Урок «Периодический закон и периодическая система химических элементов Д.И. Менделеева» (8 класс)
2. История открытия периодического закона
1829 год – Иоганн Вольфганг Дёберейнер (законтриад);
1843 год – Леопольд Гмелин (таблица химически
сходных элементов, расставленных по группам в
определенном порядке);
1863 год – Александр Эмиль Бегуйе де Шанкуртуа
(винтовой график элементов – «земная спираль»);
1864 год – Джон Александр Рейна Ньюлендс (закон
октав);
1864 год - Юлиус Лотар Мейер (таблица, в которой
44 элемента были расставлены в шести столбцах в
соответствии с их валентностью по водороду).
3. 1869 год – Дмитрий Иванович Менделеев сформулировал периодический закон:
Свойства элементов,а также формы и свойства их соединений
находятся в периодической зависимости
от величины заряда ядра атома
(порядкового номера) элемента.
4. Физический смысл периодического закона
периодическое изменениесвойств элементов
объясняется периодическим повторением
числа электронов
на внешнем энергетическом уровне и
электронных структур атомов
5. Периоды – горизонтальные ряды элементов, расположенные в порядке увеличения атомных масс элементов
III
III
IV
V
VI
VII
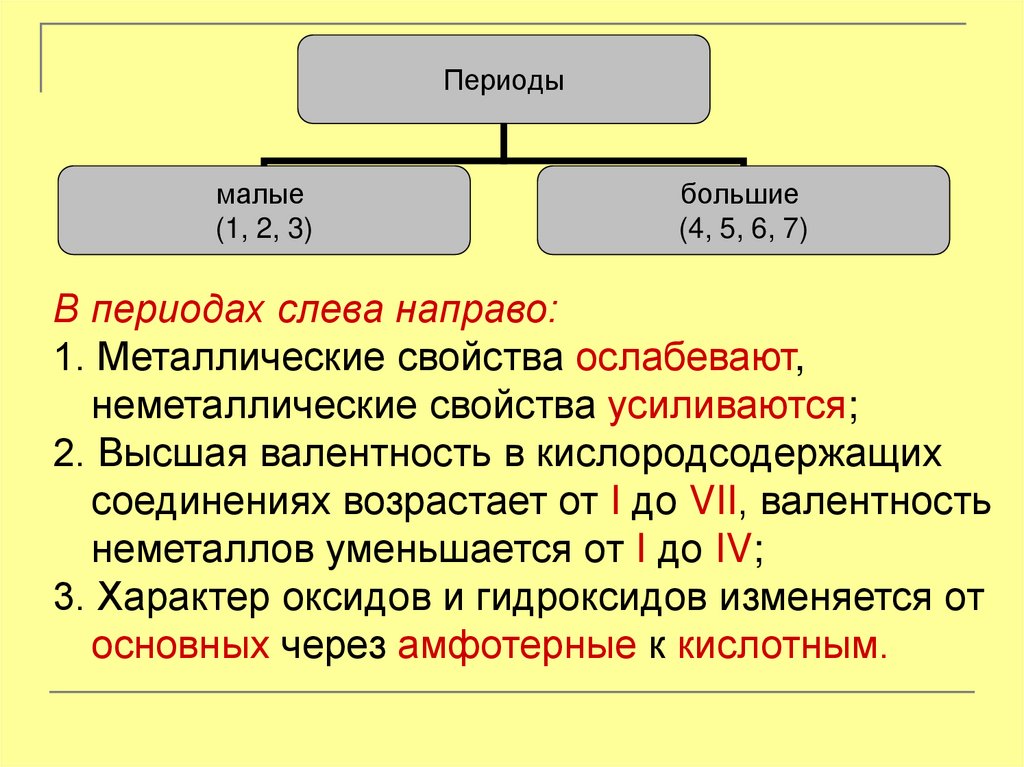
6.
Периодымалые
(1, 2, 3)
большие
(4, 5, 6, 7)
В периодах слева направо:
1. Металлические свойства ослабевают,
неметаллические свойства усиливаются;
2. Высшая валентность в кислородсодержащих
соединениях возрастает от I до VII, валентность
неметаллов уменьшается от I до IV;
3. Характер оксидов и гидроксидов изменяется от
основных через амфотерные к кислотным.
7. Группы – вертикальные ряды элементов, расположенные в порядке увеличения атомных масс
периодГРУППЫ
1
I
II
III
IV
V
VI
VII
2
3
4
5
6
7
8
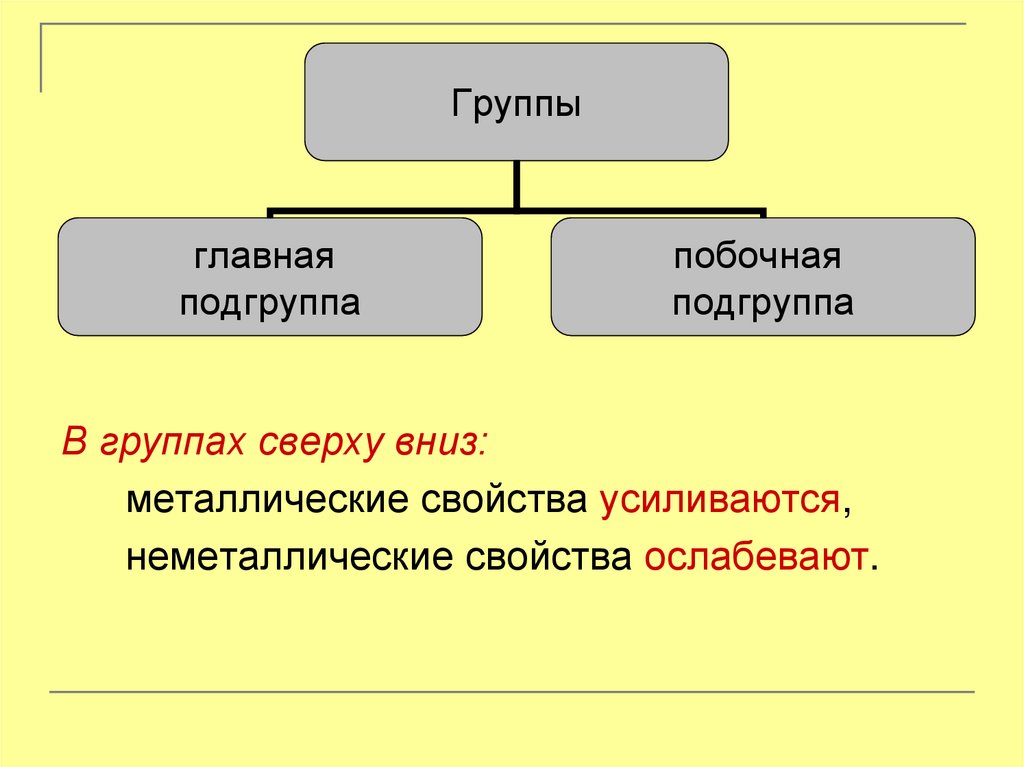
8.
Группыглавная
подгруппа
побочная
подгруппа
В группах сверху вниз:
металлические свойства усиливаются,
неметаллические свойства ослабевают.
9.
Признакигруппы
общие формы
кислородных
соединений
одинаковая высшая
валентность элементов
по кислороду
10. Значение периодического закона
1. Развитие периодического законапозволили выявить ряд новых
характеристик химических элементов и
периодичность их изменения;
2. На основе периодического закона удалось
предсказать и открыть урановые
элементы;
3. Периодический закон и периодическая
система имели большое значение для
открытия радиоактивных изотопов.
11. План характеристики элемента по положению в периодической системе
1. Нахождение в таблице (период, ряд, группа,подгруппа, порядковый номер, атомная масса).
2. Строение атома.
3. Характер элемента (металл, неметалл или
переходный).
4. Летучее водородное соединение.
5. Высший оксид, гидроксид, характер соединений.
6. Металлические или неметаллические свойства в
сравнении с соседями.
12. Пример характеристики элемента азота на основании его положения в периодической системе
1. 2 период (малый), 2 ряд (четный), группа V, подгруппаглавная, порядковый номер 7, относительная атомная
масса 14.
2. Заряд ядра +7 N+7)2)5
Электронная формула 1s22s22p3.
3. Неметалл.
4. NH3 – аммиак.
5. N2O5, HNO3 – азотная кислота, кислотный.
6. C < N < O
V
Р
13.
Генетическая связь — это связьмежду веществами разных классов,
основанная на их
взаимопревращениях и отражающая
единство их происхождения.
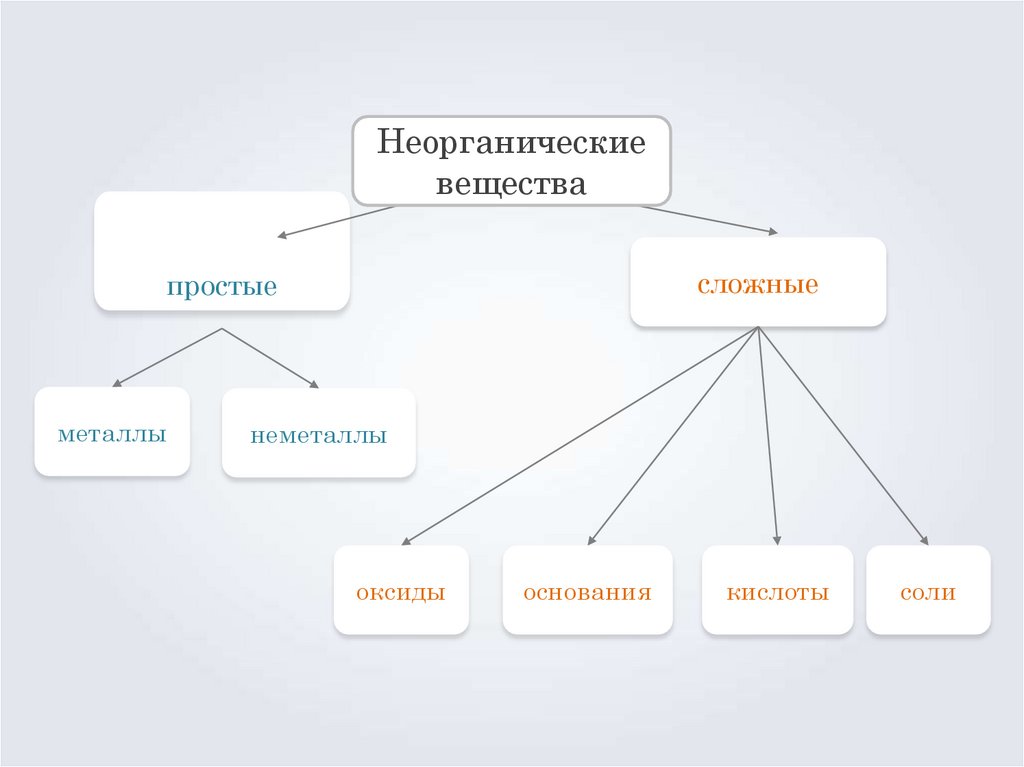
14. Неорганические вещества
сложныепростые
металлы
неметаллы
оксиды
основания
кислоты
соли
15. Генетические ряды
1. Генетический ряд металлов.2. Генетический ряд неметаллов.
16. Генетический ряд металлов отражает взаимосвязь веществ разных классов, в основу которой положен один и тот же металл.
17.
18. Генетические ряды металлов
1. Генетический ряд, в основу которого положенметалл, образующий щёлочь.
металл → основный оксид → щёлочь → соль
Na → Na2O → NaOH → Na2SO4
19. Генетические ряды металлов
Натрий, окисляясь, преобразуется в оксид натрия.Na → Na2O
Оксид натрия при взаимодействии с водой превращается
в щёлочь — гидроксид натрия.
Na2O → NaOH
Щёлочь, взаимодействуя с серяной кислотой, преобразуется в
соль сульфат натрия.
NaOH → Na2SO4
20. Генетические ряды металлов
2. Генетический ряд, в основу которого положенметалл, образующий нерастворимое основание.
металл → основный оксид → соль → основание
→
→ основный оксид → металл
Mg → MgO → MgBr2 → Mg(OH)2 → MgO → Mg
21. Генетические ряды металлов
Магний, взаимодействуя с кислородом, преобразуется в оксид магния.Mg → MgO
Оксид магния, взаимодействуя с бромоводородной кислотой,
преобразуется в соль бромид магния.
MgO → MgBr2
Бромид магния, взаимодействуя со щелочью, преобразуется в
гидроксид
магния.
MgBr2 → Mg(OH)2
Гидроксид магния, разлагаясь, выделяет оксид магния.
Mg(OH)2 → MgO
Оксид магния при прокаливании выделяет металл магний.
MgO → Mg
22.
Генетический ряднеметаллов отражает
взаимосвязь веществ
разных классов, в основу
которой положен один и тот
же неметалл.
23. Генетические ряды неметаллов
1. Генетический ряд неметаллов, в основу которогоположена растворимая кислота.
неметалл → кислотный оксид → кислота → соль
S → SO3 → H2SO4 → ZnSO4
24. Генетические ряды неметаллов
Сера, взаимодействуя с кислородом, превращаетсяв оксид серы (VI).
S → SO3
Оксид серы (VI), соединяясь с водой, превращается
в серную кислоту.
SO3 → H2SO4
Серная кислота, взаимодействуя с цинком, превращается
в соль – сульфат цинка.
H2SO4 → ZnSO4
25. Генетические ряды неметаллов
2. Генетический ряд неметаллов, в основу которогоположена нерастворимая кислота.
неметалл → кислотный оксид → соль →
→ кислота → кислотный оксид → неметалл
Si → SiO2 → K2SiO3 → H2SiO3 → SiO2 → Si
26. Генетические ряды неметаллов
Кремний, взаимодействуя с кислородом, преобразуется воксид кремния.
Si → SiO2
Оксид кремния при сплавлении с оксидом калия преобразуется
в соль – силикат калия.
SiO2 → K2SiO3
Силикат калия, растворяясь в воде, преобразуется в
кремниевую кислоту.
K2SiO3 → H2SiO3
Кремниевая кислота разлагается, образуя оксид кремния.
H2SiO3 → SiO2
Оксид кремния, разлагаясь, выделяет кремний.
SiO2 → Si
27.
Все классы неорганических соединенийвзаимосвязаны между собой рядом химических
превращений, что отражает их общее
происхождение, т.е. генетическую связь.
























 chemistry
chemistry








