Similar presentations:
Определение биоэквивалентности ЛП
1. Определение биоэквивалентности ЛП
Выполнила:ординатор группы ФО-3301
Воронович Алина
2. Дженерики на рынке ЛП
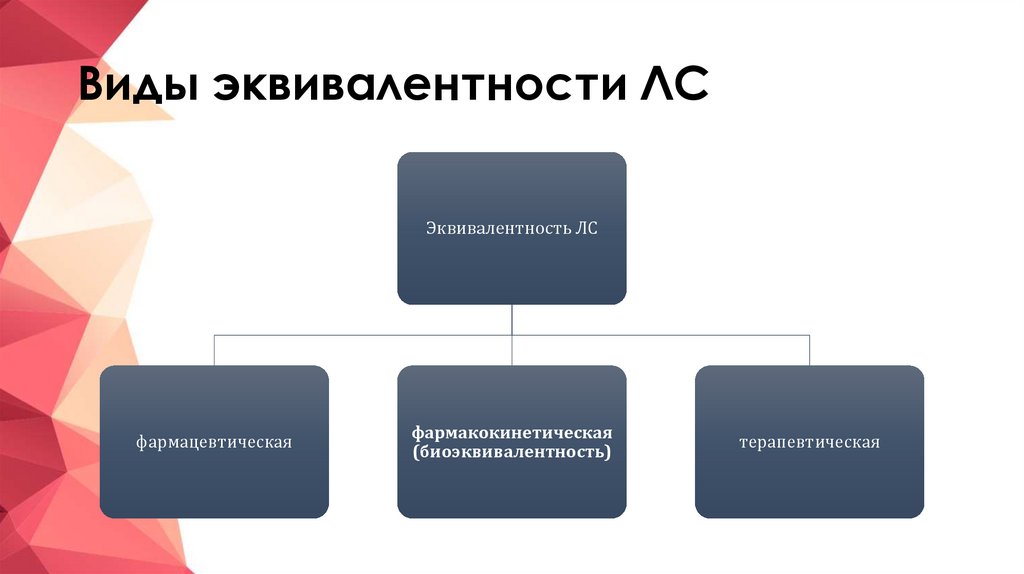
3. Виды эквивалентности ЛС
Эквивалентность ЛСфармацевтическая
фармакокинетическая
(биоэквивалентность)
терапевтическая
4. Биоэквивалентность лекарственных препаратов
- достижение сопоставимых показателей скорости всасывания, степени поступления кместу действия и скорости выведения одного или нескольких обладающих
фармакологической активностью действующих веществ при применении
лекарственных препаратов для медицинского применения, имеющих одно
международное непатентованное (или химическое, или группировочное)
наименование, в эквивалентных дозировках и при одинаковом способе введения;
(Федеральный закон от 12.04.2010 N 61-ФЗ
«Об обращении лекарственных средств» (ред. от 11.06.2021) )
5. Исследования биоэквивалентности
In-vivoоценка концентрации, скорости действия,
периода полувыведения (всего 12 показателей)
препарата после его приема здоровыми
добровольцами. Если все показатели
сопоставимы, то препараты считают
биоэквивалентными. Недостаток данного
метода заключается в отсутствии регистрации
клинического эффекта (невозможно оценить,
насколько препарат эффективен против
головной боли, если его принимает здоровый
человек).
In-vitro
Например, антибактериальную активность
вагинальных суппозиториев можно определить,
поместив их на питательную среду в чашку
Петри, пластинки с лунками (оценивают диаметр
зоны задержки роста микроорганизмов). Если
показатели для сравниваемых препаратов
совпадают, их можно считать эквивалентными
по антибактериальной активности. Некоторые
лекарственные средства (3-, 4-компонентные)
сопоставить в лабораторных условиях
невозможно; необходимы испытания in vivo.
6. Исследование биоэквивалентности лекарственного препарата
- вид клинического исследования лекарственного препарата, проведение которогоосуществляется для определения скорости всасывания и выведения одного или
нескольких обладающих фармакологической активностью действующих веществ,
количества лекарственного препарата, достигающего системного кровотока, и
результаты которого позволяют сделать вывод о биоэквивалентности
воспроизведенного лекарственного препарата в определенных лекарственной форме
и дозировке, соответствующих форме и дозировке референтного лекарственного
препарата;
(Федеральный закон от 12.04.2010 N 61-ФЗ
«Об обращении лекарственных средств» (ред. от 11.06.2021) )
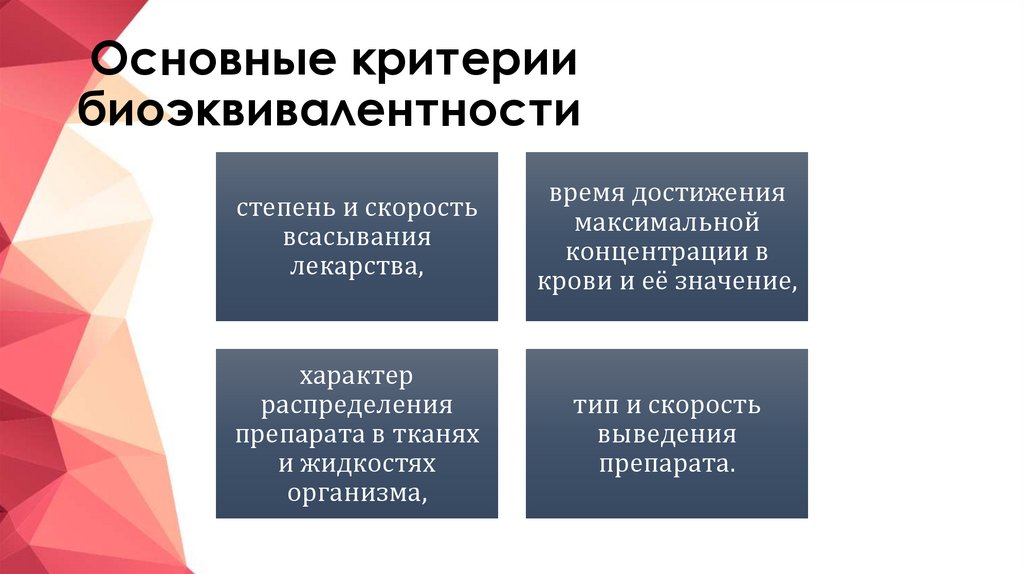
7. Основные критерии биоэквивалентности
степень и скоростьвсасывания
лекарства,
время достижения
максимальной
концентрации в
крови и её значение,
характер
распределения
препарата в тканях
и жидкостях
организма,
тип и скорость
выведения
препарата.
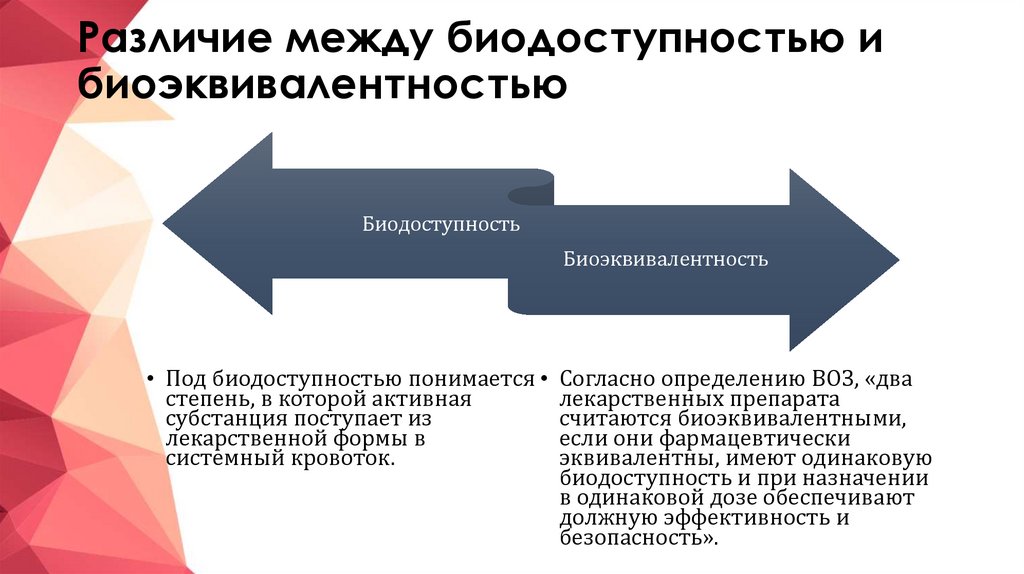
8. Различие между биодоступностью и биоэквивалентностью
БиодоступностьБиоэквивалентность
• Под биодоступностью понимается
степень, в которой активная
субстанция поступает из
лекарственной формы в
системный кровоток.
Согласно определению ВОЗ, «два
лекарственных препарата
считаются биоэквивалентными,
если они фармацевтически
эквивалентны, имеют одинаковую
биодоступность и при назначении
в одинаковой дозе обеспечивают
должную эффективность и
безопасность».
9. Общие сведения о КИ БЭ
• Объект исследований• Объектами исследований являются воспроизведенные дозированные ЛС,
пpедназначенные для внесосудистого (пpием внутpь, накожная, аппликация,
ректальное введение и дp.), но не паpентеpального введения, пpи условии, что
их действие опосpедовано появлением ЛВ в системном кpовотоке. Оценка
биоэквивалентности проводится для всех лекарственных форм,
обеспечивающих немедленное или постепенное высвобождение ЛВ.
• В качестве пpепаpата сpавнения следует использовать соответствующее
оpигинальное ЛС, если оно заpегистpиpовано в РФ, или его аналог,
биоэквивалентность которого оpигинальному ЛС установлена ранее и
который успешно применяется в медицинских учреждениях РФ. Необходимым
условием приемлемости результатов оценки биоэквивалентности
лекарственного средства, зарегистрированного в стране-производителе,
является использование в качестве препарата сравнения оригинального ЛС.
• Содержание ЛВ в исследуемом ЛС и препарате сравнения не должно
отличаться более чем на 5%.
10. Общие сведения о КИ БЭ
• Испытуемые• Оценка биоэквивалентности всех ЛС за иcключением ряда психотропных,
противоопухолевых и средств, применяемых при ВИЧ-инфекциях, пpоводится на
здоpовых добровольцах.
• В качестве здоровых добровольцев могут привлекаться лица обоего пола в возрасте
от 18 до 45 лет, отвечающие следующим критериям:
• - верифицированный диагноз: «здоров» по данным стандартных клинических,
лабораторных и инструментальных методов обследования;
• - масса тела не выходит за пределы ±15% по весо-ростовому индексу Кетле;
• - для женщин - отрицательный тест на беременность и согласие придерживаться
адекватных методов контрацепции.
• Участие здоровых испытуемых и больных в оценке биоэквивалентности
лекарственных средств является добровольным. Доброволец имеет право отказаться
от участия в проводимых исследованиях на любой его стадии.
• Добровольцы до начала исследования должны подписать информированное согласие
и пройти обследование
11. Общие сведения об исследовании БЭ
• Pегламент фармакокинетического исследования• Исследования ЛС осуществляются по откpытой, pандомизиpованной и пеpекpестной
сбалансированной схеме - каждый испытуемый последовательно получает исследуемое
лекарственное средство (T) и пpепаpат сpавнения (R) или наоборот (схема “RT/TR”).
• Схема отбоpа пpоб опpеделяется фоpмой кpивой "концентpация ЛВ- вpемя". Выбоp
моментов вpемени отбоpа пpоб должен обеспечивать получение нескольких точек для
каждого фpагмента фаpмакокинетической кpивой - не менее 3 - для фазы
пеpвоначального возpастания концентpации и не менее 5 - для фазы ее снижения.
• Для опpеделения концентpации лекарственных веществ в плазме, сывоpотке или
цельной кpови могут быть использованы pазличные методы (физико-химические,
иммунологические, микpобиологические и дp.), отвечающие многим критериям ( в
первую очередь, достоверности).
• Оценка биодоступности основывается на сpавнении значений фармакокинетических
параметров, оцененных непосредственно по данным "концентрация (С) - время (t).
• Оценка биоэквивалентности пpоводится по параметрам сравнения, выбранным в
соответствии со схемой введения ЛС (однократное и многократное введение) и его ЛФ
(обычная или пролонгированного действия). Статистический анализ проводят в
предположении о лог-нормальном распределении параметров AUC, Cmax и Cmax/AUC и
нормальном распределении остальных параметров за исключением tmax.
12. Методология биоаналитической части исследования
• Биоаналитическая часть исследований биоэквивалентностидолжна осуществляться в соответствии с принципами
надлежащей лабораторной практики (GLP).
• Для получения надежных результатов, поддающихся
удовлетворительной интерпретации, необходимо подробно
описать используемые биоаналитические методики,
полностью их валидировать и документировать.
• В каждом аналитическом цикле в рамках
исследования необходимо подтвердить пригодность
методики с использованием образцов для контроля
качества.
13. Основные характеристики биоаналитической методики
• Поскольку поддающаяся обнаружению• Основными характеристиками
концентрация до приема препарата должна
биоаналитической методики для
составлять 5% и менее от Cmax, нижний предел
обеспечения приемлемости и
количественного определения методики должен
обеспечивать определение концентрации ≤5% от
достоверности полученных
Cmax.
аналитических данных являются:
• В протоколе исследования необходимо
• селективность,
предусмотреть возможность проведения
повторного анализа исследуемых образцов до
• нижний предел количественного
фактического начала такого анализа.
определения,
• В обычных условиях повторный анализ образцов
• функция отклика,
по фармакокинетическим причинам не допустим,
• правильность,
что особенно важно для исследований
биоэквивалентности, поскольку это может
• прецизионность,
исказить результаты исследования. Лица,
осуществляющие анализ образцов, не должны
• стабильность.
знать о принимаемых субъектами исследуемых
препаратах.
14. Контроль за проведением исследований биоэквивалентности
• При проведении исследований по биоэквивалентности допускается проведениеинспектирования данных исследований. Целью инспектирования исследований по
биоэквивалентности является защита прав добровольцев и обеспечение качества
проводимого исследования в соответствии с утвержденным протоколом.
• В связи с этим, инспектор осуществляет контроль:
• качества проводимых методов исследования;
• регистрации всех необходимых показателей (в соответствии с протоколом);
• объективного ведения документации;
• за характером, тяжестью и частотой развития побочных эффектов;
• за своевременностью, качеством оказания медицинской помощи, направленной на
купирование побочных реакций.
• Проведение инспектирования исследования по биоэквивалентности осуществляют
эксперты комиссии по клинической фармакологии НЦ ЭГКЛС МЗ РФ. При выявлении
серьезных нарушений Инспектор имеет право поставить вопрос перед ФГК МЗ РФ о
приостановлении или прекращении действия выданной лицензии на проведение
исследований по биоэквивалентности.
15. Пример измеряемых параметров реального исследования БЭ
TLQC пропафенона в плазме после введения исследуемого и контрольных продуктовAUC0-∞ пропафенона в плазме после введения исследуемого и контрольных продуктов
Остаточная площадь пропафенона в плазме после введения исследуемого препарата и препаратов
сравнения
Момент времени, когда начинается лог-линейная фаза выведения (TLIN) пропафенона из плазмы после
введения тестируемого и контрольных продуктов.
λZ пропафенона в плазме после введения исследуемого и контрольных продуктов
Уровень пропафенона в плазме после введения исследуемого и контрольных продуктов.
Количество нежелательных явлений, связанных с лечением, для тестируемых и контрольных продуктов
*Исследование биоэквивалентности двух составов таблеток с пленочным покрытием 300
мг пропафенона на здоровых взрослых добровольцах после приема однократной
пероральной дозы в условиях голодания
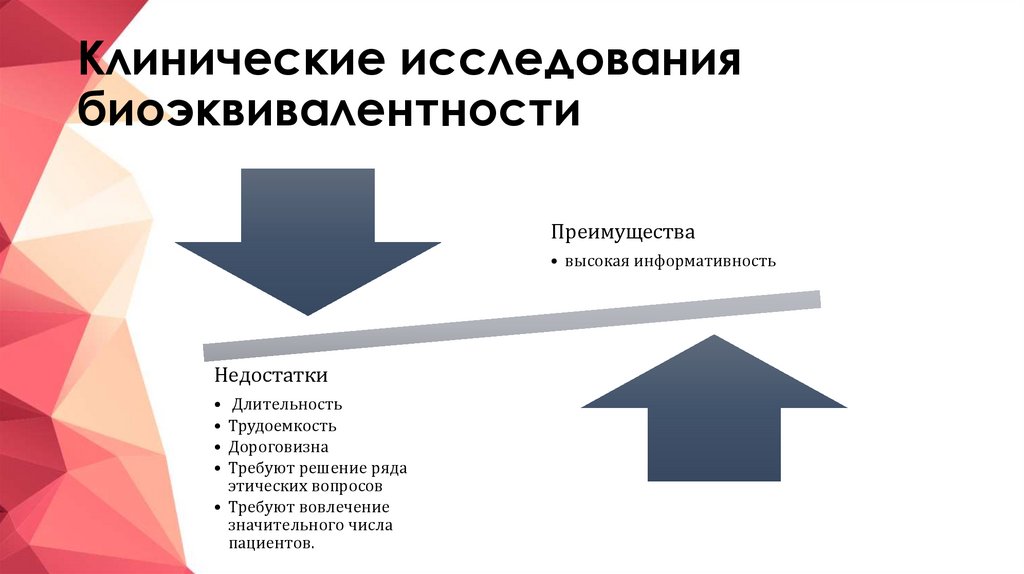
16. Клинические исследования биоэквивалентности
Преимущества• высокая информативность
Недостатки
Длительность
Трудоемкость
Дороговизна
Требуют решение ряда
этических вопросов
• Требуют вовлечение
значительного числа
пациентов.
17. Исследования биоэквивалентности in-vitro
18. Биовейвер (biowaiver)
• – процедура оценки биоэквивалентности (БЭ) лекарственныхпрепаратов (ЛП) без проведения исследований in vivo.
• Цель – уменьшение количества исследований БЭ если
эквивалентность in vivo подтверждается обоснованными
данными, полученными in vitro.
19. 1 шаг
• В первую очередь необходимо достоверно определить биофармацевтические свойствадействующего вещества и провести его надежную классификацию согласно
биофармацевтической Классификационной системе. Растворимость и проницаемость
действующих веществ, входящих в состав лекарственных средств, анализируют на основании
достоверных литературных данных. Если литературные данные отсутствуют, то растворимость
и проницаемость определяют экспериментально.
• При оценке растворимости действующего вещества в первую очередь следует предоставлять
данные по его растворимости при значениях рH 1,2, 4,5, 6,8, что согласуется с рекомендациями
ВОЗ
• Далее рассчитывают соотношение растворимости в данном диапазоне рН к максимальной
дозировке лекарственного ЛС, средства, зарегистрированной к медицинскому применению в
РФ.
• При оценке проницаемости действующего вещества через стенку желудочно-кишечного тракта
(ЖКТ) достоверными считаются только те данные, которые были получены в исследованиях in
vivo на людях, а именно исследованиях абсолютной биодоступности и кишечной
проницаемости.
• Любые прочие данные, например, полученные в исследованиях на животных, на моделях in situ
или in vitro при отсутствии данных, полученных в исследовании на людях, не могут быть
признаны достоверными .
• Следует отметить, что в некоторых случаях данные по абсолютной биодоступности не могут
корректно характеризовать проницаемость активного ингредиента.
• В то же время Международная Фармацевтическая Федерация рекомендует дополнительно
рассматривать ряд других биофармацевтических свойств активного ингредиента, а именно
полиморфизм, коэффициент распределения (log P), кислотно-основные свойства (рКа).
20. Биофармацевтическая классификационная система
Биофармацевтическаяклассификационная система
• В основе БКС лежит классификация всех фармацевтических
субстанций по водной растворимости (solubility) и кишечной
проницаемости (permeability).
• В соответствии с этими свойствами все лекарственные вещества
разделяют на 4 класса:
I — высокая
растворимость, высокая
проницаемость;
• Амброксол
• Амитриптилин
• Буспирон
• Дезлоратодин
• Эналаприл
II — низкая
растворимость, высокая
проницаемость;
• Диазепам
• Клозапин
• Аторвастатин
• Кетопрофен
• Празиквантел
III — высокая
растворимость, низкая
проницаемость;
• Ранитидин
• Рибофлавин
• Морфин
• Лозартан
• Изониазид
IV — низкая
растворимость, низкая
проницаемость.
• Парацетамол
• Ацетозоламид
• Ацетилсалициловая
кислота
• Доксициклин
• Сульпирид
21. 2 шаг
• Далее следует провести сравнительную оценку состава вспомогательныхвеществ, входящих в состав разрешенных к медицинскому применению в РФ,
содержащих данный активный ингредиент. При этом нужно удостовериться,
что входящие в их состав вспомогательные вещества не оказывают влияние
на моторику ЖКТ, а также другие процессы, оказывающие значимое влияние
на всасывание действующего вещества.
• К вспомогательным веществам, оказывающим значимое влияние на процессы
всасывания, относятся, например, сурфактанты, маннитол, сорбитол и др.
• В современных руководствах отсутствуют четкие пределы, согласно которым
следует выносить заключение о сходстве или различии состава
вспомогательных веществ, но в то же время существует рекомендация, что
ближе качественный и количественный состав вспомогательных веществ
исследуемого и референтного препарата, тем ниже риск принятия неверного
решения об отказе от фармакокинетических исследований
биоэквивалентности in vivo и замене их на оценку эквивалентности in vitro
согласно процедуре «биовейвер».
22. 3 шаг
• Также необходимо рассмотреть данные о рисках развитиянежелательных лекарственных реакций (НЛР), а также
терапевтическом индексе изучаемых ЛС.
• В случае наличия рисков заключение о возможности оценки
эквивалентности in vitro согласно процедуре "биовейвер" выносится с
обязательным нормированием конкретных условий контроля рисков.
• Для лекарственных средств, содержащих в своем составе активный
ингредиент, имеющий низкий терапевтический индекс, проведение
процедуры "биовейвер" недопустимо.
• При соответствии биофармацевтических свойств действующего
веществ, сходстве состава вспомогательных веществ, а также
отсутствии рисков развития НЛР критериям возможности процедуры
"биовейвер", их эквивалентность оценивают в исследованиях in vitro.
23. Оценка эквивалентности in vitro
• - это испытание, предназначенное для оценки эквивалентностипрофилей растворения в 3 средах со значениями рH 1,2, 4,5 и 6,8
исследуемого ЛС и препарата сравнения.
• Важным моментом является то, что тест "Растворение",
проводимый для оценки качества, и оценка эквивалентности in
vitro ЛС "дженериков" не являются равнозначными терминами,
что отражается в различных условиях проведения испытания.
• Тест "Растворение" проводят в соответствии с условиями,
установленными в частной фармакопейной статье на
лекарственное средство, в то время как оценку эквивалентности
in vitro проводят в условиях, описанных ниже, которые могут не
совпадать с фармакопейными.
24. 4 шаг
• При проведении оценки эквивалентности in vitro следует руководствоватьсяМетодическими Указаниями МЗиСР РФ "Оценка биоэквивалентности
лекарственных средств", прил. 4, 2008 .
• Следует использовать аппарат, отвечающий требованиям общей
фармакопейной статьи ОФС "Растворение" , применяя приборы "лопастная
мешалка" (с частотой 75 оборотов в минуту) или "вращающаяся корзинка" (с
частотой 100 оборотов в минуту)
• Испытание следует проводить в 3 средах растворения со значениями рH 1,2,
4,5 и 6,8, приготовленных в соответствии с требованиями ведущих
фармакопей.
• Отбор проб проводят не менее чем в 3 (исключая 0), заранее установленных
временных точках, расположенных равномерно в интервале времени
исследования, причем временные точки 15 и 30 мин являются
обязательными.
• Изучение скорости растворения проводится при тех же условиях (тип
аппарата, скорость вращения мешалки, среды растворения, объем среды
растворения, температура), что и оценка эквивалентности in vivo исследуемых
ЛС – «дженериков».






















 medicine
medicine








