Similar presentations:
Вопросы биоэтики в фармакоэкономике и фармакотерапии с позиции безопасности пациента
1.
ЛекцияВопросы биоэтики в
фармакоэкономике и
фармакотерапии с позиции
безопасности пациента
кафедра фармакологии и медицинской
рецептуры ЗГМУ
2.
Главной ценностьючеловеческой жизни является
здоровье
Чтобы сохранить жизнь и помочь больному
человеку восстановить здоровье,
врач должен знать:
что делать, как делать, когда делать,
а главное – зачем
3.
Лекарстваи есть те тонкие инструменты,
которые могут помочь больному человеку
справиться с трудностями или несчастьем,
а в связи с этим должны быть доступны
каждому человеку в нужный момент
и в достаточном количестве
4.
Современный фармацевтический рынок насыщенмножеством лекарственных препаратов
Нравственный долг врача,
включая выбор препарата, должен,
в первую очередь, исходить из интересов пациента
Прежде всего необходимо понимать,
чем отличаются
патентованные (оригинальные) препараты
от непатентованных (генерических) лекарственных
средств
5.
Оригинальный лекарственныйпрепарат
— это препарат, который является
исключительной собственностью
компании-разработчика или компаниивладельца первой
лицензии на его продажу
До истечения срока действия патента
никакая другая фармацевтическая
компания не вправе синтезировать или
использовать чужое зарегистрированное
активное вещество в своих коммерческих
или некоммерческих целях
6.
История оригинального препаратаначинается с синтеза химической молекулы,
продолжается в доклинических
исследованиях (токсичность, тератогенность,
мутагенность, доказательства
фармакодинамического эффекта) и
завершается клиническими испытаниями по
эффективности и безопасности на сотнях и
тысячах пациентов, которые проводятся в
сравнении с плацебо или с эталонным
препаратом во всех четырех фазах
клинических испытаний
7.
При создании оригинального препарата применяютстандартные приемы
Good Clinical Practice
(добротная клиническая практика),
что требует огромных финансовых затрат
Оригинальный препарат защищают патентом,
срок действия которого
в Европе длится 10 лет
За этот период продажа оригинального препарата должна
покрыть затраты на его создание и принести прибыль для
будущих разработок компании
в области клинической фармакологии
8.
Появление оригинального препаратаЕго исключительное присутствие на рынке
до истечения срока действия патента
Окончание срока действия патентных прав
Появление генериков
9.
Генерик— это лекарственный препарат, который
появляется после окончания срока
действия патентной защиты
оригинального препарата, и он (вернее
активное вещество), таким образом, уже
не является исключительной
собственностью фармацевтической
компании, которая его разработала или
владела первой лицензией
на его реализацию
На этом основании генерик может производиться
10.
Копиями считают те лекарственные препараты,которые представлены на рынках стран со
слабой или отсутствующей патентной
защитой химических молекул, а отсюда —
активных ингредиентов лекарственных
средств (Policy Relating to Generic Medicines in
the OECD. Final report for the European
Commission. NERA, S.J. Berwin & Co, YRCR Ltd.,
December, 1998)
Генерики дублируют оригинальные препараты,
срок действия патентных прав которых
истек, в то время как копии – это препараты,
патентная защита которых в данной стране
юридически не реализуема
11.
Создание генерика гораздо более простойпроцесс, чем создание
оригинального препарата
В Европе для регистрации генерика
необходимы доказательства подлинности
субстанции, сведения о фармацевтических
свойствах препарата (распадаемость
таблеток, испытание на стабильность и т.д.), а
также данные о биоэквивалентности
Процедура этих исследований
не очень сложна
12.
Как правило, генерик назначают однократно24 здоровым добровольцам с определением
концентрации активного вещества в крови
Кривая параметров биоэквивалентности не должна
выходить за пределы 80 – 125% от кривой
оригинального препарата
Пролонгированный генерик для достижения
«стационарного состояния» назначают в течение 5
дней
После проведения этих исследований
генерик готов к регистрации
13.
Таким образом, генерические препараты могутотличаться по своим фармакокинетическим
или фармакодинамическим свойствам от
оригинальных препаратов
Качество разных генерических препаратов
не одинаково
Генерики имеют свои собственные названия,
т.е. зарегистрированные торговые марки, что
усложняет работу врача по распознаванию
оригинальных препаратов от генерических
аналогов, производимых различными
фирмами
14.
Польза генериковИспользование генериков способствует
снижению стоимости лечения в ЛПУ (что
важно в условиях недостаточного
финансирования и низкой покупательной
способности населения)
Появление генериков стимулирует компаниюразработчик на синтез новых поколений
оригинальных препаратов
15. Критерии выбора генерика
Качество генерикаЦена
Последовательность и постоянство
фирмы - производителя
16. Биоэквивалентность
Два лекарственных препарата биоэквивалентны, еслиони фармацевтически эквивалентны и если их
биодоступность (скорость и степень всасывания)
после введения в одинаковой молярной дозе сходна в
такой степени, что их эффективность и безопасность в
основном одинаковы.
EMEA, The rules governing medicinal products in the European
Union.
Investigation of Bioavailability and Bioequivalence, v. 3C, 1998,
pp. 231–244
Биоэквивалентные лекарственные препараты — это
фармацевтически эквивалентные препараты, которые
имеют сравнимую биодоступность при исследовании в
сходных экспериментальных условиях.
FDA, Electronic Orange Book.
Approved Drug Products with Therapeutic Equivalence
Evaluations, 20th Edition, 2000
17. Терапевтическая эквивалентность
Лекарственный препарат терапевтически эквивалентен другому препарату,если он содержит ту же активную субстанцию и, по результатам
клинических исследований, обладает такой же эффективностью и
безопасностью, как и препарат сравнения, чья эффективность и
безопасность уже установлены.
The rules governing medicinal products in the European Union.
Investigation of Bioavailability and Bioequivalence, v. 3C, 1998, pp. 231–244
Терапевтически эквивалентными лекарственные препараты могут
считаться только в том случае, если они фармацевтически эквивалентны,
имеют одинаковый клинический эффект и одинаковый профиль
безопасности.
FDA, Electronic Orange Book.
Approved Drug Products with Therapeutic Equivalence Evaluations, 20th
Edition, 2000
18.
В 70-е годы все копии и генерики пытались называтьих родовым (генерическим) именем, а фирму
производителя определять другим способом
Отсюда и происходит название «генерики» (generics),
принятое во всем мире
Существуют генерики с так называемой «добавленной
ценностью», когда производители владеют
собственным гарантированным методом синтеза
активной субстанции или покупают другие
компании, которые производят более сложную
лекарственную форму, чем оригинальный препарат
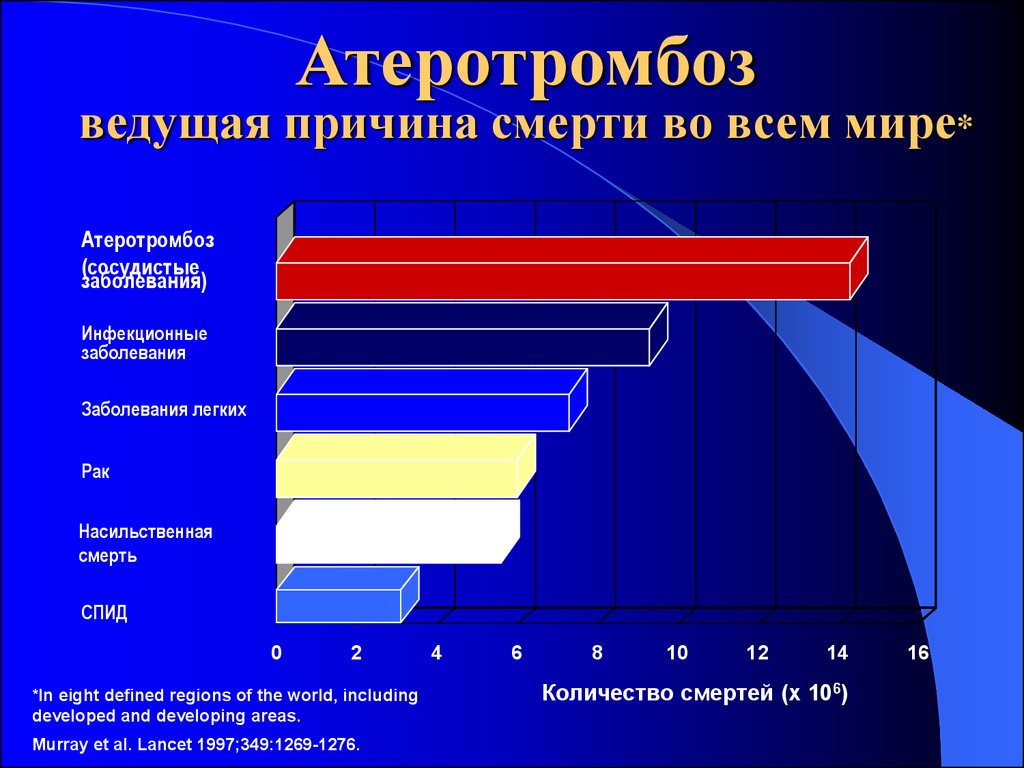
19. Атеротромбоз ведущая причина смерти во всем мире*
Атеротромбоз(сосудистые
заболевания)
Инфекционные
заболевания
Заболевания легких
Рак
Насильственная
смерть
СПИД
0
2
*In eight defined regions of the world, including
developed and developing areas.
Murray et al. Lancet 1997;349:1269-1276.
4
6
8
10
12
14
Количество смертей (x 106)
16
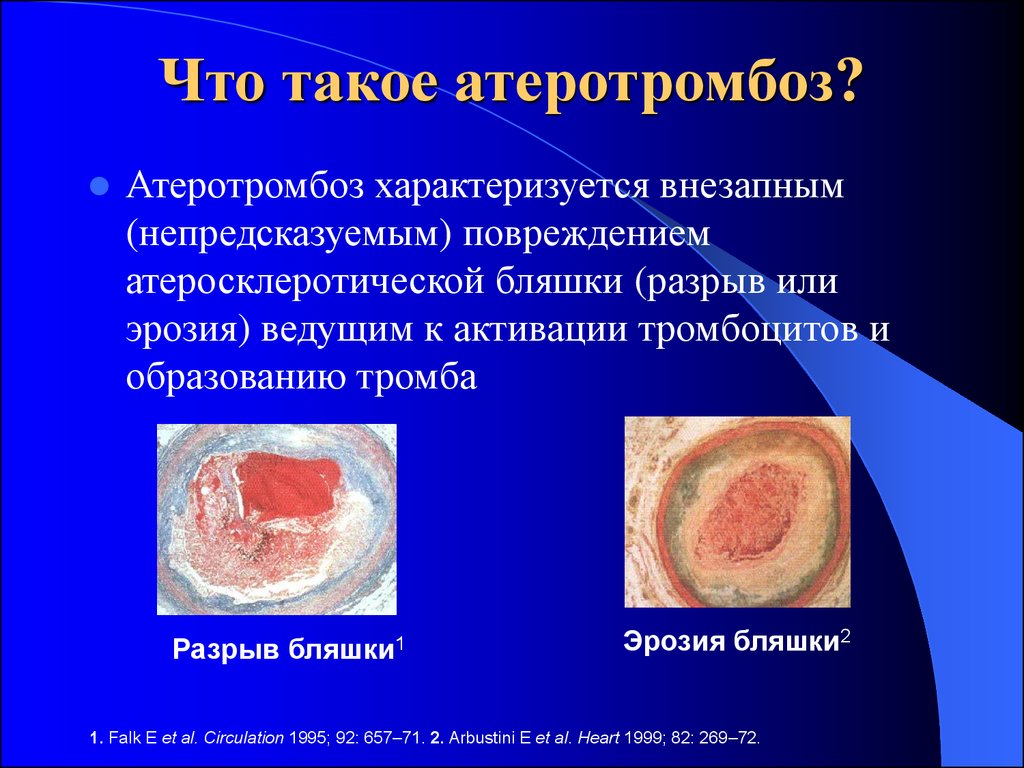
20. Что такое атеротромбоз?
Атеротромбоз характеризуется внезапным(непредсказуемым) повреждением
атеросклеротической бляшки (разрыв или
эрозия) ведущим к активации тромбоцитов и
образованию тромба
Разрыв бляшки1
Эрозия бляшки2
1. Falk E et al. Circulation 1995; 92: 657–71. 2. Arbustini E et al. Heart 1999; 82: 269–72.
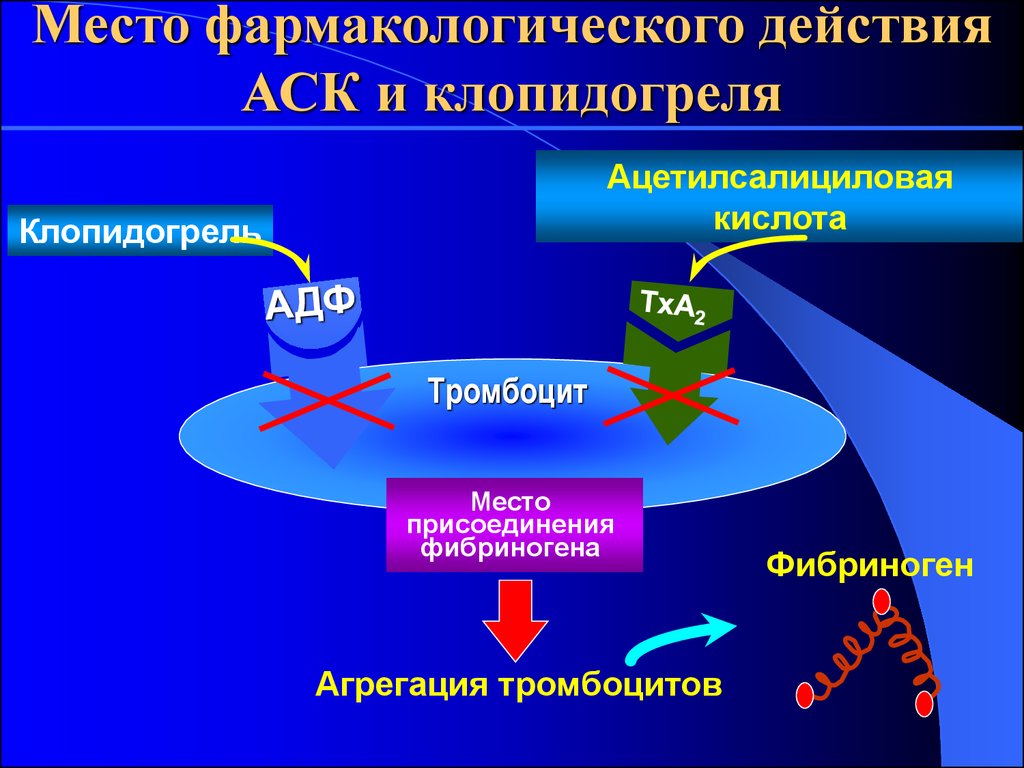
21. Место фармакологического действия АСК и клопидогреля
Ацетилсалициловаякислота
Клопидогрель
Тромбоцит
Место
присоединения
фибриногена
Агрегация тромбоцитов
Фибриноген
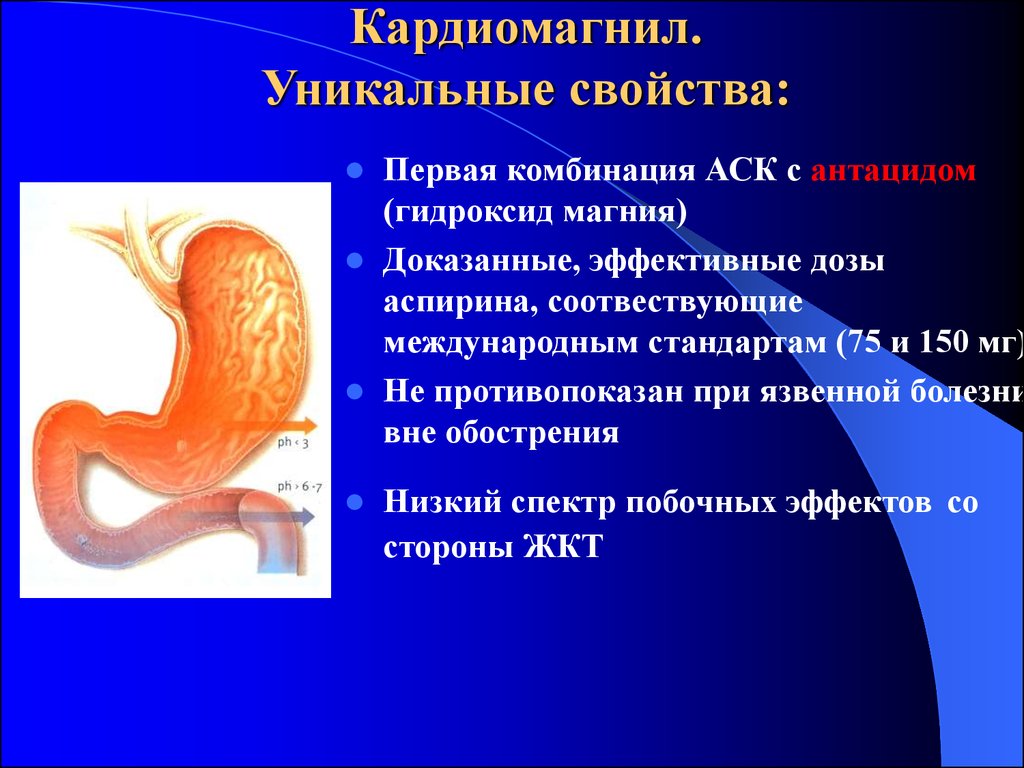
22. Кардиомагнил. Уникальные свойства:
Первая комбинация АСК с антацидом(гидроксид магния)
Доказанные, эффективные дозы
аспирина, соотвествующие
международным стандартам (75 и 150 мг)
Не противопоказан при язвенной болезни
вне обострения
Низкий спектр побочных эффектов со
стороны ЖКТ
23. Виды нарушений ЖКТ, вызываемые ацетилсалициловой кислотой
• АСК - индуцированные язвы желудка• Повреждение слизистой оболочки
тонкого и толстого кишечника
(кровотечения, перфорации, обстукции,
о.колит, хронические заболевания
кишечника)
• Суммарный риск повреждения ЖКТ в 5
раз выше у пожилых пациентов
24. Нарушения ЖКТ, вызываемые АСК
• АСК - индуцированная энтеропатия состояние, характеризующеесякровотечениями, потерей белка,
синдромом мальабсорбции
• 50% пациентов, принимающих АСК
более 6 месяцев
•Lanza FL. A guideline for the treatment and
prevention of NSAID-induced ulcers. Am J of
Gastroenterology 1998;93;2037-46
25.
Известно, что использование кишечнорастворимых форм ацетилсалициловойкислоты с аспирин-индуцированными язвами
не приводит к увеличению показателей
рубцевания язв
У 90% больных рубцевание язв происходит
только после отмены кишечно-растворимых
форм ацетилсалициловой кислоты
26.
Кардиомагнил(Nycomed Danmark AS, Дания)
представляет собой соединение АСК (75 и 150 мг) с
невсасывающимся антацидом - гидроокисью магния,
действующим на протяжении всего
желудочно-кишечного тракта
Эффективность невсасывающихся антацидов обусловлена:
- адсорбцией соляной кислоты
- снижением протеолитической активности желудочного сока
(посредством адсорбции пепсина, повышения pH среды, в
результате чего пепсин становится неактивным)
- обволакивающими свойствами
- связыванием лизолецитина и желчных кислот, оказывающих
негативное воздействие на слизистую желудка
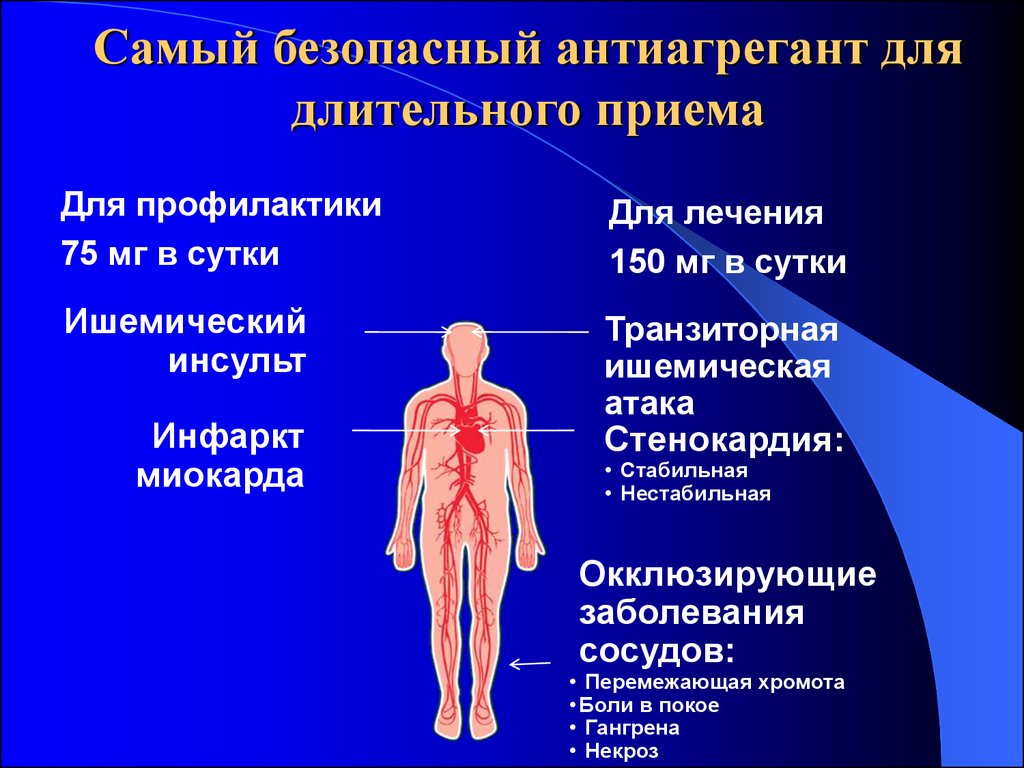
27. Самый безопасный антиагрегант для длительного приема
Для профилактики75 мг в сутки
Для лечения
150 мг в сутки
Ишемический
инсульт
Транзиторная
ишемическая
атака
Стенокардия:
Инфаркт
миокарда
• Стабильная
• Нестабильная
Окклюзирующие
заболевания
сосудов:
• Перемежающая хромота
• Боли в покое
• Гангрена
• Некроз
28. Стоимость месячной терапии в расчете на 150 мг АСК в сутки
$7$6
$5
$4
$3
$2
$1
$0
Тромбо АСС таб. п/о
100мг №30
Тромбо АСС таб. п/о
50мг №30
Аспирин кардио таб.
п/о 100мг №20
Аспирин кардио таб.
п/о 300мг №20
Кардиомагнил таб.
п/о 75мг №100
Кардиомагнил таб.
п/о 75мг №30
Кардиомагнил форте
таб. п/о 150мг №100
Кардиомагнил форте
таб. п/о 150мг №30
«Фармвестник Алтая» 2006 г
29.
Иногда активное вещество для генерикасинтезируется в Китае или Индии, а готовая
лекарственная форма производится
в других странах
Лекарственный препарат в этом случае может
рекламироваться как продукт какой-нибудь
высокоразвитой страны
(США, Канады, Финляндии, Германии)
Такие сведения обычно не публикуются, что
существенно затрудняет выбор достойного
препарата для рациональной фармакотерапии
30.
Качество генерика в ходе длительногоприменения не подвергается повторной
проверке, а технология его производства не
всегда точно соответствует оригинальной
патентованной технологии
Исследования биоэквивалентности генерика
также не гарантируют его долгосрочной
безопасности
31.
В Европе доля генериков среди назначаемыхпациентам препаратов широко варьирует –
от 1% в Швейцарии до < 50% в других странах
Заманчивая реклама генерика
сама по себе не может считаться
достоверной информацией
Обязательным условием для генерика является
проведение клинического исследования по
принципам
GMP (добротная практика производства) и
GCP (добротная клиническая практика)
Предполагается, что качество генерика выше у
известных и авторитетных производителей, чем у
мало известных фирм
32.
Главной задачей фармакоэкономикиявляется конечная польза
любых лекарственных вмешательств
для пациента
Фармакоэкономика оценивает соотношение
между экономическими затратами,
клинической эффективностью и
безопасностью лекарств при соблюдении
строгих требований к качеству
как оригинальных препаратов,
так и генериков
33.
Внедрениеформулярной системы
Перечень жизненно-важных лекарственных
средств (Приказ Кабинета Министров 2343 от
29.12.05)
Руководство
по использованию лекарственных средств
Под редакцией
Стефанов А.В., Викторов А.П., Бухтиарова Т.А.
2006
34.
Формулярная система –• профессиональный отбор из всех имеющихся на рынке страны наиболее терапевтически- и затратноэффективных и безопасных лекарственных средств
• разработка и распространение объективной
лекарственной информации
• обучение медицинских работников
• мониторинг правильности использования
препаратов
• применение мер предотвращения и
исправления ошибок фармакотерапии
35. Классификационные сравнения
Перечень ЖВЛСруководство МОЗ Украины
X. Средства, влияющие на ССС
2.2. Сердечно-сосудистые средства
(мы выбрали только противоаритмические
ЛС, остальные включены по алфавиту без
классификации)
2.2.9 Средства для лечения нарушений ритма
сердца
2.2.9.3. Средства для лечения
наджелудочковых и желудочковых
аритмий
Амиодарон
Атенолол
Лидокаин
Лаппаконитина гидробромид
Мексилетин
Метопролол
Прокаинамид
Пропафенон
Хинидин
Этацизин
Амиодарон
Соталол
Морацизин (Этмозин)
Пропионил фенотиазин (Этацизин)
Лаппаконитина гидробромид
Прокаинамид
Пропафенон
Хинидин
2.2.9.4. Средства для лечения желужочковых
аритмий
Лидокаин
Мексилетин
Сульфат магния
36. Лекарственные формы амиодарона
Страна и производительКанада
Altimed Pharma Inc.
Genpharm Inc.
Novopharm Ltd.
Pharmascience Inc.
Wyeth-Ayerst Canada Inc.
США
Alphapharm PTY Ltd.
Barr Laboratories Inc.
Eon Labs Manufacturing
Geneva Pharmaceuticals Inc.
Taro Pharmaceutical Industries Ltd.
TEVA Pharmaceuticals USA
Upsher-Smith Laboratories Ins.
Wyeth-Ayerst Inc.
ICN Pharmaceuticals Inc.
Название препарата
Алти-амиодарон
Ген-амиодарон
Ново-амиодарон
PMS-амиодарон
Кордарон
Амиодарона гидрохлорид
Амиодарона гидрохлорид
Амиодарона гидрохлорид
Амиодарона гидрохлорид
Амиодарона гидрохлорид
Амиодарона гидрохлорид
Пацерон
Кордарон
Ритмиодарон
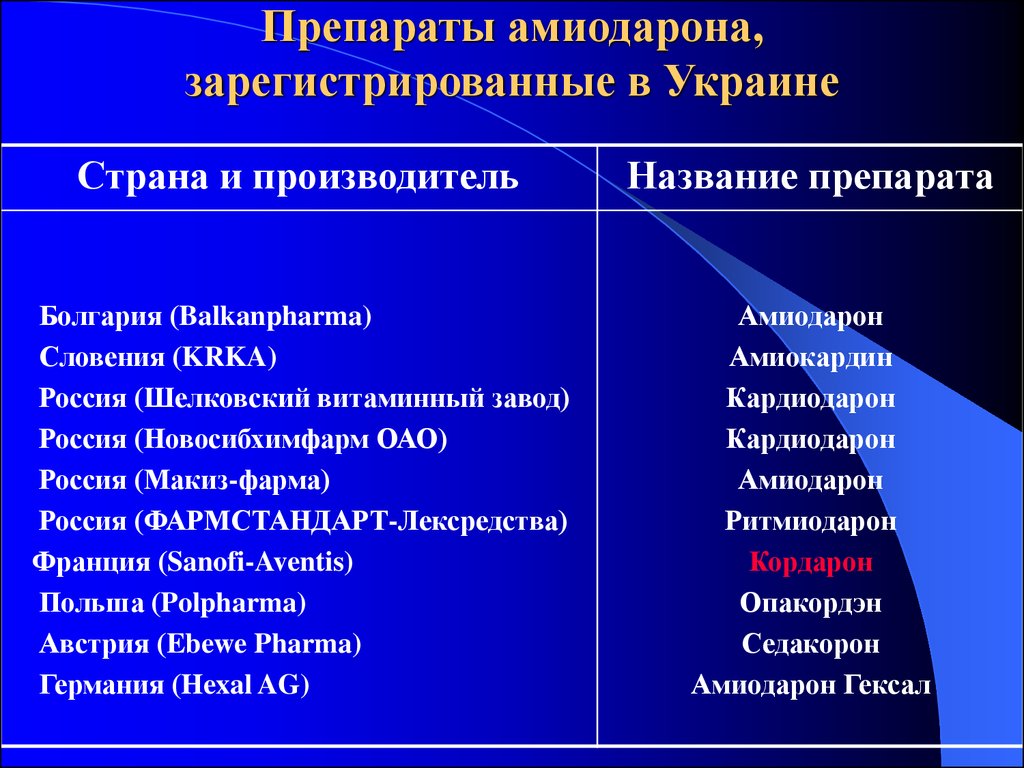
37. Препараты амиодарона, зарегистрированные в Украине
Страна и производительНазвание препарата
Болгария (Balkanpharma)
Словения (KRKA)
Россия (Шелковский витаминный завод)
Россия (Новосибхимфарм ОАО)
Россия (Макиз-фарма)
Россия (ФАРМСТАНДАРТ-Лексредства)
Франция (Sanofi-Aventis)
Польша (Polpharma)
Австрия (Ebewe Pharma)
Германия (Hexal AG)
Амиодарон
Амиокардин
Кардиодарон
Кардиодарон
Амиодарон
Ритмиодарон
Кордарон
Опакордэн
Седакорон
Амиодарон Гексал
38.
АмиодаронАнтиаритмический препарат III класса, блокирует
ионные каналы (главным образом – калиевые, в
меньшей степени – кальциевые и натриевые)
мембран кардиомиоцитов, тормозит возбуждение
альфа- и бета-адренорецепторов. Увеличивает
продолжительность потенциала действия всех
сердечных структур за счет выраженного снижения
его амплитуды. Обладает отрицательным
хронотропным влиянием, уменьшает потребность
миокарда в кислороде, вызывает отрицательный
дромотропный эффект, замедляет проводимость и
удлиняет рефрактерный период в синусном и АVузлах, снижает сопротивление коронарных сосудов
39.
Основные параметры фармакокинетикиамиодарона
Биодоступность – 30-80%
Сmax после однократного приема - через 3-7 часов
Связь с белками плазмы – 96%
Накапливается в печени, легких, селезенке и депонируется в
жировой ткани
Т1/2 амиодарона после однократного приема 3,2 – 20,7 часов, Т1/2
амиодарона при продолжительном лечении - 20-100 дней
Метаболизируется в печени с помощью цитохромов Р450 с
образованием метаболита дезэтиламиодарона (ДЭА)
Выводится с желчью, почечная экскреция незначительна
После прекращения приема выведение препарата продолжается
в течение нескольких месяцев
40.
Побочные эффектыСердечно-сосудистая система: дозозависимая брадикардия, возможна
остановка синусового узла, особенно у пациентов пожилого возраста,
иногда AV-блокада. Есть сообщения о развитии или прогрессировании
аритмий (вплоть до остановки сердца)
Эндокринная система: гипо- или гипертиреоз (требуется отмена препарата)
ЦНС и периферическая нервная система: невропатия, миопатия,
мозжечковая атаксия, экстрапирамидный тремор, внутричерепная
гипертензия, кошмарные сновидения
Пищеварительная система: тошнота, рвота, нарушения вкуса, нарушения
функции печени, повышение активности печеночных трансаминаз,
псевдоалкогольный гепатит, цирроз
Дыхательная система: альвеолярный и/или интерстициальный пневмонит,
фиброз, плеврит, бронхиолит, пневмония (с летальным исходом),
бронхоспазм
Органы зрения: невропатия или неврит зрительного нерва, микроотслойка
сетчатки
Прочие: в единичных случаях – импотенция, гемолитическая или
апластическая анемия
41.
Амиодарон является очень затребованнымпрепаратом, что послужило основанием для
создания его различных генериков
При переходе с оригинального препарата
на более дешевые генерики у врача могут возникнуть
этические проблемы, а у пациента - серьезные
осложнения, вплоть до летальных исходов
В Канадском кардиологическом журнале очень
детально была обсуждена проблема гарантий
биоэквивалентности и терапевтической
эквивалентности генериков амиодарона
(Цит. по Кардиология. 2003, №1)
42.
Было получено,что благодаря фармакокинетическим особенностям
амиодарона любые нежелательные проявления могут
наблюдаться через несколько недель после перехода с одной
лекарственной формы препарата на другую, что затрудняет
выяснение причинно-следственной связи при оценке
конечных результатов лечения
Измерение концентраций амиодарона и его основного
метаболита в обычной практике не проводится, поэтому
отклонение их плазменных уровней остаются неизвестными
Клиницист не в состоянии оценить адекватность исследований
по биоэквивалентности всех зарегистрированных генериков
Фармацевты не всегда информируют врача о замене
препаратов амиодарона
43.
Клинический примерМужчина 42 года, врожденный порок сердца.
3,5 года принимал кордарон по поводу рефрактерной
предсердной тахикардии.
Через 1 месяц после перехода на генерик амиодарона пациент
был госпитализирован в связи с появлением изменений в
легких. К этому времени отношение концентраций ДЭА к
амиодарону возросло с 0,8 до 1,8.
После возобновления приема кордарона этот показатель
снизился до нормы – 1,1.
Через несколько месяцев пациент возобновил прием генерика с
целью экономии.
Через 8 месяцев коэффициент вновь повысился до 1,6.
44.
«Необъяснимое» снижение эффективности илинарастание побочных реакций при смене препаратов
создают проблемы как для врача,
так и для пациента
Критерии оценки эквивалентности генериков
должны быть пересмотрены,
т.к в настоящее время они не гарантируют
возможность выявления клинических изменений
в состоянии больного
45.
Следует задуматься о фармакоэкономическихпреимуществах лекарственной терапии
Желание сделать лечение более дешевым вполне
понятно, однако вопрос о выборе терапии с
помощью оригинального препарата или генерика
должен решаться с учетом их клинической
эффективности
Нельзя опираться только на теоретические
предпосылки предполагаемой
фармакодинамической эффективности, требуется
обязательное клиническое подтверждение
активности каждого отдельно взятого препарата
46.
ПредложенияЦелесообразно учесть опыт других стран,
где приняты официальные документы, содержащие
сведения по биоэквивалентности генериков и
оригинальных препаратов
Введение нормативных требований об активном мониторинге
всех вновь зарегистированных лекарственных средств
(в т.ч. генериков). При необходимости проведения
дополнительных клинических исследований
Регулярное доведение информации о нежелательных
лекарственных реакциях до практикующих врачей
47.
Необходим банк данныхпо биоэквивалентности генериков и их
фармакоэкономической
целесообразности, так как генерики
в России закупаются и используются
в большем объеме,
чем оригинальные препараты








































 medicine
medicine








