Similar presentations:
Курс лекций по энзимиологии
1. Курс лекций по энзимиологии
• Лектор• Шумянцева Виктория Васильевна,
д.б.н. профессор кафедры биохимии
МБФ РНИМУ им. Н.И. Пирогова,
• Зав. лабораторией биоэлектрохимии
ИБМХ им. В.Н. Ореховича (кор. Б, ком.
354)
• 8 499 246 5820
2. Основные вопросы по 2-й лекции
• 1.Закон действующих масс. Скорость иконстанта скорости химической реакции.
• 2. Молекулярность реакций.
• 3. Порядок реакций.
• 4. Определение порядка реакции
(зависимость скорости от концентрации
реагента). Графический способ определения
порядка реакции.
• 5. Начальная скорость. Графики.
• 6. Способы выражения концентрации
растворов.
• Размерность констант скорости для реакций
различных порядков
3. Лекция 3.
• Единицы измерения скорости иконстанты скорости химических
реакций. Экспериментальный расчет
константы скорости мономолекулярной
и бимолекулярной реакции.
Определение порядка реакции.
4. Различные формы уравнения скорости первого порядка
• В дифференциальной формеуравнение для скорости первого
порядка
• V = -dA/dt =k[A]
• Размерность скорости
• моль/л с, моль/л мин
5. Интегрирование этого выражения дает -ln [A]=kt+C,
• Принимая граничные условия для величинконцентрации А (А0 и А) и времени (t и t0),
т.е.
• -ln[A] AA0=kt t0+C
• ln A0/A=kt,
• где А0 - начальная концентрация,
• А- концентрация в момент времени t
• Переход от натуральных логарифмов к
десятичным дает
• 2,303 lg A0/A = kt
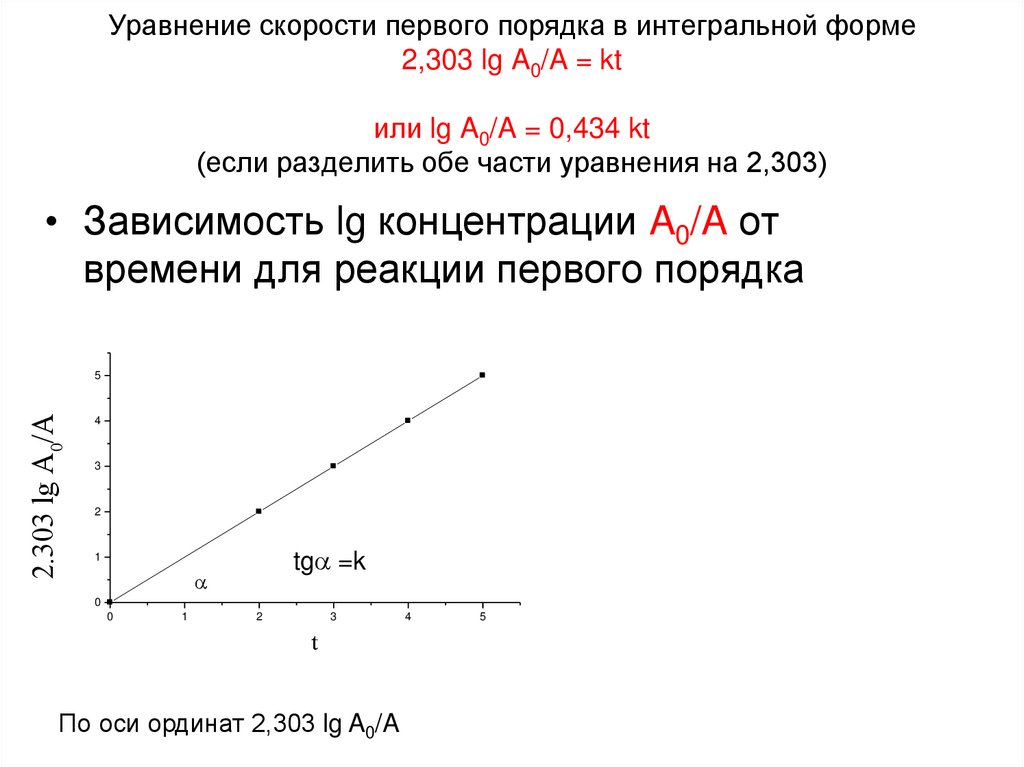
6. Уравнение скорости первого порядка в интегральной форме 2,303 lg A0/A = kt или lg A0/A = 0,434 kt (если разделить обе части
уравнения на 2,303)• Зависимость lg концентрации A0/A от
времени для реакции первого порядка
2.303 lg A0/A
5
4
3
2
tg =k
1
0
0
1
2
3
t
По оси ординат 2,303 lg A0/A
4
5
7. Размерность константы мономолекулярной реакции первого порядка
V=k[A]
V размерность (моль/л с, моль/л мин)
[A] размерность моль/л
k размерность c-1 , мин-1
8. Экспериментальное определение параметров реакции
• Часто кинетические измерения гораздопроще провести для образования
продукта, чем для исчезновения
реагента (субстрата).
• Например, при термическом
декарбоксилировании дикарбоновой
кислоты происходит выделение CO2
• HOOC-CH(NH2)-CH(CH3)-COOH = CO2
• + HOOC-CH(NH2)-CH2-CH2-CH3
9.
• За реакцией можно следить, измеряяскорость выделения CO2
• Если мы обозначим исходную
концентрацию дикарбоновой кислоты
через а, а количество CO2,
выделяющееся за время t, через x, то
количество дикарбоновой кислоты,
оставшееся ко времени t, должно быть
равно (a-x).
• ln A0/A=kt, или ln A0/(а-х)=kt,
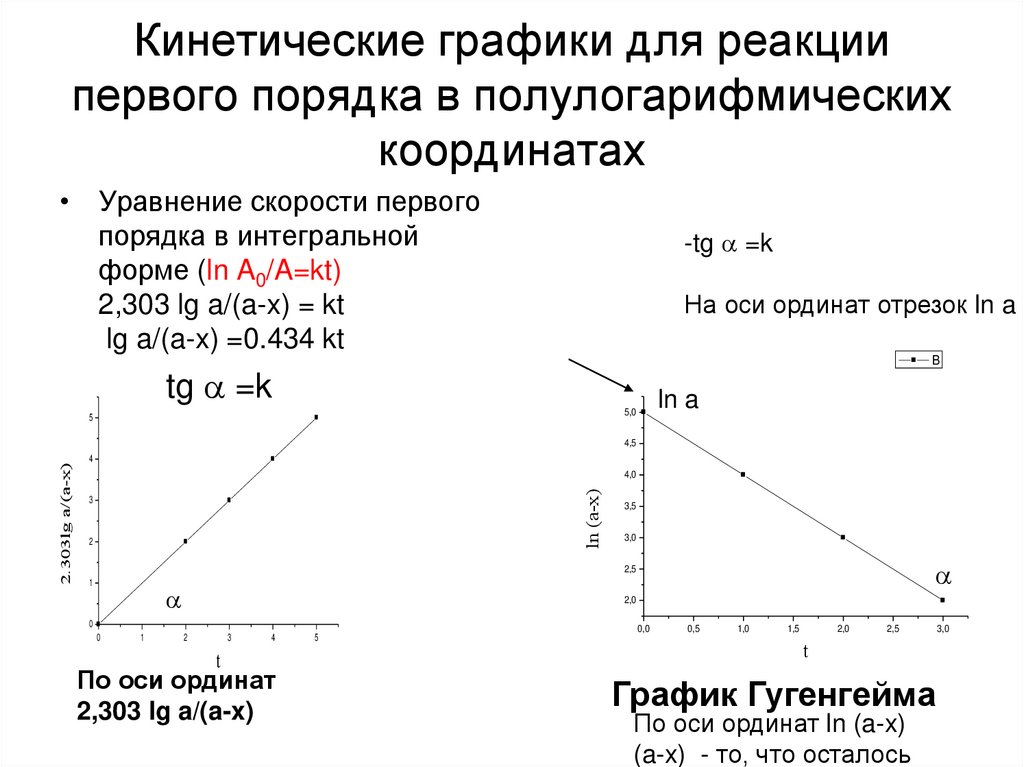
10. Кинетические графики для реакции первого порядка в полулогарифмических координатах
• Уравнение скорости первогопорядка в интегральной
форме (ln A0/A=kt)
2,303 lg a/(a-x) = kt
lg a/(a-x) =0.434 kt
-tg =k
На оси ординат отрезок ln a
B
tg =k
ln a
5,0
5
4,0
ln (a-x)
2.303lg a/(a-x)
4,5
4
3
2
3,5
3,0
2,5
1
2,0
0
0
1
2
3
t
4
По оси ординат
2,303 lg a/(a-x)
5
0,0
0,5
1,0
1,5
2,0
2,5
t
График Гугенгейма
По оси ординат ln (a-x)
(a-x) - то, что осталось
3,0
11. k=2,303/t lg[A]0/[A]t размерность константы скорости первого порядка c-1, мин-1
k=2,303/t lg[A]0/[A]t-1
-1
размерность константы скорости первого порядка c , мин
• Пример.
• Хлористый фенилдиазоний при 500 С в воде
подвергается термическому распаду по уравнению
первого порядка с константой скорости k = 0. 071
мин-1.
• Сколько времени нужно нагревать раствор при 500 С
для того , чтобы исходная концентрация, равная
0.01М, уменьшилась до 0.001М?
• Решение.
• 2.303 lg 0.01/0.001= 0.071t
• t=32.4 мин
12. Пример.
• Дипептид при 800 С в воде подвергается термическому распадупо уравнению первого порядка. За 32,4 мин. исходная
концентрация, равная 0.01М, уменьшилась на 90 %. Найти
константу скорости k этой реакции.
• 2.303 lg 0.01/0.001= 32.4k
• K=
13. k=2,303/t lg[A]0/[A]t
k=2,303/t lg[A]0/[A]t• При использовании этого уравнения концентрации не
обязательно выражать в абсолютных единицах.
Можно использовать, например, проценты.
• Задача. За какое время реакция пройдет на 90%?
[A]0 =0.01 M.
• Решение
• 2.303 lg 0.01/0.001= 0.071t
• Ответ
• t=32.4 мин
14. Пример.
• Дипептид при 800 С в воде подвергается термическому распадупо уравнению первого порядка за 32,4 мин . Исходная
концентрация равная 0.01М уменьшилась на 90 %. Найти
константу скорости k этой реакции.
• 2.303 lg 0.01/0.001= 32.4k
• K=
15. Время полупревращения реагента (субстрата) t1/2
• Для реакций первого порядка• 2,303 lg A0/A = kt
• Пусть t1/2 выражает время, необходимое для
завершения реакции наполовину, по истечении
которого [A]=1/2 [A0]
• 2,303 lg A0/1/2 [A0] = k t1/2
• 2,303 lg 2 = 0.693
t1/2 =0.693/k
16. t1/2 =0.693/k
• Время полупревращения субстрата вслучае реакции первого порядка
зависит только от константы скорости
реакции и не зависит от начальной
концентрации реагента (субстрата).
17. Задача
• Рассчитать время полупревращения• хлористого фенилдиазония при 500 С в воде
по уравнению первого порядка с константой
скорости k = 0. 071 мин-1.
• Решение
• t1/2 =0.693/k =0.693/0.071 мин-1
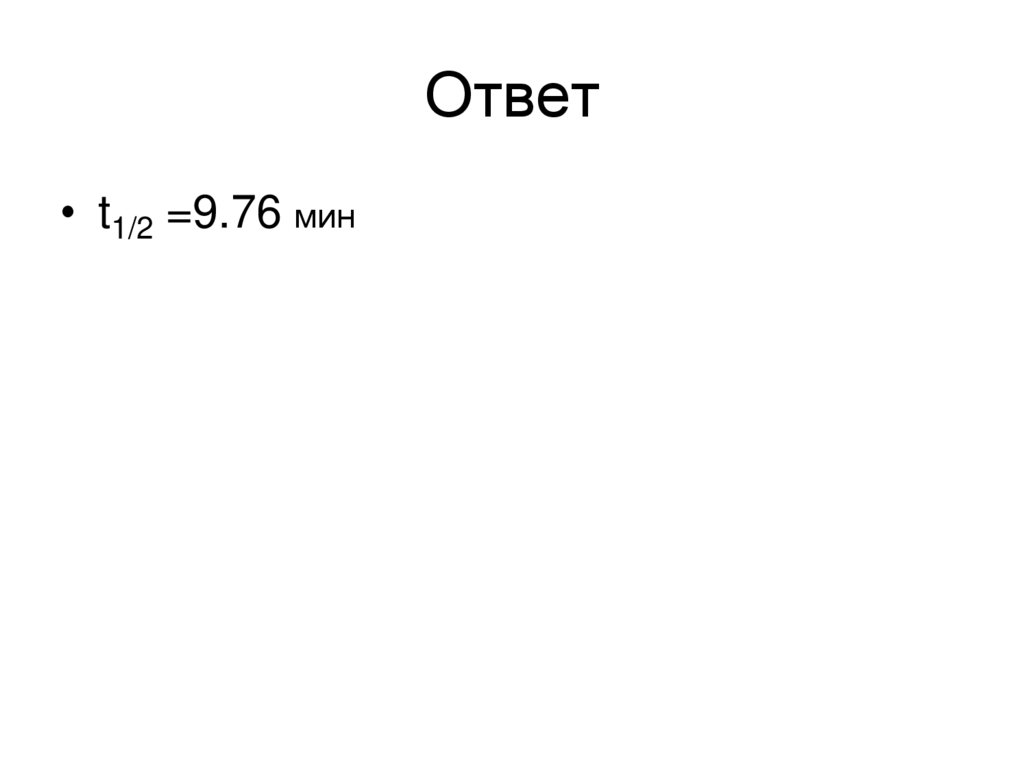
18. Ответ
• t1/2 =9.76 мин19. Реакции псевдопервого порядка
• Реакции псевдопервого порядка –этореакции второго порядка, для которых
концентрация одного из реагентов
столь высока, что остается практически
постоянной на протяжении всей
реакции. В этом случае получаем
зависимости, характерные для реакции
первого порядка.
20. Уравнение скорости реакции второго порядка
2A=C, v=-d[A]/dt= k[A]2
-d[A]/[A]2 =kdt
Интегрируем это уравнение
1/ [A]= kt+C
исходная концентрация реагента a
прореагировало x, (a-x) осталось,
x продукта образовалось
1/(a-x) -1/a =x/a(a-x)=kt
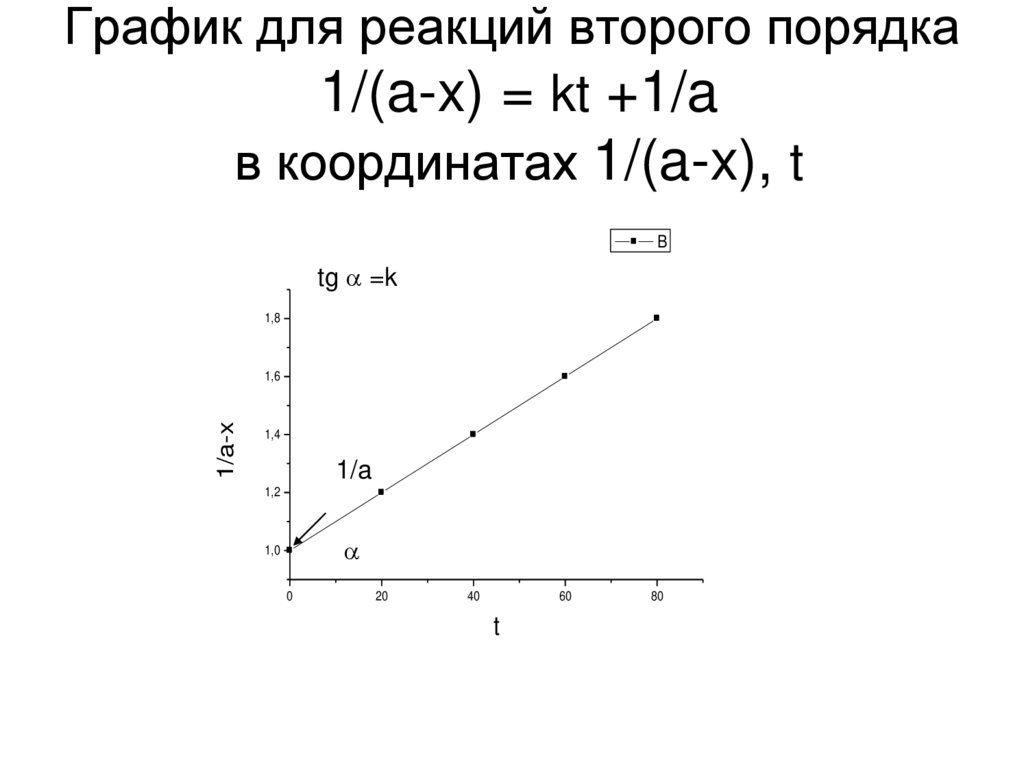
21. График для реакций второго порядка 1/(a-x) = kt +1/a в координатах 1/(a-x), t
Btg =k
1,8
1/a-x
1,6
1,4
1/a
1,2
1,0
0
20
40
60
t
80
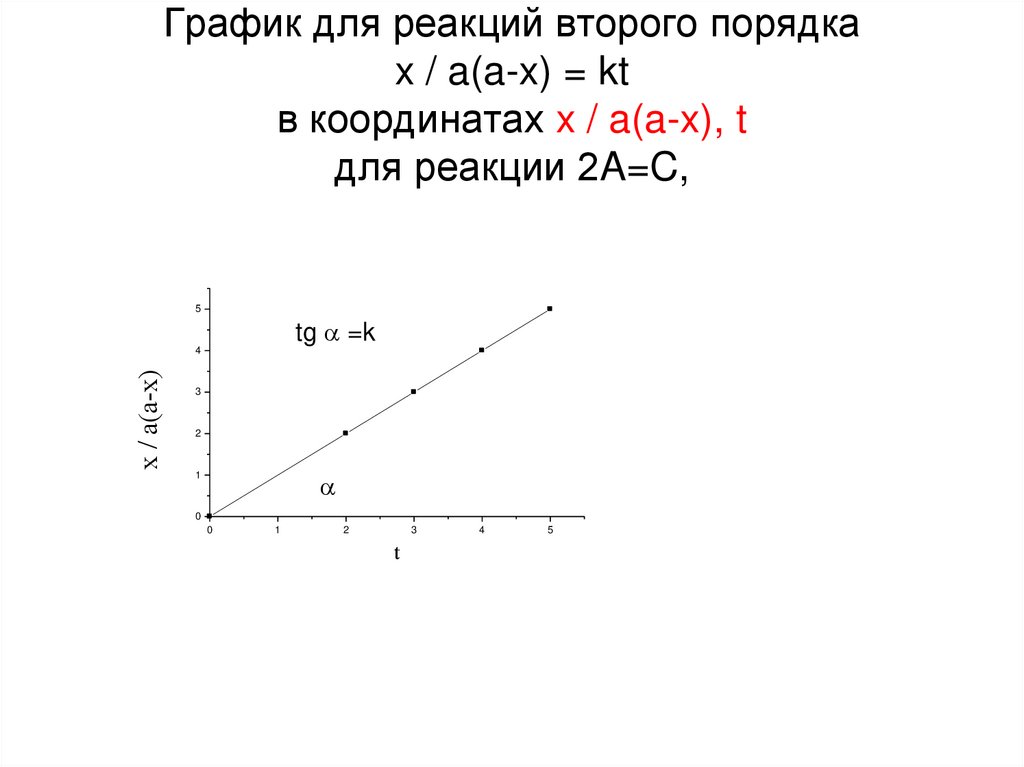
22. График для реакций второго порядка x / a(a-x) = kt в координатах x / a(a-x), t для реакции 2A=C,
5tg =k
x / a(a-x)
4
3
2
1
0
0
1
2
3
t
4
5
23. Время полупревращения реагента (субстрата) t1/2 для реакций второго порядка
• При t1/2 , x=1/2 a,• 1/(a-x) -1/a =x / a(a-x)=kt
• Получим
• t1/2 = 1/ka
• Для реакций второго порядка время
полупревращения субстрата обратно
пропорционально начальной концентрации реагента
(субстрата) а
24. Реакция второго порядка, в которой участвуют две разные молекулы
• В случае бимолекулярной реакцииA+B=C, v=-d[A]/dt = k[A][B]
• Если реакция протекает при
одинаковых концентрациях A и B, то
интегральная форма
• 1/ [A]= kt+C, или
• 1/(a-x) -1/a =x/a(a-x)=kt
25. Если используют разные концентрации А и В
• Уравнение имеет вид• V=dx/dt=k(a-x)(b-x)
• 2.303/(a-b) lg b(a-x)/a(b-x)=kt
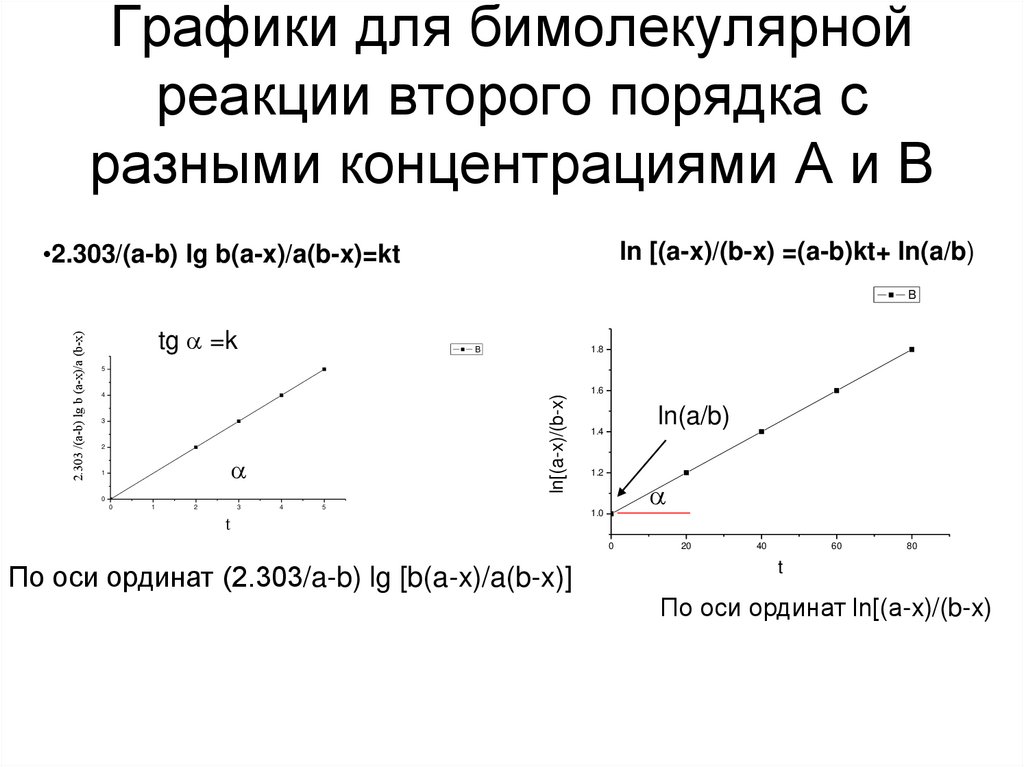
26. Графики для бимолекулярной реакции второго порядка с разными концентрациями А и В
•2.303/(a-b) lg b(a-x)/a(b-x)=ktln [(a-x)/(b-x) =(a-b)kt+ ln(a/b)
tg =k
1.8
B
5
4
ln[(a-x)/(b-x)
2.303 /(a-b) lg b (a-x)/a (b-x)
B
3
2
1
1.6
ln(a/b)
1.4
1.2
0
0
1
2
3
4
5
t
1.0
0
По оси ординат (2.303/a-b) lg [b(a-x)/a(b-x)]
20
40
60
80
t
По оси ординат ln[(a-x)/(b-x)
27. Размерность константы скорости бимолекулярной реакции v= k[A][B]
• kМ-1 мин-1 или М-1 с-1
• v
(моль/ л c, моль/л мин)
• Размерность концентраций моль/л
• Для вычисления константы скорости
бимолекулярной реакции необходимо знать
начальные концентрации реагирующих
веществ, убыль одного из них к моменту
времени t и время t.
28.
• Для реакций, когда [B]>>[A] можносчитать, что концентрация вещества В в
ходе реакции остается постоянной и
тогда
• v=k*[A], где k*=k[B]
• Мы имеем псевдомономолекулярную
реакцию
29.
• Констатна скоростипсевдомономолекулярной реакции
определяется как и константа скорости
истинной мономолекулярной реакции первого
порядка, но она представляет собой не
истинную, а кажущуюся константу скорости
реакции.
• Для нахождения истинной константы надо
полученную экспериментальную величину k*
• разделить на концентрацию вещества В
• k= k* /[B]
30. Реакции n порядка
nA=P
v=k[A]n
V0 = -dA/dt=kc0n
с0- концентрация вещества А в
начальный момент (начальная
концентрация )
31.
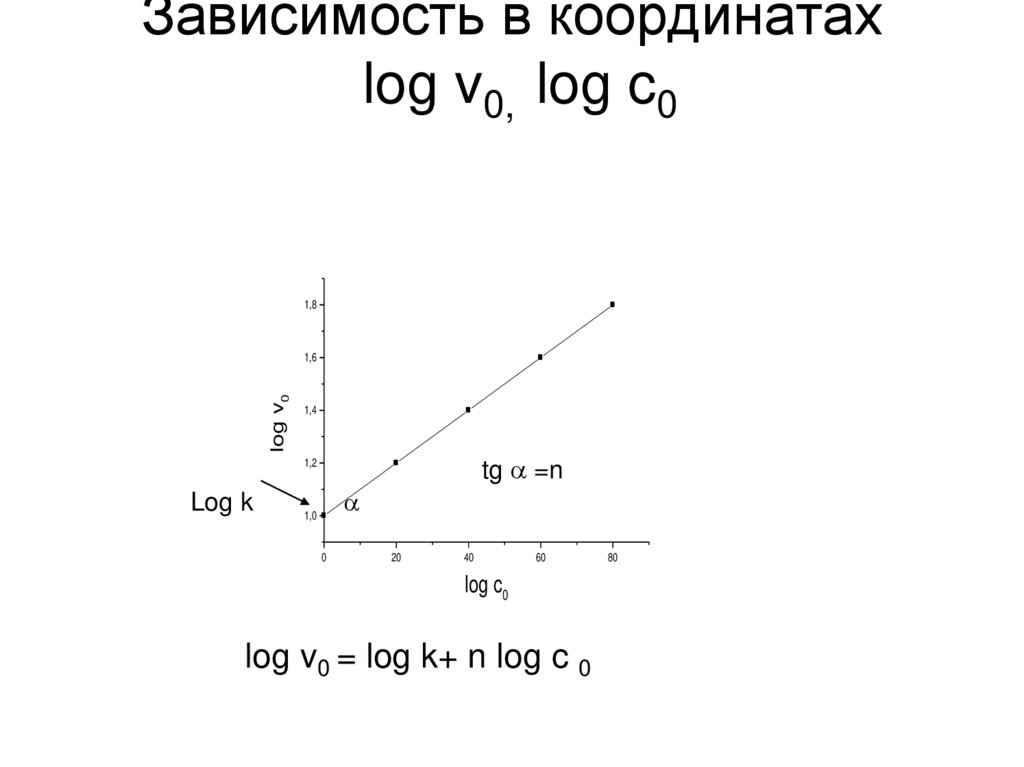
32. Зависимость в координатах log v0, log c0
1,8log v0
1,6
1,4
tg =n
1,2
Log k
1,0
0
20
40
60
log c0
log v0 = log k+ n log c 0
80
33.
34. Решение
35. Характеристики реакций простых порядков: резюме
• График зависимости концентрации отвремени дает ключ к порядку реакции.
• Если зависимость линейная, реакция имеет
нулевой порядок.
• Если графические результаты дают
изогнутые кривые, можно построить другие
зависимости, например, log a от времени или
1/а от времени. Ищите линейную
зависимость, наклон которой
пропорционален константе скорости.
• (слайд 10, 21)
36.
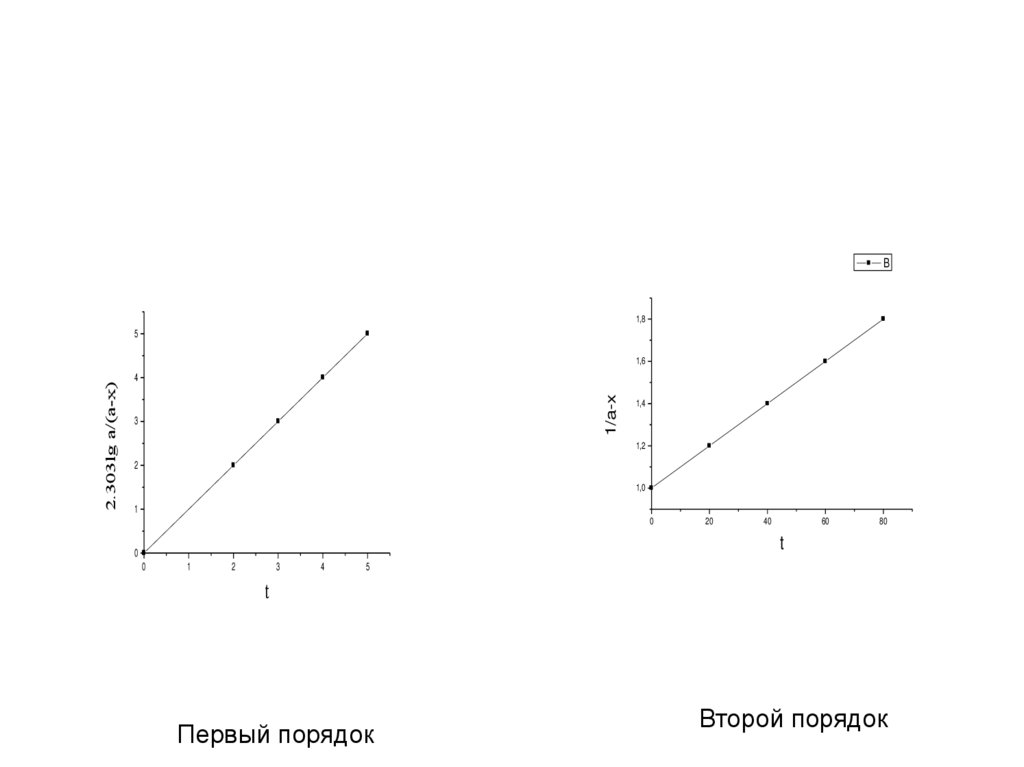
B1,8
5
1/a-x
2.303lg a/(a-x)
1,6
4
3
1,4
1,2
2
1,0
1
0
20
40
60
80
t
0
0
1
3
2
4
5
t
Первый порядок
Второй порядок




![Интегрирование этого выражения дает -ln [A]=kt+C, Интегрирование этого выражения дает -ln [A]=kt+C,](https://cf3.ppt-online.org/files3/slide/e/e52fwCui41PmbXIRpYtTySjqZrvAxLlW0n8dcK/slide-4.jpg)



![k=2,303/t lg[A]0/[A]t размерность константы скорости первого порядка c-1, мин-1 k=2,303/t lg[A]0/[A]t размерность константы скорости первого порядка c-1, мин-1](https://cf3.ppt-online.org/files3/slide/e/e52fwCui41PmbXIRpYtTySjqZrvAxLlW0n8dcK/slide-10.jpg)

![k=2,303/t lg[A]0/[A]t k=2,303/t lg[A]0/[A]t](https://cf3.ppt-online.org/files3/slide/e/e52fwCui41PmbXIRpYtTySjqZrvAxLlW0n8dcK/slide-12.jpg)









![Размерность константы скорости бимолекулярной реакции v= k[A][B] Размерность константы скорости бимолекулярной реакции v= k[A][B]](https://cf3.ppt-online.org/files3/slide/e/e52fwCui41PmbXIRpYtTySjqZrvAxLlW0n8dcK/slide-26.jpg)






 chemistry
chemistry








