Similar presentations:
Кислоты
1. КИСЛОТЫ
ГАПОУ СО «ГАЭмТ »КИСЛОТЫ
Н+
Н+
Н+
Н+
Н+
Н+
2. ВЕК ЖИВИ- ВЕК УЧИСЬ
«Сами трудясь, вы многое сделаете для себя идля близких, а если при труде успеха не будет,
будет неудача, не беда – попробуйте ещё»
Д.И. Менделеев
Остальные важные свойства
кислот представлены в
приложенном файле
«Опорный конспект
кислоты»
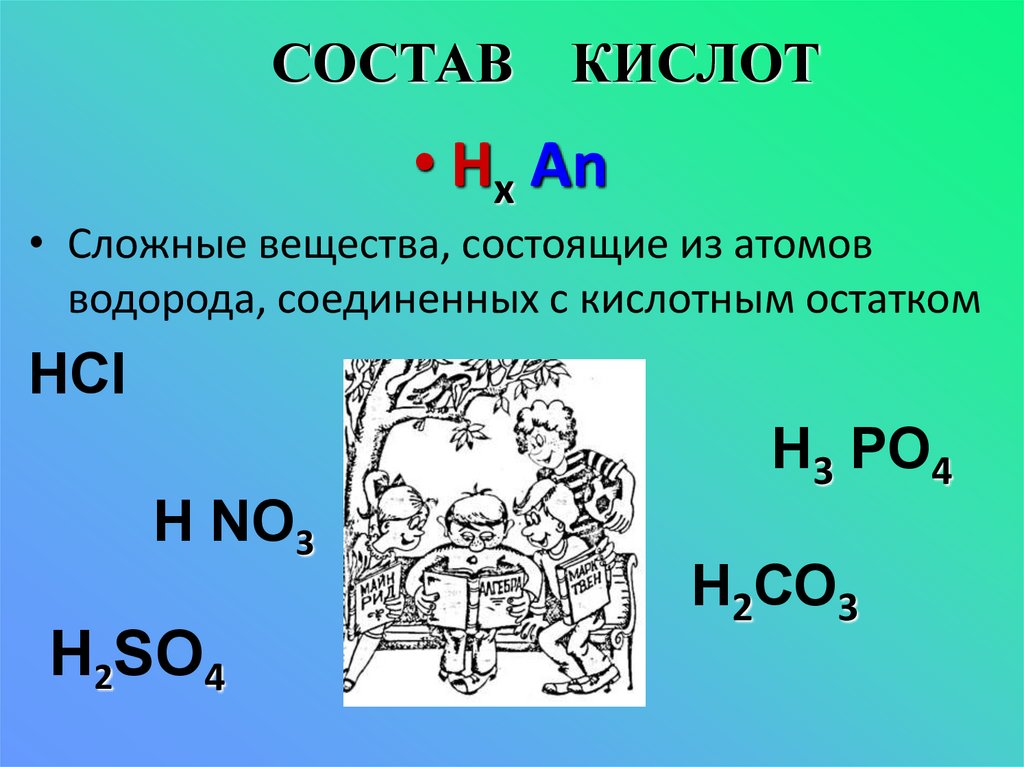
3. СОСТАВ КИСЛОТ
• Hх Аn• Сложные вещества, состоящие из атомов
водорода, соединенных с кислотным остатком
НСI
Н NО3
Н2SО4
Н3 РО4
Н2СО3
4. КИСЛОТЫ - это вкусно
5. КИСЛОТЫ – это важно
Объём продукции желудочного сокаСоляная кислота HCl
В сутки в желудке взрослого человека
вырабатывается около 2 л желудочного
сока.
Базальная (то есть в состоянии покоя,
не стимулированная пищей,
химическим стимуляторами и т.п.)
секреция у мужчин составляет (у
женщин на 25—30 % меньше):
желудочного сока — 80—100 мл/ч;
соляной кислоты — 2,5—5,0 ммоль/ч;
пепсина — 20—35 мг/ч.
Максимальная продукция соляной
кислоты у мужчин 22—29 ммоль/ч, у
женщин — 16—21 ммоль/ч.
6. КИСЛОТЫ – это опасно
КИСЛОТЫ — едкие вещества, при попаданиина кожу вызывает сильные химические ожоги.
Особенно опасно попадание в глаза. Они
поражают кожу, слизистые оболочки,
дыхательные пути
7. КЛАССИФИКАЦИЯ
Признакиклассификации
Группы кислот
Примеры
Наличие кислорода А) кислородные
в кислотном остатке Б) бескислородные
А) H3PO4, H2SO4
Б) HBr, H2S
Основность
А) одноосновные
Б) многоосновные
А) HNO3, HCl
Б) H2SO4, H3PO4
Растворимость в
воде
А) растворимые
Б) нерастворимые
А) HNO3, HCl
Б) H2SiO3
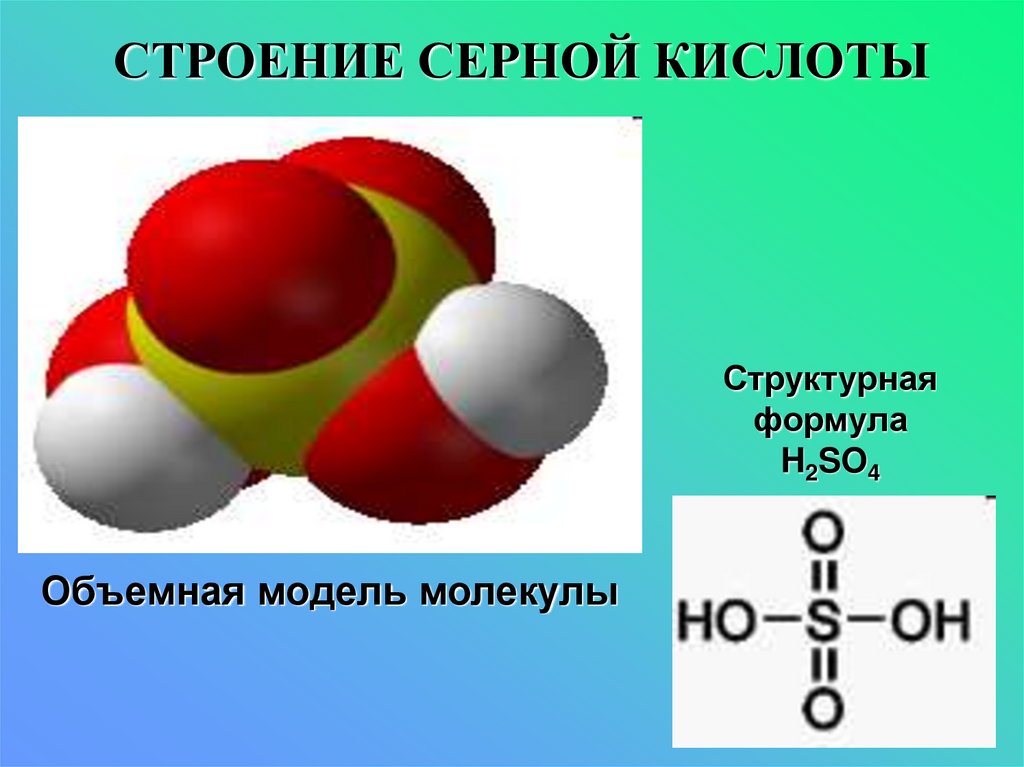
8. СТРОЕНИЕ СЕРНОЙ КИСЛОТЫ
Структурнаяформула
H2SO4
Объемная модель молекулы
9. ХИМИЧЕСКИЕ СВОЙСВА
1. кислота + металл (стоящий до водорода вЭХР напряжений)
2HCl + Mg →MgCl2 + H2
2. кислота + основный оксид
2HCl + MgO → MgCl2 + H2O
3. кислота + основание
HCl + NaOH → NaCl + H2O
4. кислота + соль
HCl +AgNO3 → AgCl + HNO3
10. Взаимодействие кислот с индикаторами
11. ВЗАИМОДЕЙСТВИЕ С ИНДИКАТОРАМИ
ИндикаторНейтральная
среда
Кислая среда
Лакмус
Фиолетовый
Красный
Фенолфталеин
Бесцветный
Бесцветный
Метиловый
оранжевый
Оранжевый
Розовый
Помни! Нерастворимые кислоты не меняют
окраску индикаторов
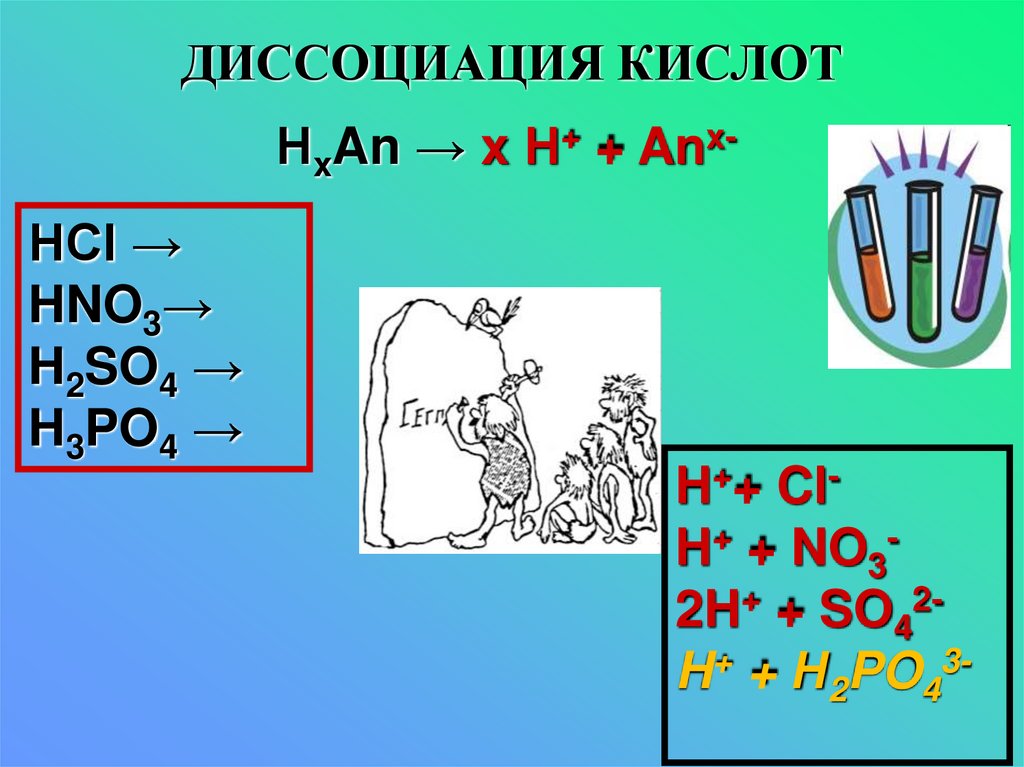
12. ДИССОЦИАЦИЯ КИСЛОТ
НxAn → x Н+ + AnxHCl →HNO3→
H2SO4 →
H3PO4 →
H++ ClH+ + NO32H+ + SO42H+ + Н2PO43-
13. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С Ме
МЕТАЛЛ + КИСЛОТА→СОЛЬ + ВОДОРОДлевее
Pb + H2SO4 →Х
???
14. ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ
ОСНОВНЫЙ ОКСИД + КИСЛОТА → СОЛЬ + ВОДА15. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ
ОСНОВАНИЕ + КИСЛОТА → СОЛЬ + ВОДАРеакция между основанием и кислотой с образованием
соли и воды называется реакцией нейтрализации
16. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ
СОЛЬ + КИСЛОТА → НОВАЯ КИСЛОТА + НОВАЯ СОЛЬРеакция возможна, ЕСЛИ образуется
↓ или ↑
17. ХИМИЧЕСКИЕ СВОЙСТВА
18. О КИСЛОТНЫХ ДОЖДЯХ
• Оксиды азота, серы содержатся ввыхлопных газах реактивных двигателей и
двигателей внутреннего сгорания,
отработанных газах металлургических и
химических предприятий,
теплоэлектростанций, которые неизбежно
превращаются в кислоты и выпадают нам
на голову в виде кислотных дождей
19.
О КИСЛОТНЫХ ДОЖДЯХ• Кислотные дожди виноваты в исчезновении
рыбы во многих реках и озёрах, так как рыба не
выдерживает кислой воды
• Такие дожди вымывают из почвы питательные
вещества, без которых растениям грозит
голодная смерть
• Многие растения погибают, если увеличивается
кислотность почвы. Оксид серы, кроме того,
прямо повреждает зелень
20. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
• Диссоциация• Взаимодействие с
индикаторами
• Взаимодействие с металлами
• Взаимодействие с основными
оксидами
• Взаимодействие с основаниями
• Взаимодействие с солями
21. Какое свойство кислот?
Кислота, когда здорова,Угостить друзей готова
Тем, что ей дала природа Катионом водорода!
22. ОТ ПЕРЕМЕНЫ МЕСТ СЛАГАЕМЫХ…?
23. В заключении - тест
1. Узнал много нового.2. Мне это пригодится в
жизни.
3. Было над чем подумать.
4. На возникшие вопросы я
получил ответ.
5. Поработал добросовестно,
цель достигнута.





















 chemistry
chemistry








