Similar presentations:
Алюминий
1.
Впервые алюминий был открыт в1825 г. датским физиком
Х.К. Эрстедом, основоположником
учения о электромагнетизме.
Х.К. Эрстед
1777–1851 гг.
2.
Выделил металлический алюминийиным и более эффективным методом:
нагреванием безводного хлорида
алюминия не с амальгамой калия, а
просто с металлическим калием.
Ф. Вёлер
1800–1882 гг.
3.
Разработал другой химический процессполучения алюминия: хлористый
алюминий нагревали с натрием,
который вытеснял алюминий из соли,
заставляя его выделяться в виде
небольших корольков.
Анри Сент-Клер Девиль
1811–1881 гг.
4.
5.
Название элемента образовано отлатинского alumen — квасцы.
Данный элемент носил несколько
названий. Так, Дэви, предполагая
присутствие его в глинозёме, называл
его алюмиумом или алюминумом.
В русской химической литературе 19
века встречаются следующие названия
алюминия: глинозём, алумий, алюминий
и глиний.
6.
До открытия промышленногоспособа получения алюминия этот
металл был дороже золота.
В 1889 г. британцы, желая
почтить богатым подарком великого
русского химика Д.И. Менделеева,
подарили ему весы из золота и
алюминия.
7.
Физические свойства алюминияMaterialscientist
8.
Физические свойства алюминияАлюмосиликаты
Бокситы
9.
10.
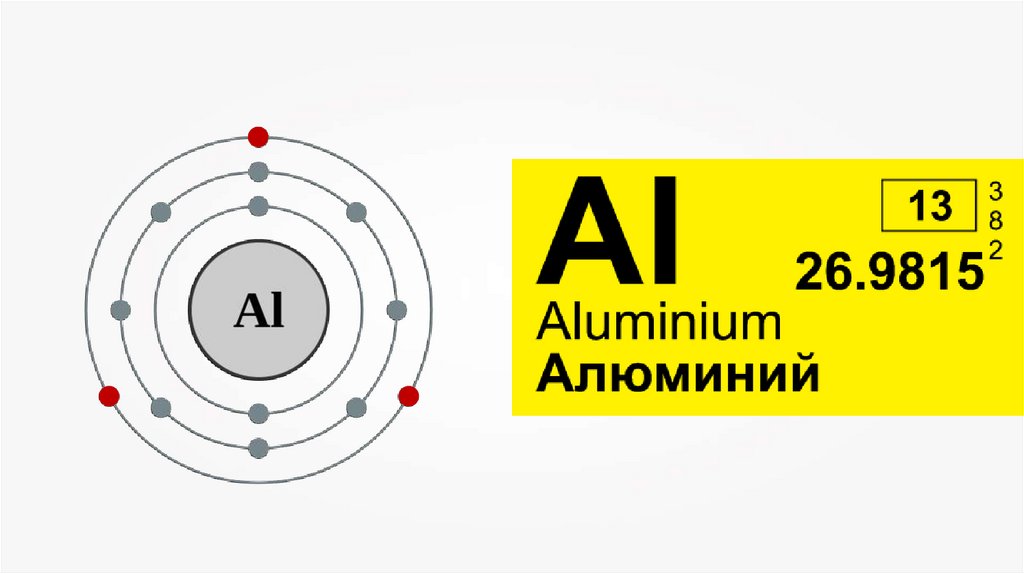
Температура плавления алюминиядовольно низкая (660 °C).
Алюминий — хороший проводник
теплоты и электрического тока.
Имеет высокую пластичность, в
следствие чего легко вытягивается в
проволоку и прокатывается в фольгу до
0,001 мм.
11.
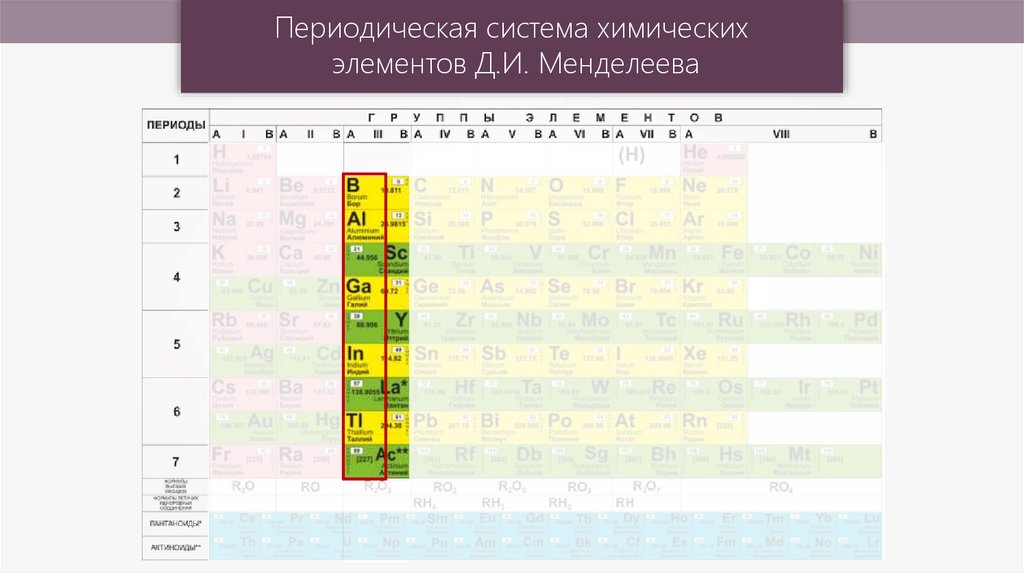
Периодическая система химическихэлементов Д.И. Менделеева
12.
13.
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H, Cu, Hg, Ag, AuВ электрохимическом ряду напряжений
металлов алюминий близок к щелочным
и щёлочноземельным металлам и проявляет
себя как химически активный металл.
14.
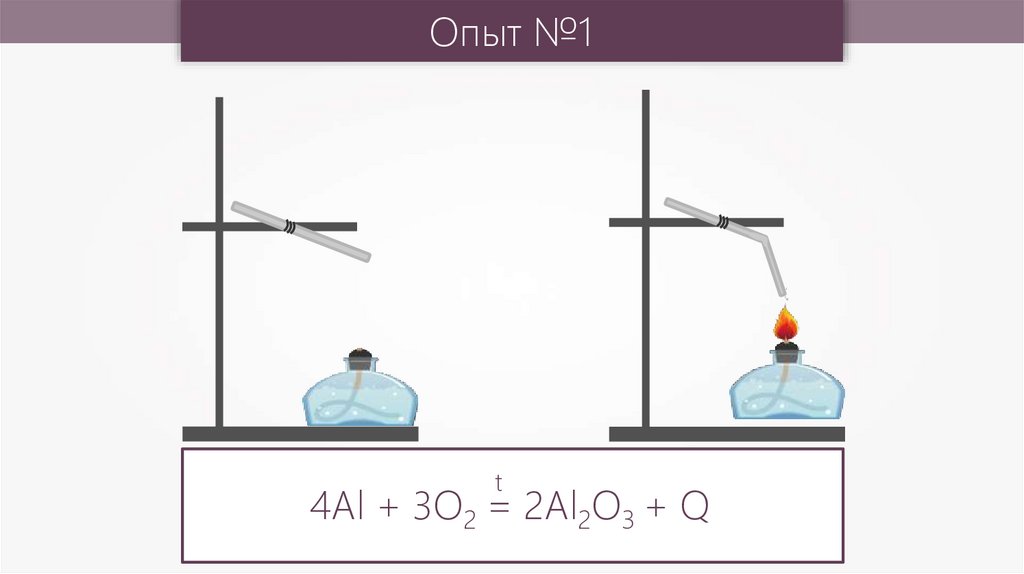
Опыт №1t
4Al + 3O2 = 2Al2O3 + Q
15.
Алюминий легко реагирует снеметаллами, реакции проходят
бурно с выделением большого
количества теплоты, но для начала
реакции необходимо нагреть
элементы (исключение составляют
галогены — хлор и бром).
16.
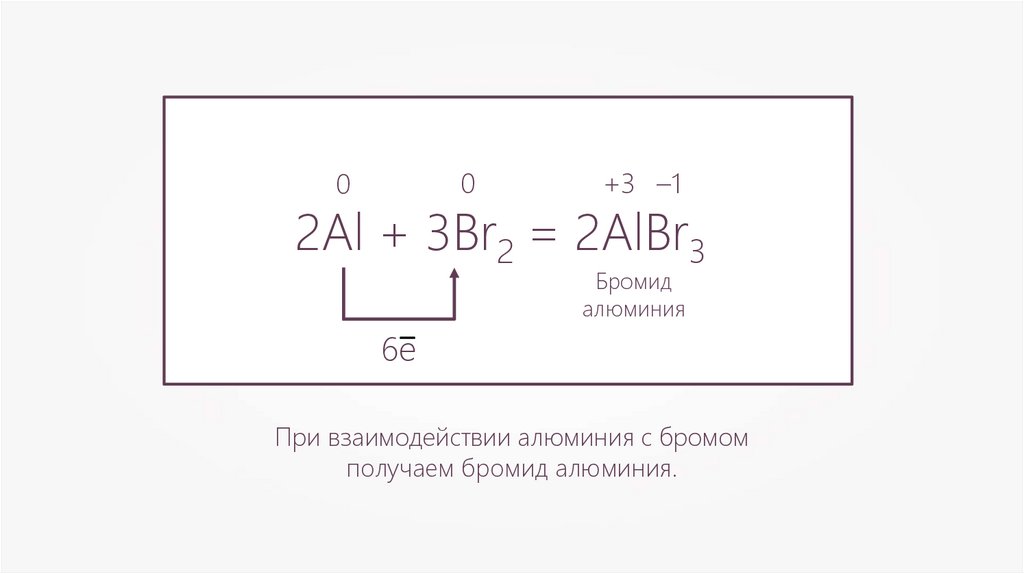
00
+3 –1
2Al + 3Br2 = 2AlBr3
6e–
Бромид
алюминия
При взаимодействии алюминия с бромом
получаем бромид алюминия.
17.
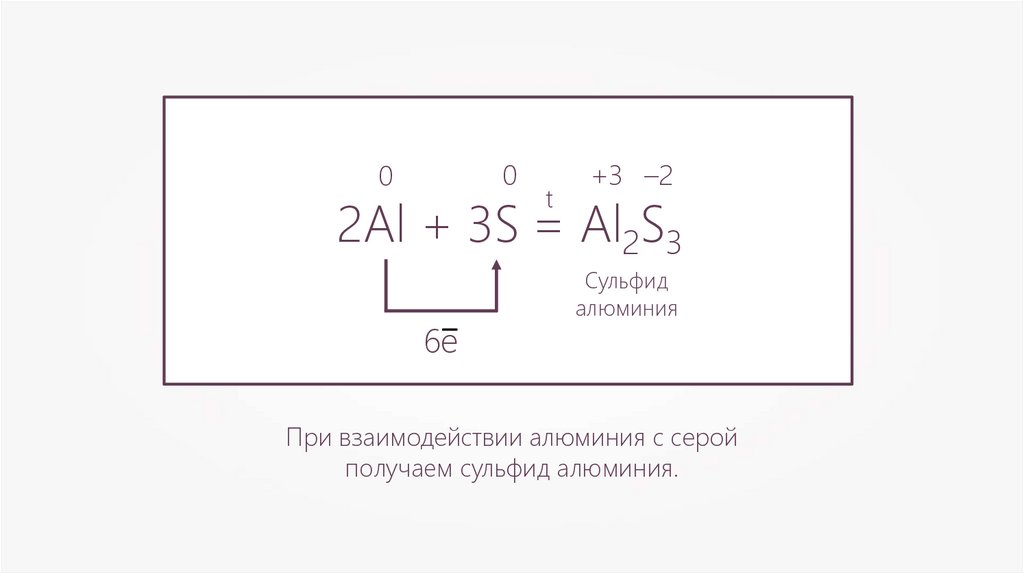
00
t
+3 –2
2Al + 3S = Al2S3
6e–
Сульфид
алюминия
При взаимодействии алюминия с серой
получаем сульфид алюминия.
18.
00
t
+3 –4
4Al + 3С = Al4С3
–
12e
Карбид
алюминия
При взаимодействии алюминия с
углеродом образуется карбид алюминия.
19.
Реакция алюминия с водой2Al + 6H2O = 2Al(OH)3 + 3H2
20.
Реакция алюминия со щелочами2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
21.
Опыт №22Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4(разб.)= Al2(SO4)3 + 3H2↑
22.
С концентрированной азотной исерной кислотой алюминий при
обычной температуре не
реагирует.
Поэтому их кислоту можно
перевозить в алюминиевых
цистернах.
23.
Метод алюминотермииt
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
24.
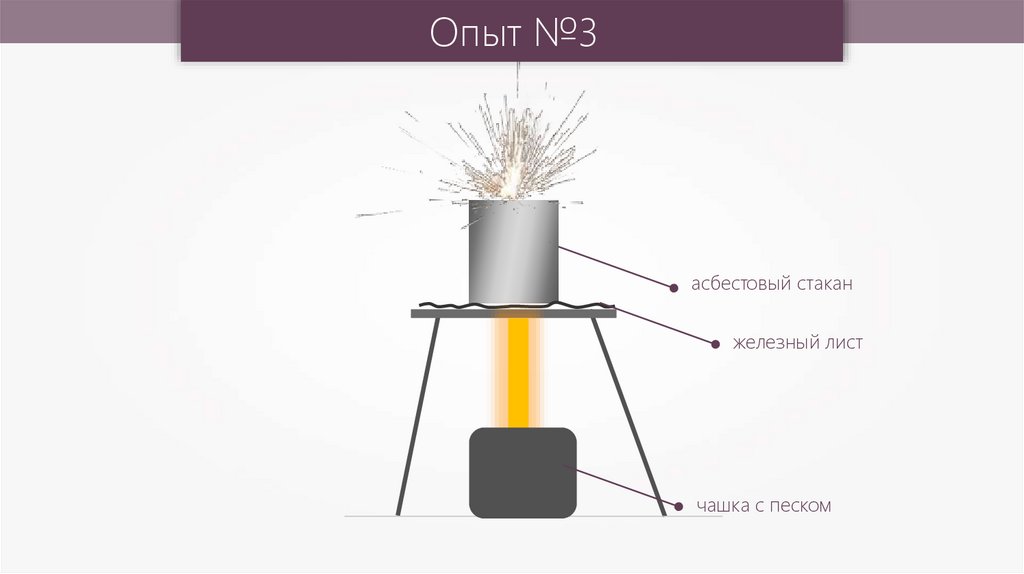
Опыт №3асбестовый стакан
железный лист
чашка с песком
25.
Амфотерный характер оксидаалюминия и особенности свойств
соединения показывают, что
металлические свойства у алюминия
выражены несколько слабее, чем у
таких типичных металлов, как
щелочные и щёлочноземельные.
26.
Оксид алюминияAl2O3
27.
Корунд28.
Al2O3+6HCl=2AlCl3+3H2OОксид алюминия не растворяется в воде и не реагирует с
ней. Оксид алюминия амфотерен.
По отношению к кислотам он ведет себя как основный оксид:
растворяется в растворах кислот с образованием солей.
29.
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]Тетрагидроксоалюминат натрия
По отношению к щелочам оксид
алюминия ведет себя как кислотный оксид.
30.
Гидроксид алюминияAl(OH)3
31.
Получение гидроксида алюминияAlCl3+3NaOH=Al(OH)3+3NaCl
32.
Al(OH)3 + 3HCl = AlCl3 + 3H2OЕсли на гидроксид алюминия подействовать какой-либо
кислотой, например, соляной, то осадок исчезнет и
получится прозрачный раствор: происходит реакция с
образованием растворимой в воде соли алюминия и воды.
33.
Алюминий в природе34.
По распространённости вземной коре среди металлов
занимает первое место и
третье место после
кислорода и водорода
среди всех элементов.
Materialscientist
35.
Природные соединения, содержащие алюминийАлюмосиликаты
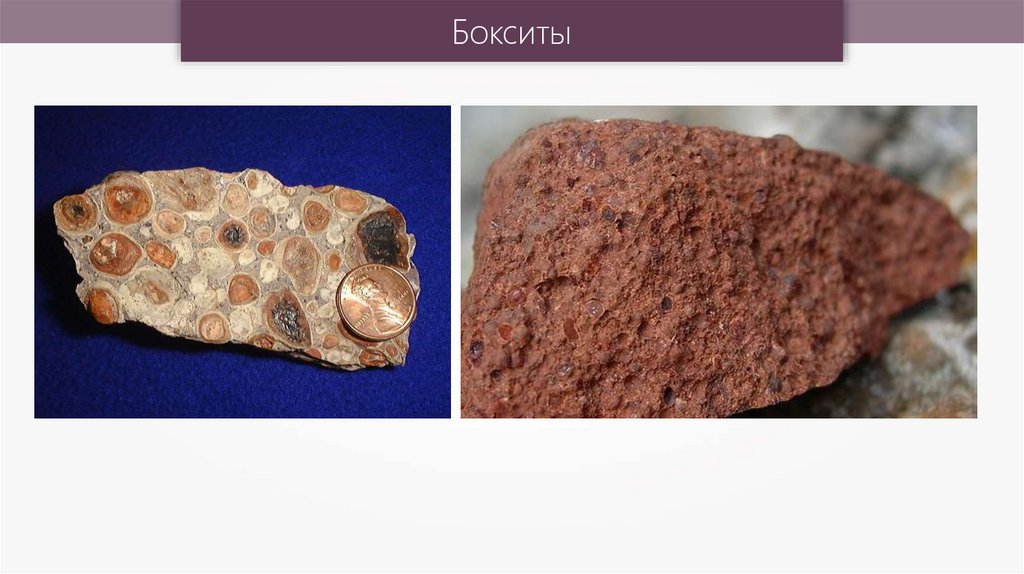
Бокситы
36.
АлюмосиликатыЭти соединения можно
рассматривать как соли,
образованные оксидами
алюминия, кремния,
щелочных и
щёлочноземельных
металлов.
37.
Бокситы38.
Применение алюминия39.
40.
41.
42.
Высокая электрическаяпроводимость чистого
алюминия используется в
электротехнике.







































 chemistry
chemistry








