Similar presentations:
Алюминий, его соединения
1.
Алюминий,его соединения
2.
Я металл, серебристый и лёгкий,И зовусь самолётный металл,
И покрыт я оксидною плёнкой
Чтоб меня кислород не достал.
Алюминий
3.
4.
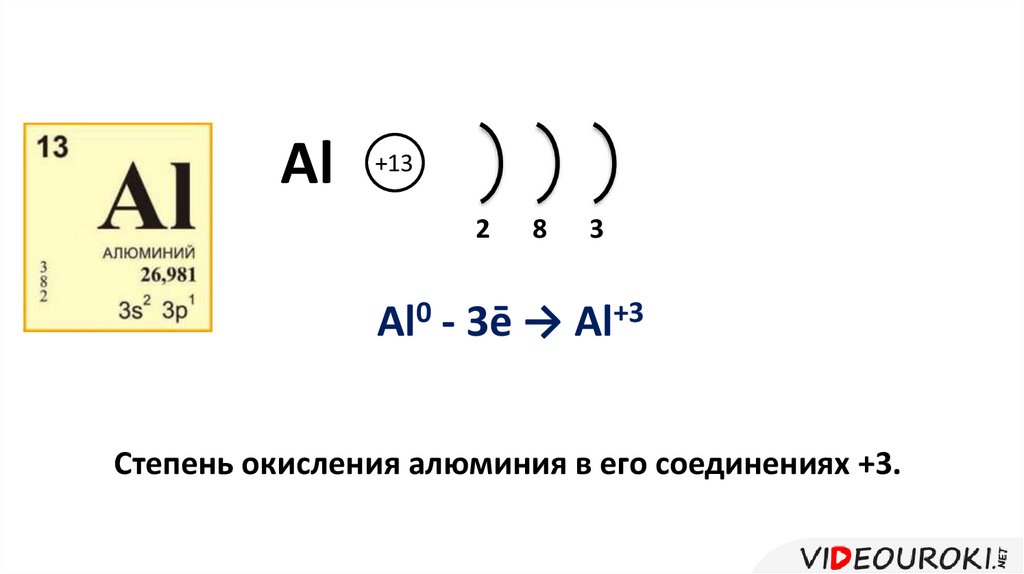
Al+13
2
8
3
Al0 - 3ē → Al+3
Степень окисления алюминия в его соединениях +3.
5.
6.
7.
8.
Алюминий представляет собой серебристо-белый металл.Лёгкий (ρ=2,7г/см3) и мягкий.
Плавится при температуре 660 0С.
Он очень пластичный и легко вытягивается в проволоку и
прокатывается в фольгу.
Алюминий обладает большой электро- и
теплопроводностью.
Для алюминия характерна высокая упругость.
9.
Нахождение алюминия в природеВ земной коре содержится
8,8 % алюминия.
Алюминий занимает
3 место по
распространённости
среди других элементов.
10.
Соединения алюминияАлюмосиликаты
Бокситы
Корунд (Al2O3)
11.
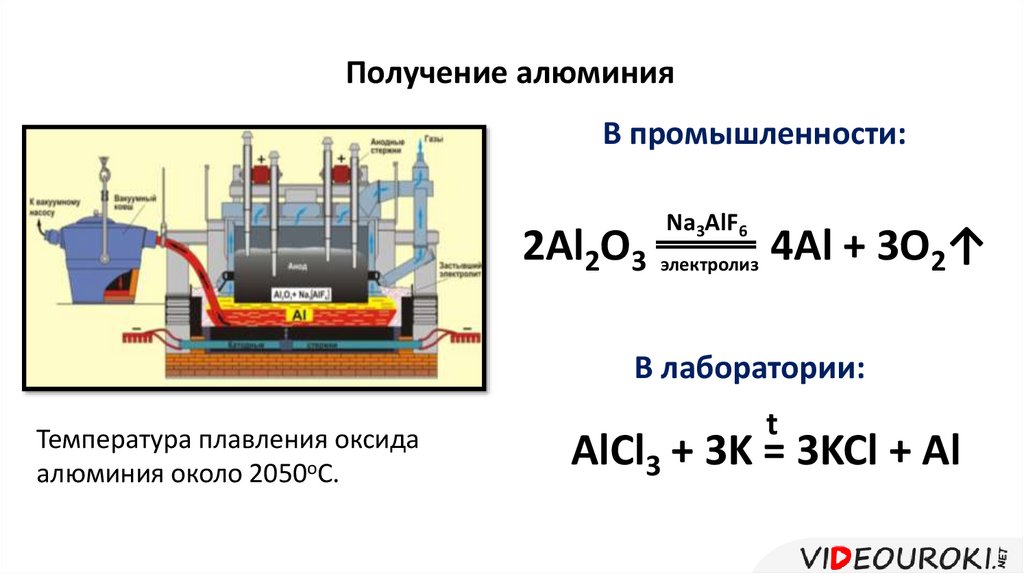
Получение алюминияВ промышленности:
2Al2O3
Na3AlF6
электролиз
4Al + 3O2↑
В лаборатории:
Температура плавления оксида
алюминия около 2050оС.
t
AlCl3 + 3K = 3KCl + Al
12.
По объёму производства алюминийзанимает 2 место после железа и его
сплавов (среди металлов).
Для выплавки 1т алюминия требуется
13-17000 квт/час электрической
энергии (постоянный ток, V=5в,
I=100000А).
13.
Алюминий – активный металл.Алюминий покрыт прочной и тонкой плёнкой оксида.
Механически разрушить плёнку сложно.
Амальгамированный алюминий – соединение алюминия с
ртутью.
14.
Химические свойстваРеакция с кислородом
0
12 ē
0
+3 -2
4Al + 3O2 =t 2Al2O3
Аl – восстановитель
O2 – окислитель
оксид
алюминия
15.
16.
Реакции с неметаллами0
6ē
+3 -1
0
2Al +3Cl2 = 2AlCl3
хлорид
алюминия
0
2ē
0
t
+3 -3
2Al + N2 = 2AlN
нитрид
алюминия
0
6ē
0 t +3 -2
2Al + 3S = Al2S3
сульфид
алюминия
Аl – восстановитель
Неметаллы – окислители
17.
Химические свойстваРеакция с йодом
2Al + 3I2 = 2AlI3
йодид
алюминия
18.
Химические свойстваРеакция с водой
0
+1
+3
0
2Al + 6HOH = 2Al(OH)3 + 3H2↑
Восст-ль Ок-ль
Аl – активный металл
19.
Химические свойстваРеакции с растворами кислот
0
+1
+3
0
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Восст-ль Ок-ль
0
+1
сульфат
алюминия
+3
0
2Al + 6HCl = 2AlCl3 + 3H2↑
Восст-ль Ок-ль
хлорид
алюминия
20.
Концентрированные серная и азотная кислотыпассивируют поверхность алюминия.
21.
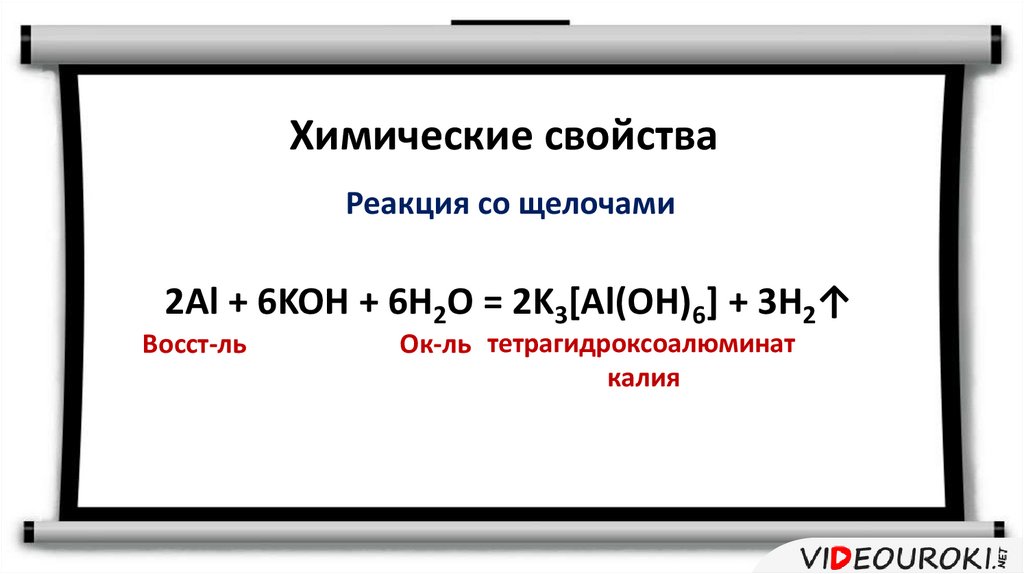
Химические свойстваРеакция со щелочами
2Al + 6KOH + 6H2O = 2K3[Al(OH)6] + 3H2↑
Восст-ль
Ок-ль тетрагидроксоалюминат
калия
22.
Алюминий является активным металлом.Алюминий реагирует с простыми веществами –
неметаллами.
Восстанавливает металлы до свободного состояния,
стоящие в электрохимическом ряду напряжения справа
от него.
Из сложных соединений алюминий восстанавливает
ионы водорода и ионы менее активных металлов.
При комнатной температуре на воздухе алюминий не
изменяется, так как покрыт защитной оксидной
пленкой.
23.
Al2O3Белое, твёрдое вещество
Оксид алюминия огнеупорен
Широко распространён в природе
Является абразивным
материалом
Имеет высокую температуру
плавления
Нерастворим в воде
Обладает инертностью при
обычных условиях
С кислотами, щелочами и
оксидами реагирует при t
24.
tAl2O3 + 2KOH = 2KAlO2 + H2O
t
метаалюминат
калия
Al2O3 + CaO = Ca(AlO2)2
метаалюминат
кальция
t
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4]
t
тетрагидроксоалюминат
калия
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
cульфат алюминия
25.
Получение оксида алюминияt
2Al(OH)3 = Al2O3 + 3H2O
26.
Al(OH)3Обладает амфотерными свойствами
Получают осаждением из растворимых
солей алюминия действием щелочей
Реагирует с кислотами и щелочами
27.
Химические свойствагидроксида алюминия
Как основание
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Как кислота
Al(OH)3 + NaOH = Na[Al(OH)4]
28.
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaClAl3+ + 3OH- = Al(OH)3↓
29.
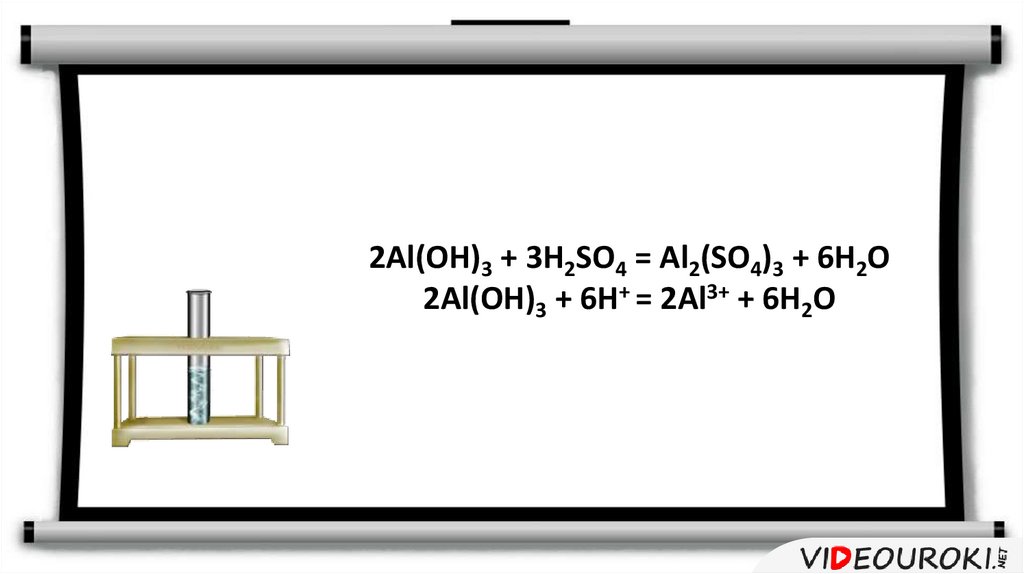
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O2Al(OH)3 + 6H+ = 2Al3+ + 6H2O
30.
Al(OH)3 + NaOH = Na[Al(OH)4]Al(OH)3 + OH- = [Al(OH)4]-
31.
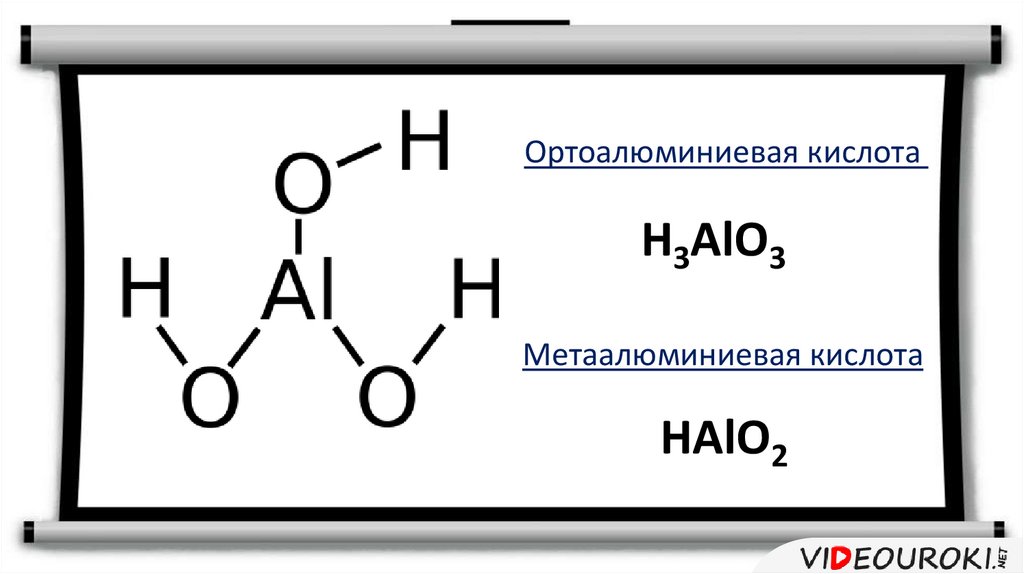
Ортоалюминиевая кислотаH3AlO3
Метаалюминиевая кислота
HАlO2
32.
Благородная шпинельДрагоценный хризоберилл
33.
Соли алюминияВсе соли алюминия, кроме фосфатов,
хорошо растворимы в воде
Некоторые соли, такие как сульфиды,
сульфиты разлагаются водой
Хлорид алюминия, применяется как
катализатор
34.
Оксид алюминия при обычных условиях являетсядостаточно инертным веществом и широко
распространен в природе.
Гидроксид алюминия получают из растворимых солей
алюминия действием щелочей.
Гидроксид алюминия взаимодействует как с кислотами,
так и со щелочами, образуя растворимые соли,
следовательно проявляет амфотерные свойства.
35.
AlAl
Al
Al
1. Алюминий — самый распространённый металл в
земной коре.
2. Обладает высокой коррозионной стойкостью и
малой плотностью.
3. Сплавы на основе алюминия обладают
прочностью.
4. Для алюминия характерна высокая
электропроводность и теплопроводность.
36.
Al37.
Al38.
Al39.
AlAl
Al
Al
Алюминий — самый распространённый металл в
природе.
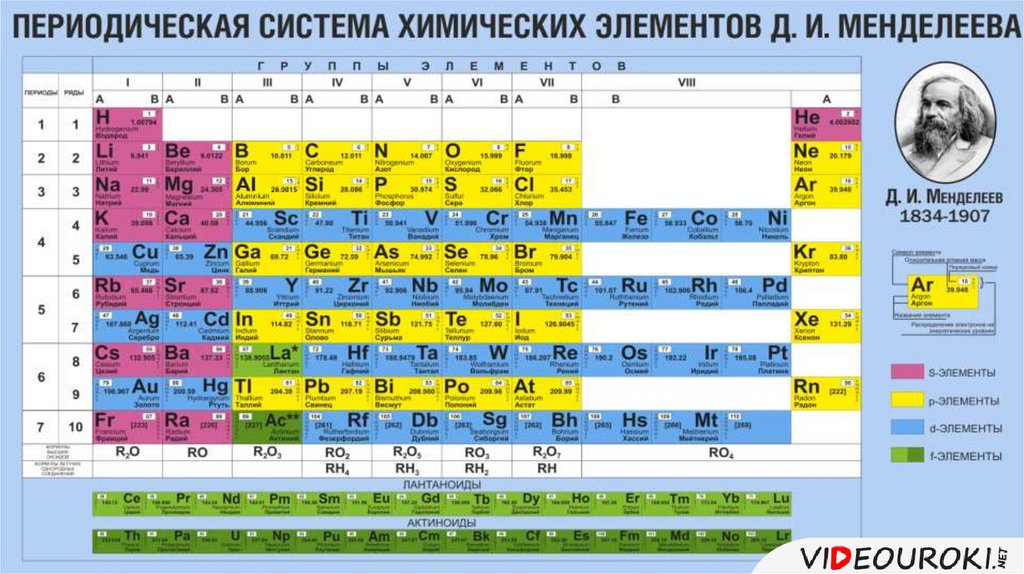
Он расположен в 3 периоде IIIA группы, имеет
степень окисления +3.
В природе встречается только в виде соединений.
По физическим свойствам – типичный
металл.
40.
AlАлюминий химически очень активный.
Al
Реагирует с кислотами и щелочами.
Al
Al
Алюминий, оксид алюминия и гидроксид алюминия
проявляют амфотерные свойства.
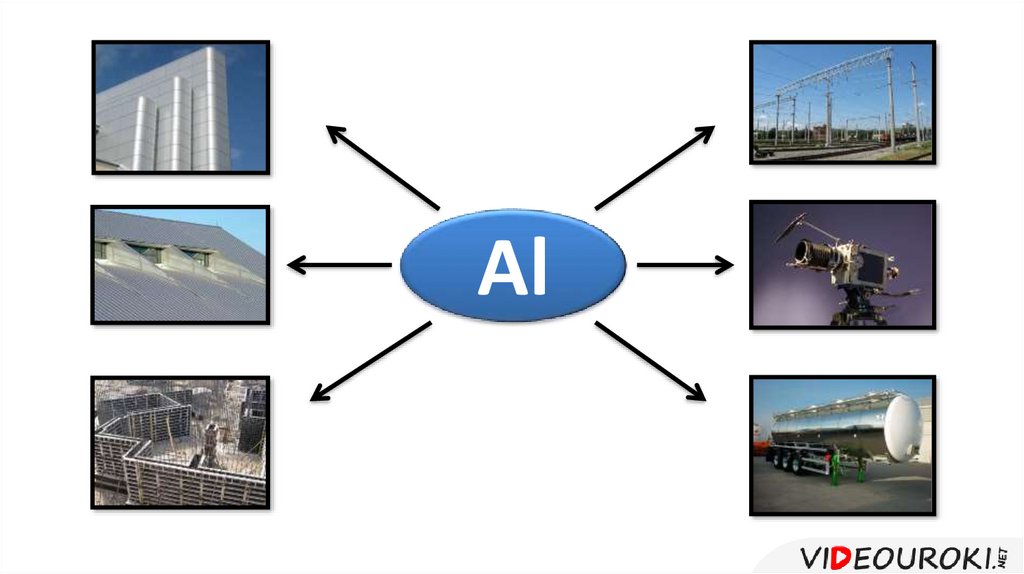
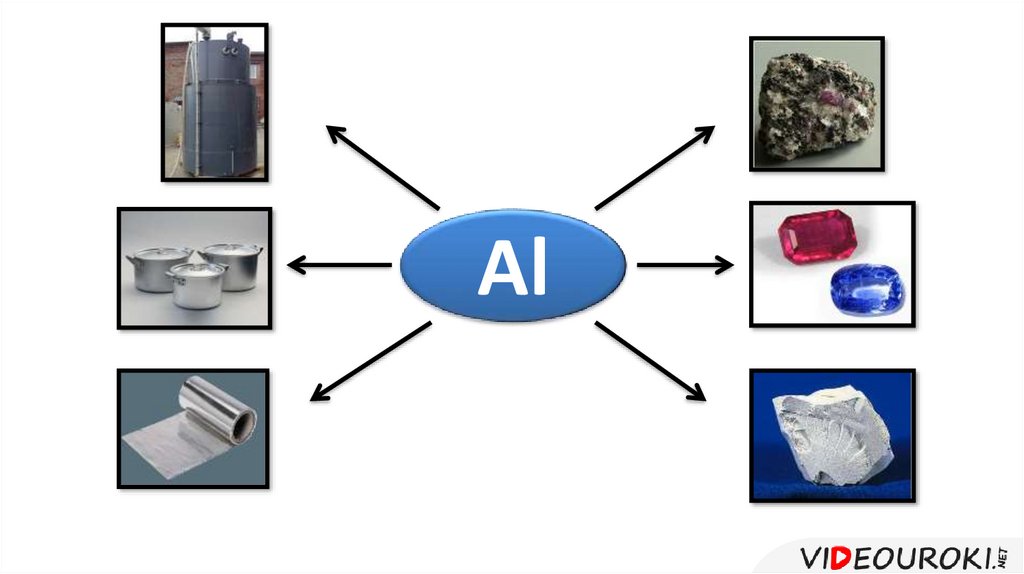
Алюминий и его сплавы находят широкое
распространение в промышленности и
быту.






























 chemistry
chemistry








