Similar presentations:
Алюминий и его соединения
1.
2.
3.
4.
5.
План:1. Характеристика алюминия как
химического элемента.
2. Распространение и роль алюминия в
природе.
3. Физические свойства алюминия.
4. Химические свойства алюминия.
5. Важнейшие соединения алюминия и
их свойства
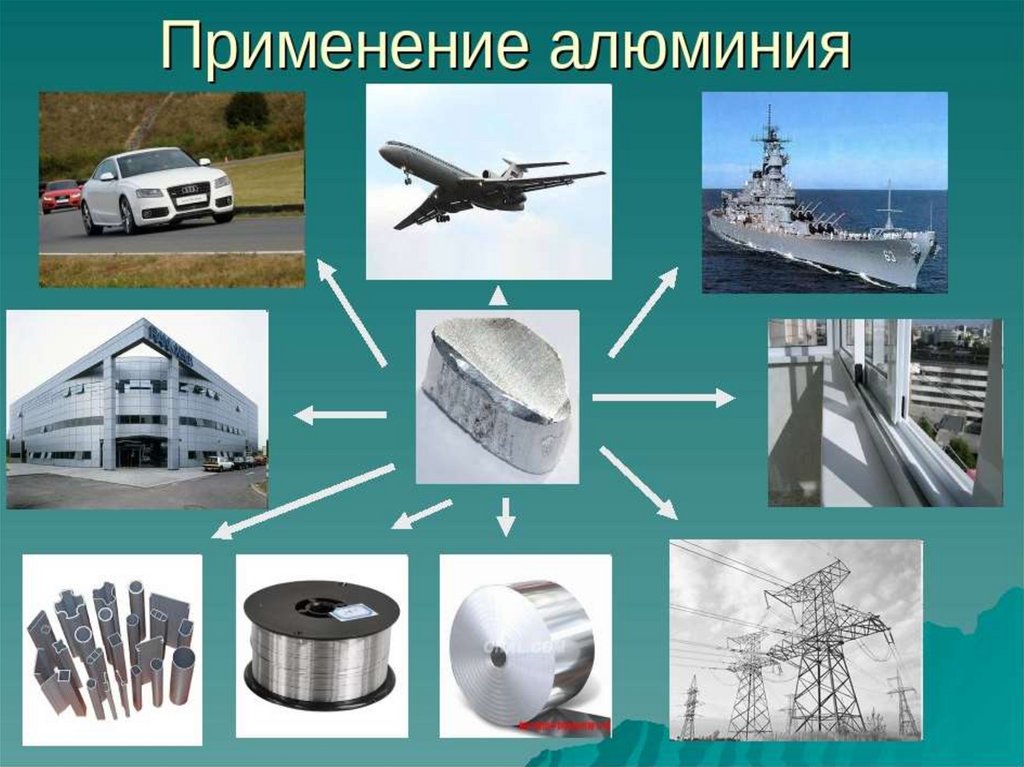
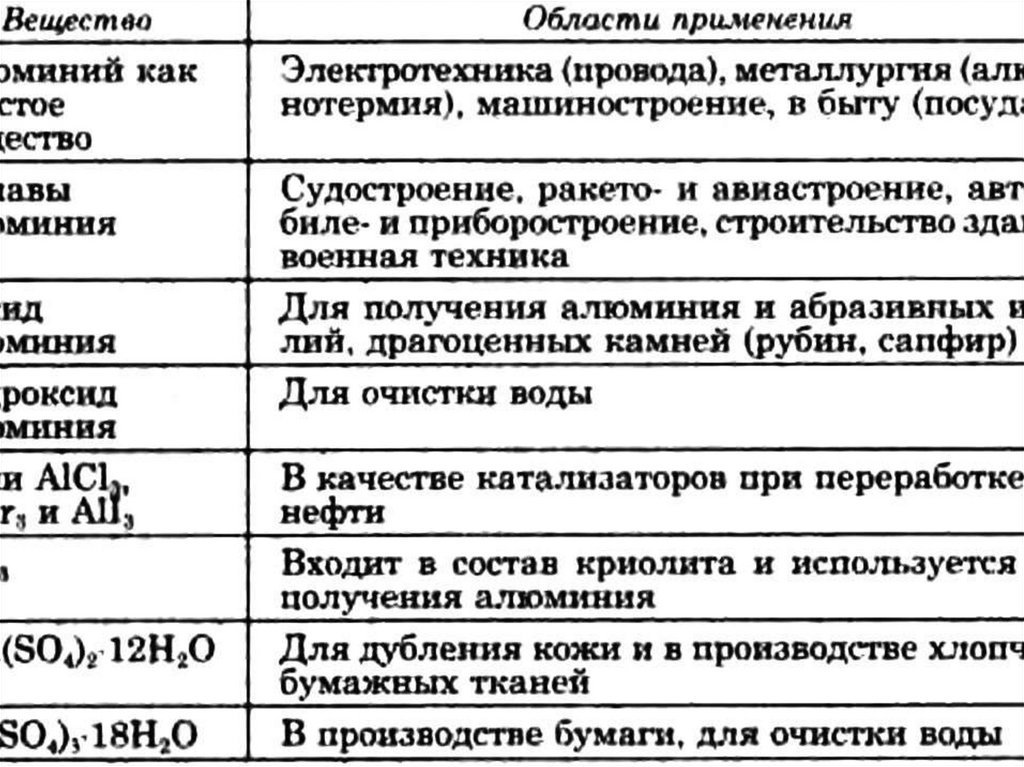
6. Алюминий, его соединения и сплавы в
жизни человека.
6.
Вставьте пропущенные словаглавная
1. Алюминий - элемент III группы, главной подгруппы.
2. Заряд ядра атома алюминия равен +13.
3. В ядре атома алюминия 13 протонов.
4. В ядре атома алюминия 14 нейтронов.
5. В атоме алюминия 13 электронов.
6. Атом алюминия имеет 3 энергетических уровня.
7. Электронная оболочка имеет строение 2е, 8е, 3е.
8. На внешнем уровне в атоме 3 электронов.
9. Степень окисления атома в соединениях равна +3 .
10.Простое вещество алюминий является металлом.
11.Оксид и гидроксид алюминия имеют амфотерный характер
Далее
6
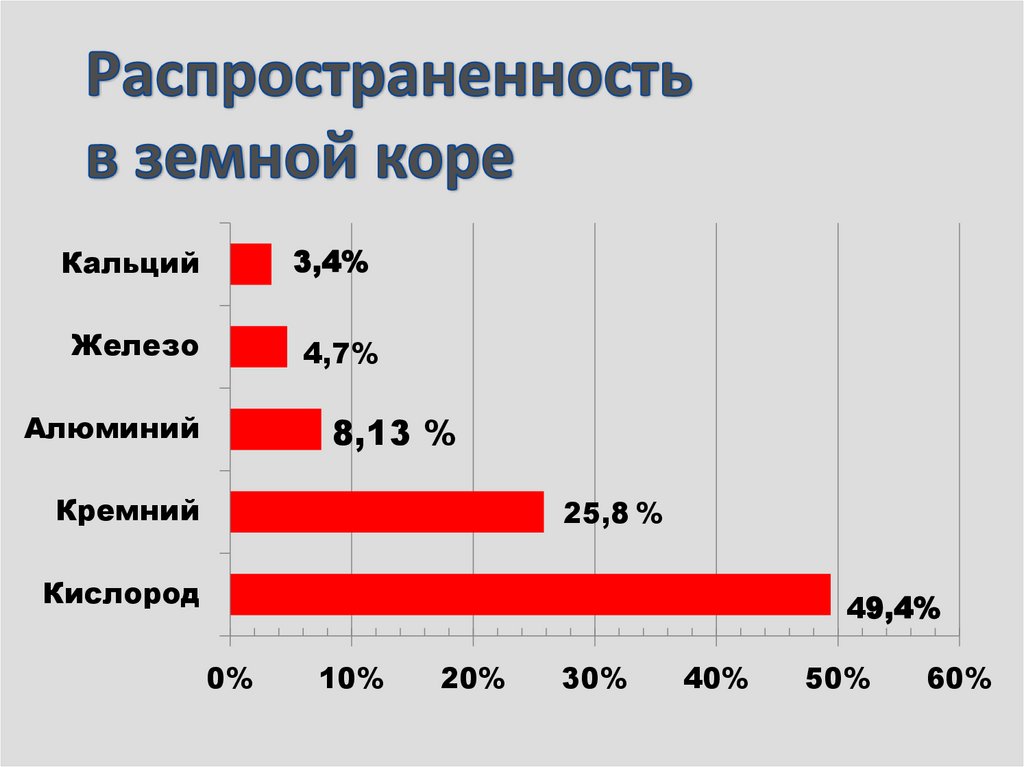
7.
Кальций3,4%
Железо
4,7%
Алюминий
8,13 %
Кремний
25,8 %
Кислород
49,4%
0%
10%
20%
30%
40%
50%
60%
8.
Алюминий входит в состав 250 минералов,главным образом алюмосиликатов
Полевой шпат
Слюда
9.
Глинистые минералы: бокситы и каолиныКаолин
Бокситы
10.
Замечательные драгоценные камни –соединения алюминия
Топаз
Гранат
Сапфир
Рубин
Берилл
11.
Важнейшие минералы алюминия,имеющие промышленное значение
Боксит
Криолит
Каолин
12.
7. Нахождение в природеглавная
Алюмосиликаты
Полевой шпат
(ортоклаз) –
K2O*Al2O3*6SiO2
Нефелин - Na2O *
Al2O3 * 2SiO2
Каолин – Al2O3 *
2SiO2 * 2H2O
Корунд – Al2O3
Рубин
(красный Cr+3)
Сапфир
(синийTi+4,
Fe+2, Fe+3)
Бокситы – Al2O3
Глинозем – Al2O3
12
13.
План характеристикифизических свойств алюминия:
1. Агрегатное состояние.
2. Цвет.
3. Плотность.
4. Температура плавления.
5. Пластичность.
6. Теплопроводность, электропроводность.
14.
Химические свойства алюминия:Взаимодействует с простыми веществами
1. 4Al+3O2 = 2Al2O3 + Q
2. 2Al + 3l2 = 2All3 + Q
3. 2Al + 3Cl2 = 2AlCl3
4. 2Al + N2 = 2AlN - при нагревании
5. 4Al + 3С = Al4С3 - при нагревании
15.
Взаимодействует со сложнымивеществами
1.
2.
3.
4.
2Al+ 6H2O= 2Al(OH)3 + 3H2
2Al + 3H2 SO4= 2Al2(SO4)3 + 3H2
2Al + 6NaOH = 2Na[Al(OH)6] +3H2
Алюминотермия – получение
металлов: Fe, Cr, Mn, Ti, W и других
2Al + Cr2O3 = Al2O3 + 2Cr
16.
Химические свойства оксида алюминия:нерастворим в воде, амфотерен,
взаимодействует с кислотами и щелочами.
Al2O3 + 6HCl = 2AlCl3 + 3H2O
сплавление
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
17.
Химические свойства гидроксидаалюминия
Гидроксид алюминия – типичный амфотерный гидроксид. С
кислотами он образует соли, содержащие катион алюминия,
со щелочами – алюминаты:
Al(OH)3 + 3HCl = AlCl3 + 3H2O;
Al(OH)3+ NaOH = NaAlO2 + 2H2O.
При взаимодействии гидроксида алюминия с водными
растворами щелочей образуются гидроксоалюминаты:
Al(OH)3 + NaOH = Na[Al(OH)4].
При нагревании до температуры выше 575oС гидроксид
алюминия разлагается:
2Al(OH)3 = Al2O3 + 3H2O.
18.
8. Получение1825 год Х. Эрстед:
главная
AlCl3 + 3K = 3KCl + Al :
Электролиз (t пл. = 2050°С) :
2Al2O3 = 4Al +3O2
Электролиз (в распл. криолите Na3AlF6, tпл.≈1000°С) :
2Al2O3 = 4Al +3O2
Далее18

















 chemistry
chemistry








