Similar presentations:
Алюминий. Лекция №14
1.
ГОУ ВПО «Донбасская Национальная академия строительства иархитектуры»,
кафедра «Прикладная химия»
Курс лекций по дисциплине «Химия»
для студентов 1 курса
Направление подготовки – 08.03.01 Строительство
Составил:
Ташкинов Ю.А.
Макеевка, 2020
1
2.
Положениев Периодической системе
Алюминий располагается в 3
периоде, в главной
подгруппе 3 группы.
Порядковый номер элемента
– 13
Относительная атомная
масса – 27
Алюминий – металл,
соединения которого
обладают амфотерными
свойствами.
2
3.
Строение атомаалюминия
Заряд ядра атома алюминия +13
В атоме 3 энергетических уровня
Электронная оболочка атома алюминия содержит
s- и p-электроны
На внешнем электронном уровне 3 электрона (2 –
спаренных s-электрона и 1 – неспаренный pэлектрон)
3
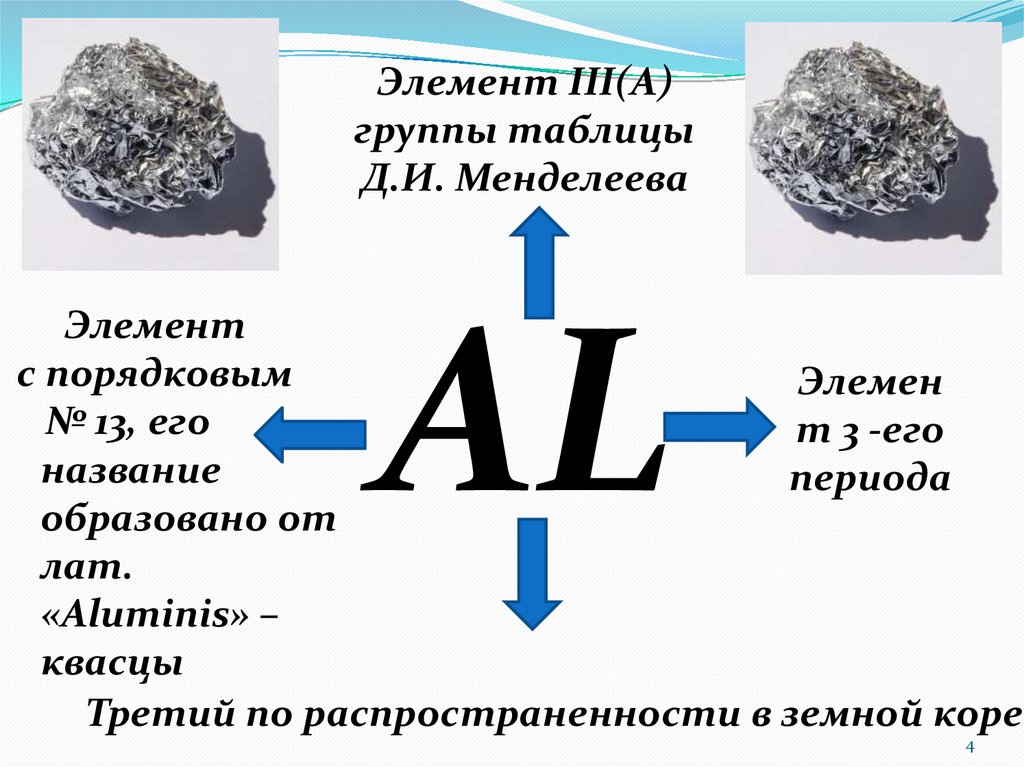
4.
Элемент III(A)группы таблицы
Д.И. Менделеева
Элемент
с порядковым
Элемен
№ 13, его
т 3 -его
название
периода
образовано от
лат.
«Aluminis» –
квасцы
Третий по распространенности в земной коре
AL
4
5.
Физические свойствасеребристо-белый с характерным металлическим блеском
мягкий
легкий (с малой плотностью – 2,7 г/см3)
с высокой тепло- и электропроводностью
легкоплавкий (температура плавления 660°C)
ЭТО ВАЖНО:
Занимает 1-е место в земной коре среди металл
Совокупность этих важных свойств
позволяет отнести алюминий к числу
важнейших технических материалов
5
6.
Датский физикГанс Эрстед
(1777-1851)
Впервые алюминий
был получен им
в 1825 году
действием
амальгамы калия
на хлорид алюминия
с последующей
отгонкой ртути.
6
7.
Современные метод получения былразработан независимо друг от друга:
американцем Чарльзом Холлом и французом
Полем Эру в 1886 году.
Он заключается в
растворении оксида
алюминия в расплаве
криолита с
последующим
электролизом с
использованием
расходуемых коксовых
или графитовых
электродов.
7
8.
Нахождение в природе8
9.
910.
1011.
1112.
1213.
1314.
1415.
1516.
1617.
Химические свойстваВзаимодействие с простыми веществами:
с кислородом, образуя оксид алюминия:
4Al + 3O2 = 2Al2O3
с серой, образуя сульфид алюминия:
2Al + 3S = Al2S3
с азотом, образуя нитрид алюминия:
2Al + N2 = 2AlN
с углеродом, образуя карбид алюминия:
4Al + 3С = Al4С3
с хлором, образуя хлорид алюминия:
2Al + 3Cl2 = 2AlCl3
17
18.
Химические свойстваВзаимодействие со сложными веществами:
1. с водой (после удаления защитной оксидной
пленки)
2Al + 6H2O = 2Al(OH)3 + 3H2
2. с растворами щелочей (с образованием
тетрагидроксоалюмината)
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
3. c соляной и разбавленной серной кислотами:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
4. с оксидами менее активных металлов
(алюминотермия)
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
18
19.
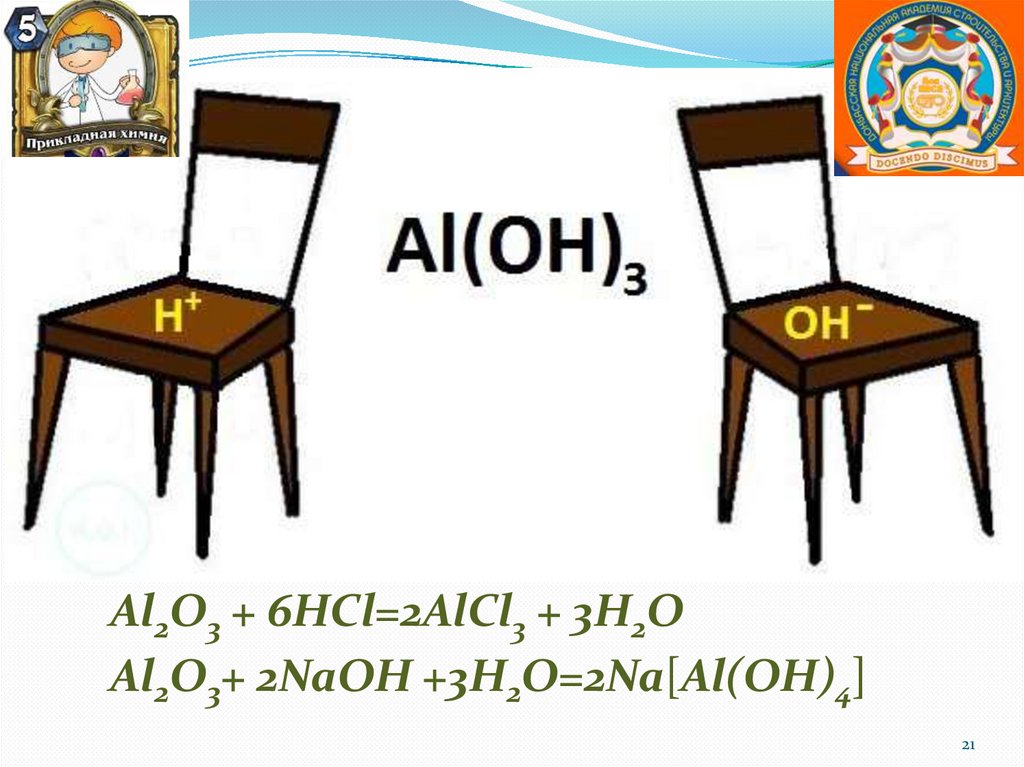
Оксид алюминия(Al2O3)
Соединения алюминия
Гидроксид алюминия
Al(OH)3
19
20.
рубинГлинозём
Al2O3
сапфир
Корунд
Боксит
20
21.
Al2O3 + 6HCl=2AlCl3 + 3H2OAl2O3+ 2NaOH +3H2O=2Na[Al(OH)4]
21
22.
Амфотерные свойстваРазлагается при нагревании
2Al(OH)3 = Al2О3+ 3H2O
Al(OH)3 + 3HCl = AlCl3+ 3H2O
Al(OH)3 + NaOH = Nа[Al(OH)4 ]
Al2O3+ 2NaOH +3H2O=2Na[Al(OH)4]
Al2O3 + 6HCl=2AlCl3 + 3H2O
22
23.
ПРИМЕНЕНИЕАЛЮМИНИЯ
23





















 chemistry
chemistry








