Similar presentations:
Сера и её свойства
1.
Сера и её свойстваПрезентация составлена к уроку химии в
9 классе
2.
Цели урокаОхарактеризовать
положение
серы в Периодической системе,
строение атома, физические и
химические свойства серы.
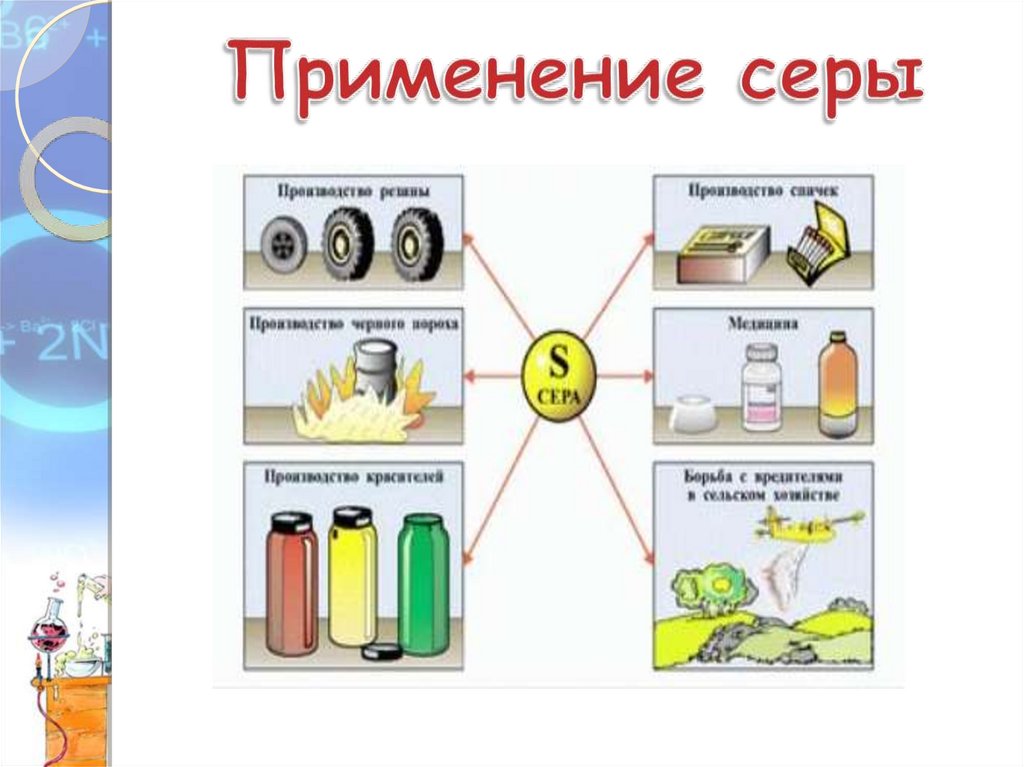
Охарактеризовать природные
соединения серы, а также
области ее применения.
Рассмотреть сероводород и оксид
серы(IV) как загрязнители
окружающей среды.
3.
Визитка химическогоэлемента.
Химический знак - S
Порядковый номер – 16
S
Аr - 32.066
Sulfur
Период - III
32.066
Группа – V I
3s23p4
Подгруппа – главная
Электронная формула атома –
1s22s22p63s23p4
Радиус атома – 0.104 нм.
Электроотрицательность – 2.58
16
2
8
6
4.
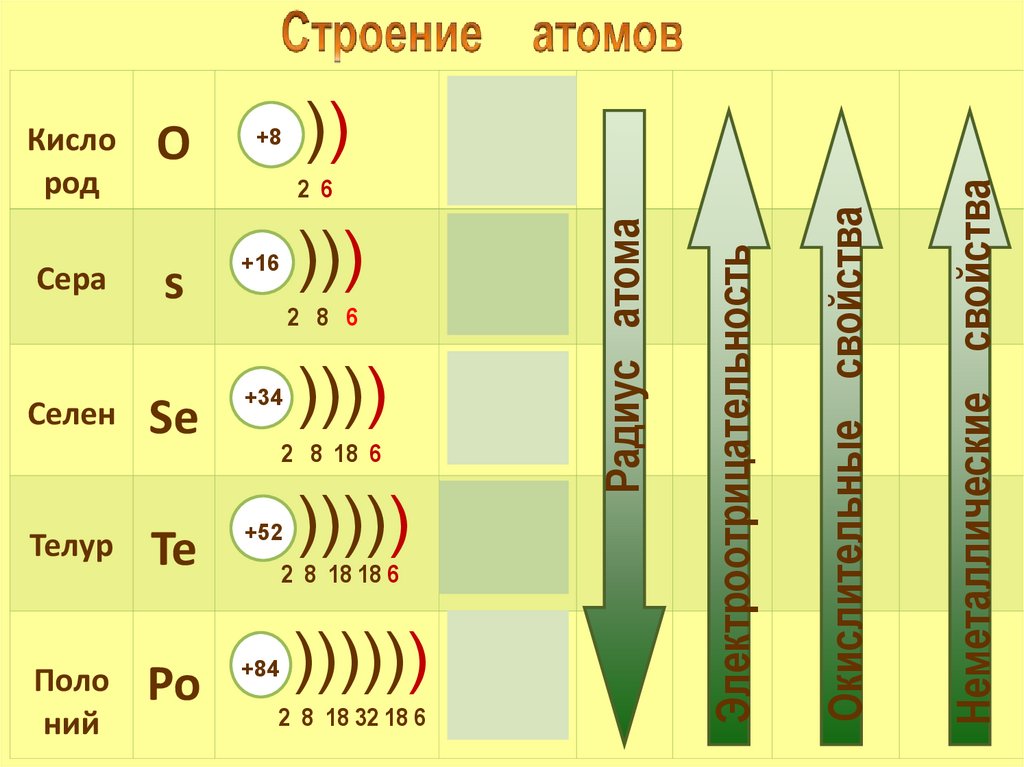
Полоний
2 6
)))
s
+16
Se
+34
Te
+52
Po
+84
3s23p4
2 8 6
))))
4s24p4
2 8 18 6
)))))
2 8 18 18 6
5s25p4
)))))) 6s 6p
2 8 18 32 18 6
2
4
Неметаллические свойства
Телур
2s22р4
Окислительные свойства
Селен
))
Электроотрицательность
Сера
О
+8
Радиус атома
Кисло
род
5.
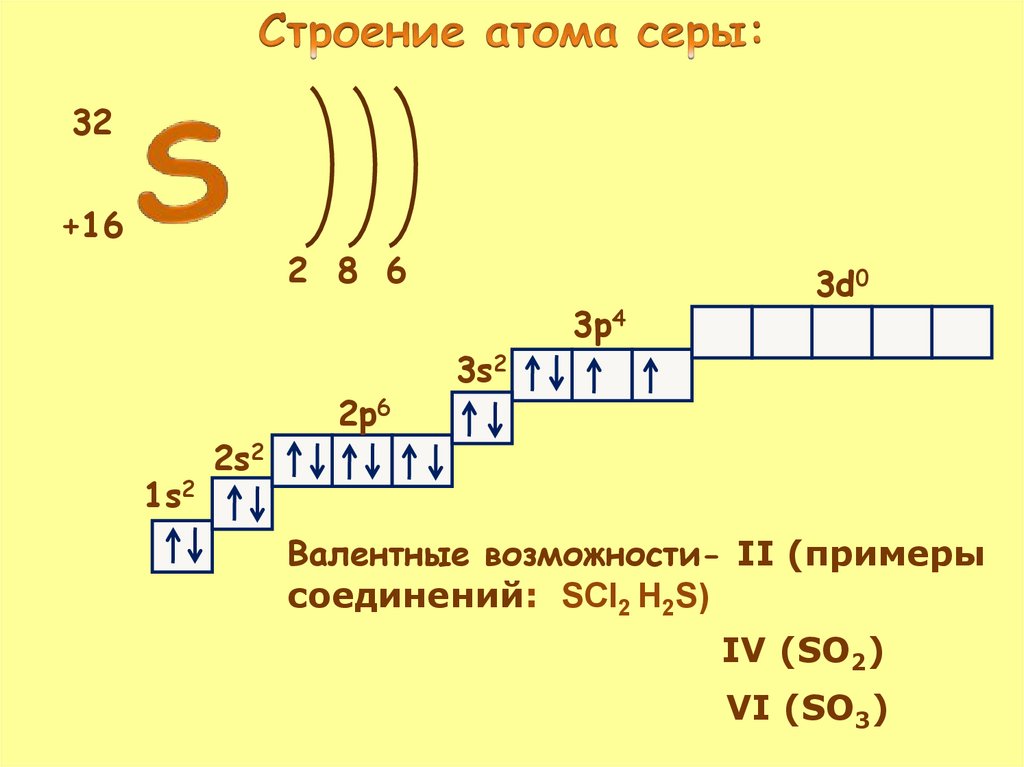
32+16
2 8 6
1s2
2s2
2p6
3s2
3p4
3d0
Валентные возможности- II (примеры
соединений: SCl2 H2S)
IV (SO2)
VI (SO3)
6.
Распространенность серыПо
распространённости в
земной коре сера
занимает
пятнадцатое место.
Содержание серы в
организме среднего
человека (массой
тела 70 кг.)
составляет 140 г.
Содержание в окружающей среде и в
организме человека ( в % по массе )
7.
Нахождение серы в природе.Сера в природе
Самородная
сера -S
Киноварь
HgS
Сульфиды
Пирит –FeS2
Сульфаты
ГипсСаSO4*2H2O
Мирабилит –
Na2SO4*10H2O
Горькая сольMgSO4*7H2O
Халькопирит
CuFeS2
8.
Аллотропные модификации серы.1. Ромбическая сера устойчива
при комнатной
температуре
2. Моноклинная сера –
образуется при
медленном охлаждении
расплава
ромбической серы.
3. Пластическая сера –
резиноподобная масса,
состоящая из полимерных
цепочек, образуется при
быстром охлаждении
расплава ромбической серы.
9.
10.
11.
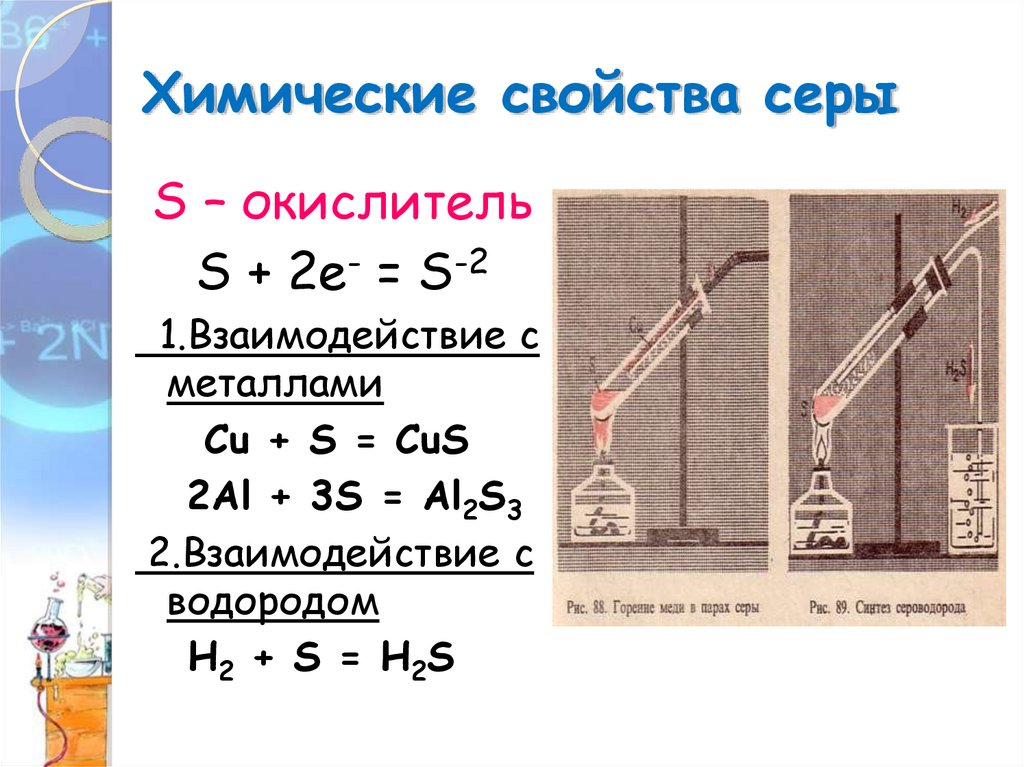
Химические свойства серыS – окислитель
S + 2е- = S-2
1.Взаимодействие с
металлами
Сu + S = CuS
2Al + 3S = Al2S3
2.Взаимодействие с
водородом
H2 + S = H2S
12.
Химические свойства серы.S – восстановитель
S – 2e- = S+2
1.Взаимодействие
с кислородом
S + O2= SO2
S - 4e- = S+4
2.Взаимодействие
с галогенами
S+ Cl2= SCl2
S + 3F2= SF6
S - 6e- = S+6
3.Взаимодействие с
кислотами –
окислителями
S+ 2Н2SО4=3SO2+2H2O
Концентрированная.
13.
14.
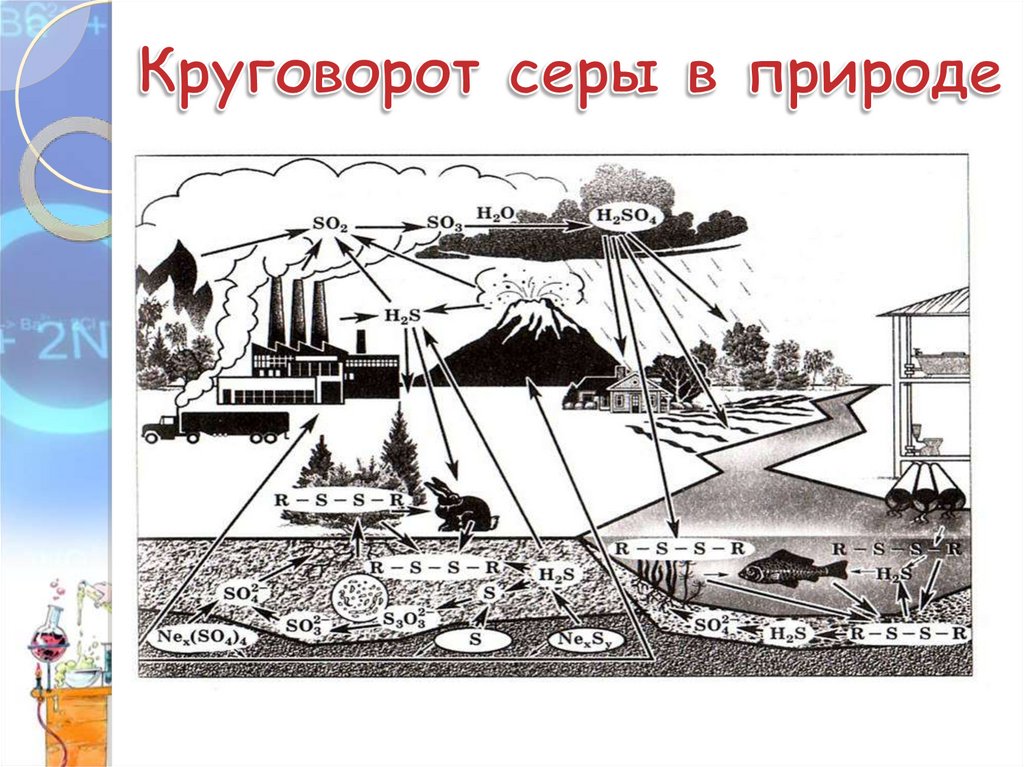
• Сероводород – высокотоксичное,крайне ядовитое вещество. Вдыхание
H2S вызывает головокружение и
головную боль, происходит
разрушение гемоглобина в крови.
• Сернистый газ тоже ядовит, но он
широко используется в качестве
дезинфицирующего средства и
отбеливателя.
15.
Кто есть кто на данномсемейном портрете?
16.
17.
18.
АНет, я не понимаю
В
Я не полностью уверен
С
Да, я понимаю
19.
Использованные материалы иИнтернет-ресурсы
•Учебник «Химия – 9» , О.С. Габриелян
•Единая коллекция Цифровых
Образовательных Ресурсов
http://school-collection.edu.ru
•Виртуальный учебник по химии
http://www.chemistry.ssu.samara.ru/
•Каталог образовательных ресурсов по
химии
http://www.mec.tgl.ru/index.php?module=su
bjects&func=viewpage&pageid=149
•Я иду на урок химии
http://him.1september.ru/urok/














 chemistry
chemistry