Similar presentations:
Строение атома, аллотропия, свойства и применение серы
1.
СЕРА.Строение
атома,
аллотропия,
свойства и
применение
серы
http://linda6035.ucoz.ru/
2.
Какие элементы входят в состав VI-А подгруппы,особенности строения атомов?
O, S, Se, Te, Po
2
2
4
8O 1 s 2 s 2 p
2 3 p4
S
…..
3
s
16
2 4 p4
Se
….4
s
34
2 5 p4
Te
….5
s
52
2
4
84 Po …..6 s 6 p
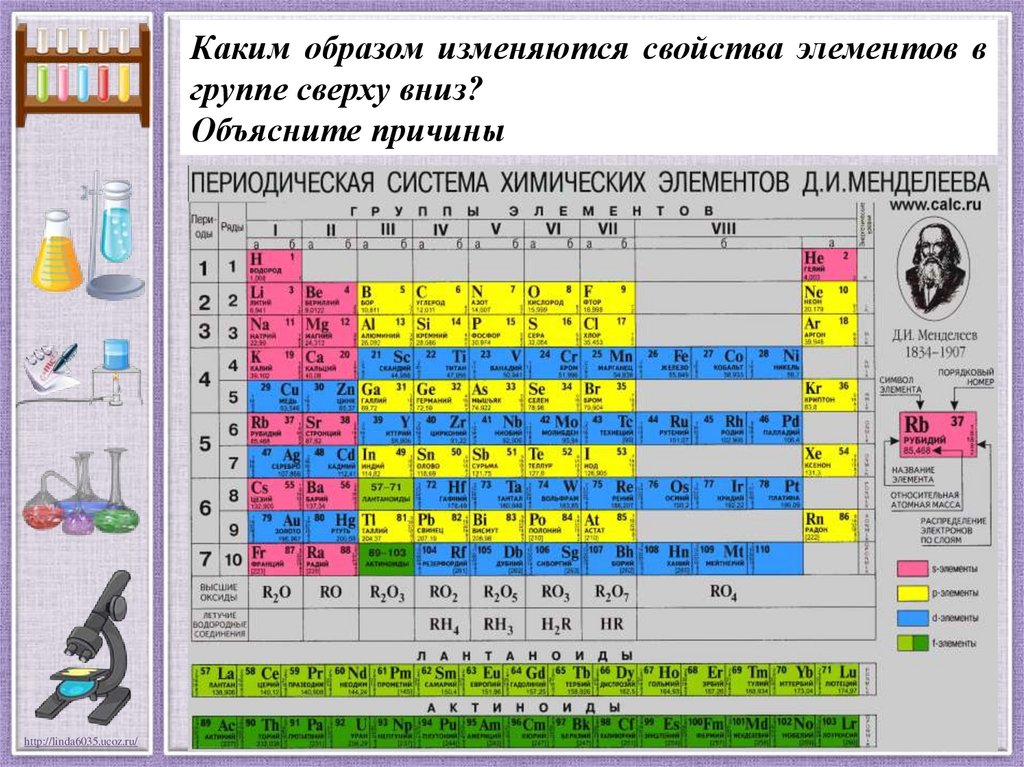
Что общего и в чем различие в строении атомов
элементов VI-А подгруппы?
Общее: количество электронов на внешнем
энергетическом
уровне.
Различие:
число
энергетических уровней.
http://linda6035.ucoz.ru/
3.
Каким образом изменяются свойства элементов вгруппе сверху вниз?
Объясните причины
http://linda6035.ucoz.ru/
4.
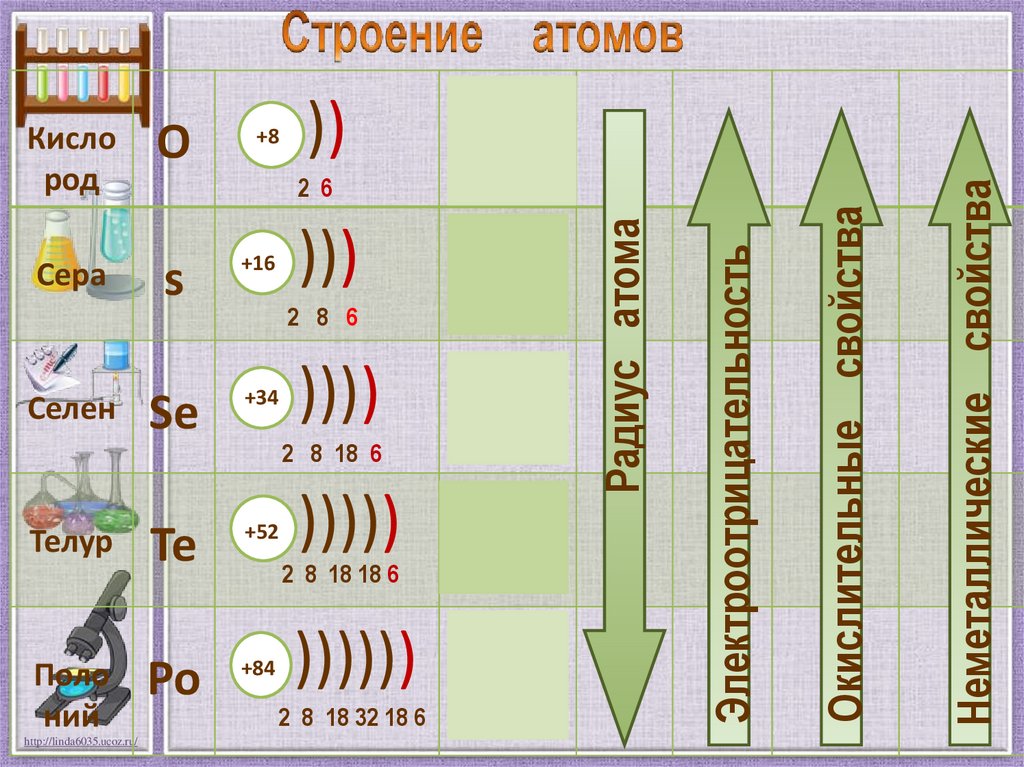
+8Телур
Te
+52
Поло
ний
Po
+84
http://linda6035.ucoz.ru/
2 8 6
))))
4s24p4
2 8 18 6
)))))
2 8 18 18 6
5s25p4
)))))) 6s 6p
2
2 8 18 32 18 6
4
Окислительные свойства
Se
+34
3s23p4
Электроотрицательность
)))
s
Селен
2s22р4
2 6
+16
Сера
))
Неметаллические свойства
О
Радиус атома
Кисло
род
5.
http://linda6035.ucoz.ru/6.
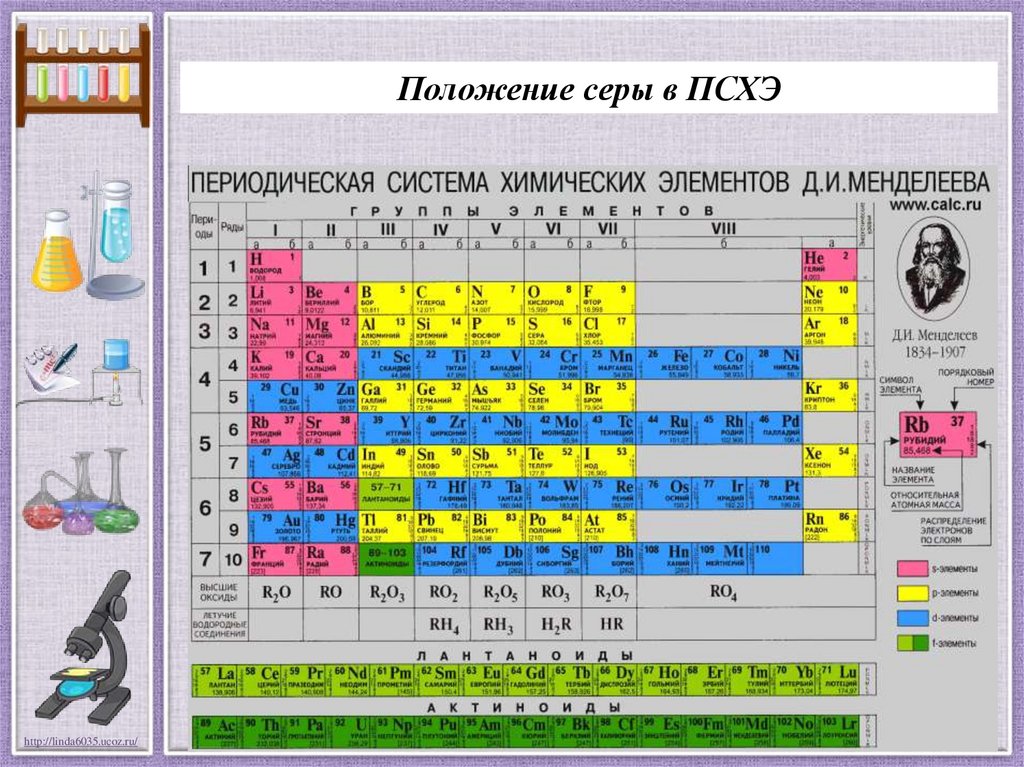
Положение серы в ПСХЭhttp://linda6035.ucoz.ru/
7.
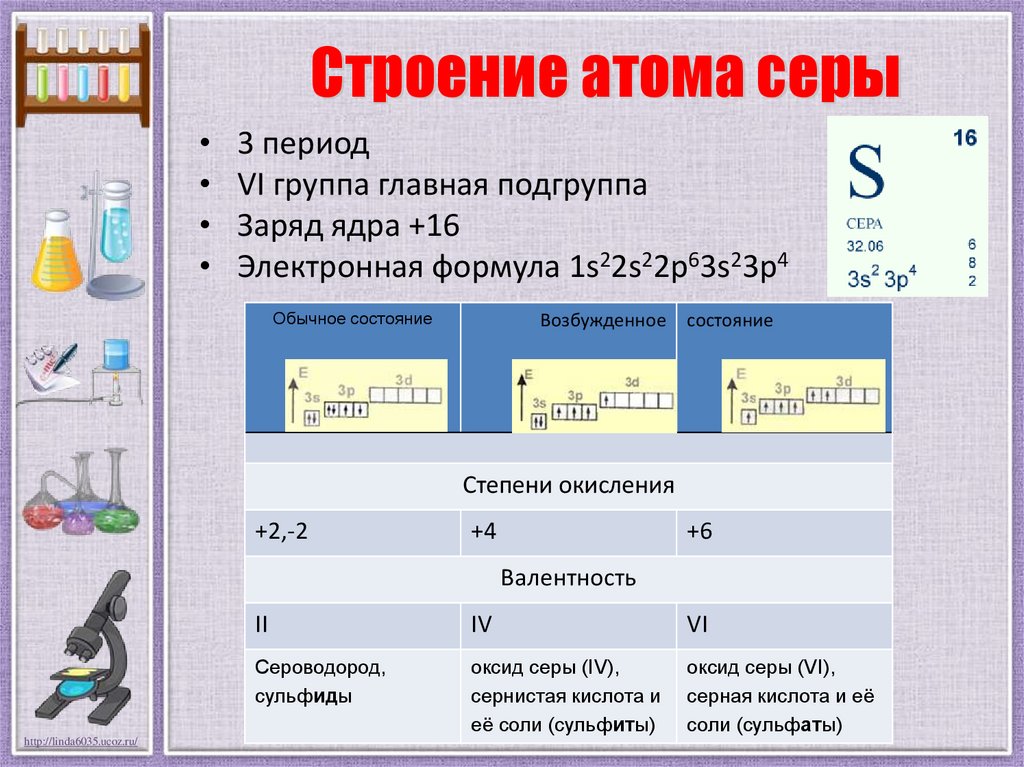
Строение атома серы3 период
VI группа главная подгруппа
Заряд ядра +16
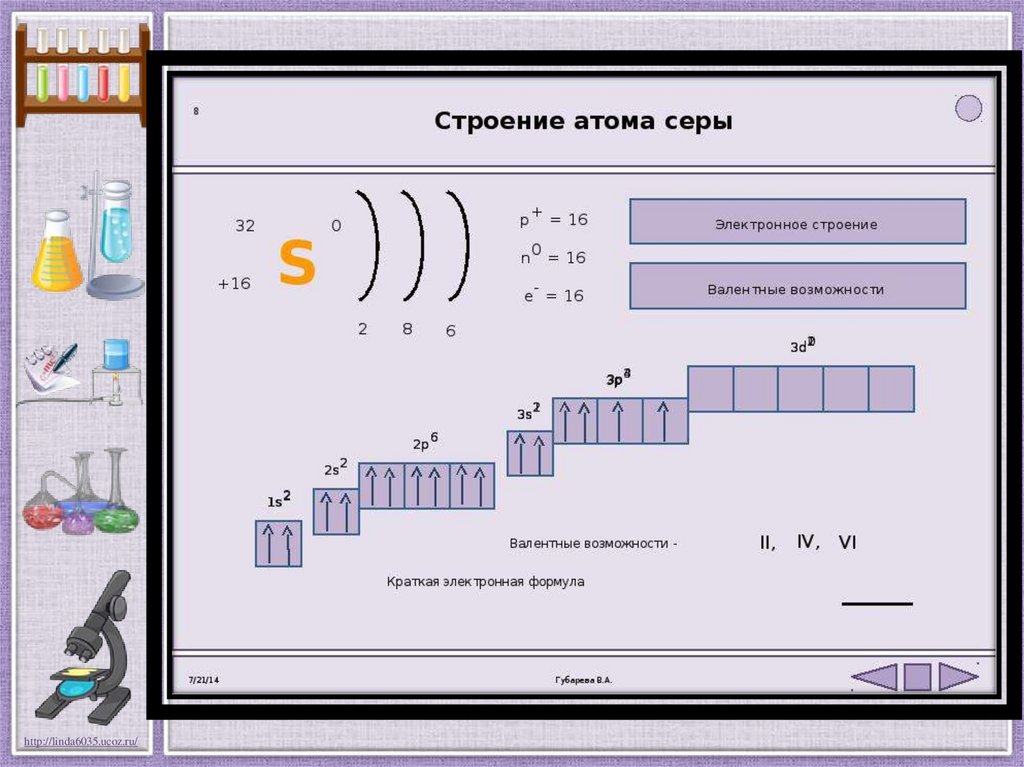
Электронная формула 1s22s22p63s23p4
Обычное состояние
Возбужденное
состояние
Степени окисления
+2,-2
+4
+6
Валентность
http://linda6035.ucoz.ru/
II
IV
VI
Сероводород,
сульфиды
оксид серы (IV),
сернистая кислота и
её соли (сульфиты)
оксид серы (VI),
серная кислота и её
соли (сульфаты)
8.
http://linda6035.ucoz.ru/9.
Валентные возможности атома серыhttp://linda6035.ucoz.ru/
10.
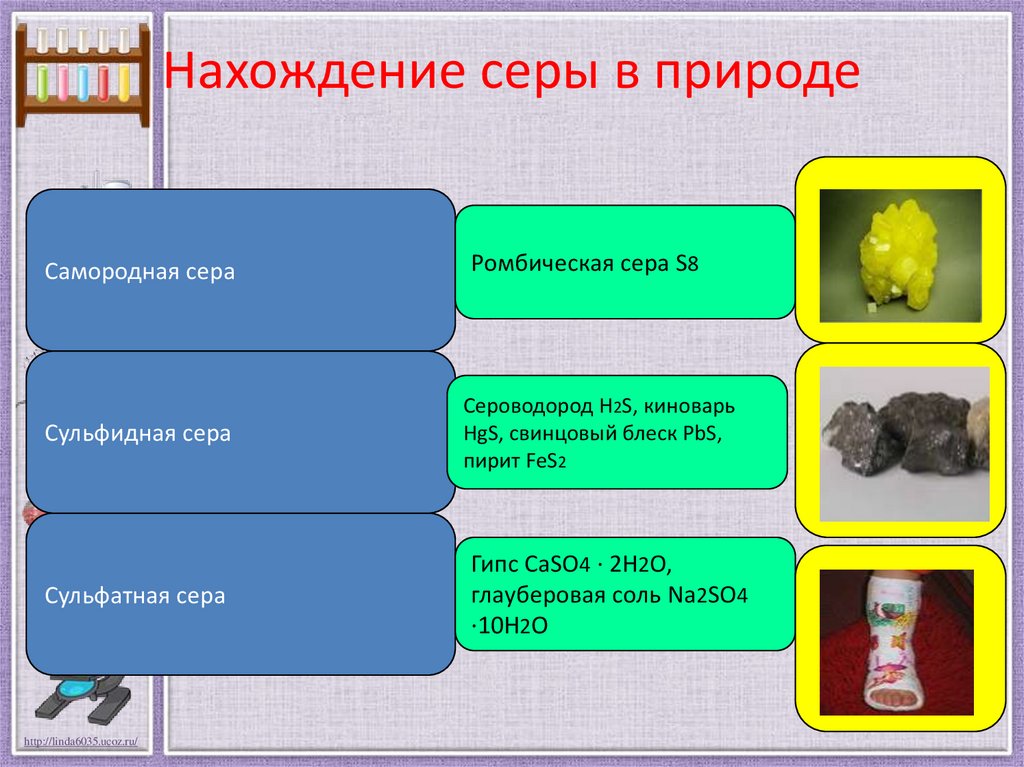
Нахождение серы в природеСамородная сера
Ромбическая сера S8
Сульфидная сера
Сероводород H2S, киноварь
HgS, свинцовый блеск PbS,
пирит FeS2
Сульфатная сера
Гипс CaSO4 · 2H2O,
глауберовая соль Na2SO4
·10H2O
http://linda6035.ucoz.ru/
11.
Самородная сераhttp://linda6035.ucoz.ru/
12.
Сульфидная сераPbS- свинцовый блеск
CuS- медный блеск
http://linda6035.ucoz.ru/
13.
Сульфидная сераZnS- цинковая обманка
HgS- киноварь
http://linda6035.ucoz.ru/
14.
Сульфатная сераГипс(CaSO4 * 2H2O)
Горькая соль(MgSO4 * 7H2O)
http://linda6035.ucoz.ru/
15.
http://linda6035.ucoz.ru/16.
http://linda6035.ucoz.ru/17.
http://linda6035.ucoz.ru/18.
Получение серы1. Промышленный метод выплавление из руды с помощью
водяного пара.
2. Неполное окисление
сероводорода (при недостатке
кислорода).
2H2S + O2 = 2S + 2H2O (*ОВР)
3. Реакция Вакенродера
2H2S + SO2 = 3S + 2H2O (*ОВР)
http://linda6035.ucoz.ru/
19.
http://linda6035.ucoz.ru/20.
Химические свойства серы - окислительныесвойства
S0 + 2e = S-2
1) с металлами, образуя сульфиды
2Na + S = Na2S без нагревания
c остальными металлами (кроме Au,Pt) - при
повышенной t°:
2Al + 3S –t°-> Al2S3
Zn + S –t°-> ZnS
Cu + S –t°-> CuS
Hg + S -> HgS - демеркуризация
http://linda6035.ucoz.ru/
21.
Химические свойства серы2) Взаимодействие серы с неметаллами окислительные свойства.
S0 + 2e = S-2.
Например: Взаимодействие серы и водорода .
H2 + S -> H2S
2P + 3S -> P2S3
C + 2S -> CS2
http://linda6035.ucoz.ru/
22.
http://linda6035.ucoz.ru/23.
Домашнее задание§26
Упр.1,3(письменно)
стр.194
.
http://linda6035.ucoz.ru/
















 chemistry
chemistry