Similar presentations:
Сера. Физические и химические свойства. Нахождение в природе
1. Сера. Физические и химические свойства. Нахождение в природе.
2. Сера
Сера – довольно активный неметалл.Сущетсвует три аллотропных
модификации серы:
• ромбическая S8
• пластическая
• моноклинная
3. Характеристика серы
Сера в ПСХЭ:1) положение (период, группа)
2) строение атома
3) свойства элемента по периоду / в
главной п/гр
4) высший оксид
5) высший гидроксид
6) ЛВС
4. Физические свойства Серы
• Сера — твердое кристаллическоевещество, устойчивое в виде двух
аллотропических модификаций.
• Ромбическая: лимонно-желтого цвета,
плотность 2,07 г/см 3, t пл 112,8 °С,
устойчива ниже 95,6 °С;
• Моноклинная : медово-желтого цвета,
плотность 1,96 г/см 3, t пл 119,3 °С,
устойчива между 95,6 °С и
температурой плавления.
5. Получение
При сливании растворов сероводороднойи сернистой кислот:
H2SO3 + 2H2S = 3S + 3H2O
При неполном сгорании сероводорода
(при недостатке воздуха):
2H2S + O2 = 2S + 2H2O
6. Химические свойства
Не смачивается и не реагирует с водой.Как окислитель реагирует с:
1) металлами (кроме золота)
Hg + S = HgS (обезвреживание разлитой
ртути)
2) водородом и неметаллами, у которых
с.о. меньше (углеродом, фосфором и
т.п.)
7. Химические свойства
Как восстановитель реагирует с:1) кислородом
2) хлором
3) фтором
8. Химические свойства
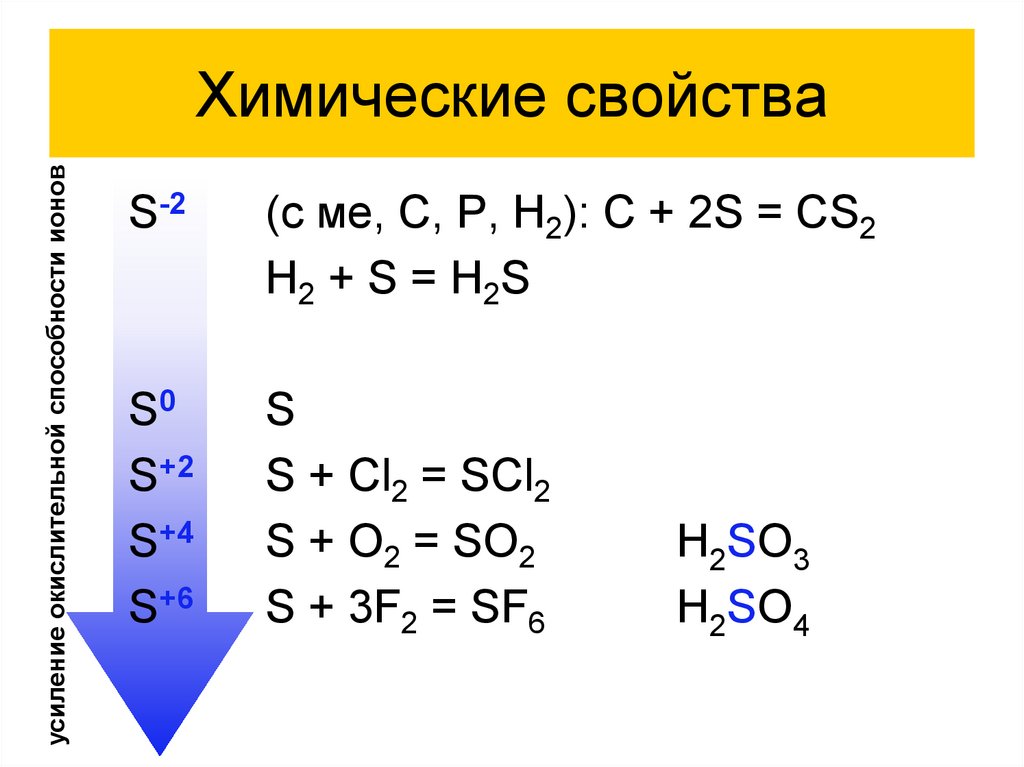
усиление окислительной способности ионовХимические свойства
S-2
(с ме, C, P, H2): C + 2S = CS2
H2 + S = H2S
S0
S+2
S+4
S+6
S
S + Cl2 = SCl2
S + O2 = SO2
S + 3F2 = SF6
H2SO3
H2SO4
9. Домашнее задание
1. Осуществите реакции:O2 → S → SO2 → SO3 → H2SO4 → Na2SO4 → BaSO4
1
Прислать фото (в тетради!) выполненной
работы на почту apolitaew@yandex.ru
или личным сообщением в ЭлЖур








 chemistry
chemistry