Similar presentations:
Карбоновые кислоты
1.
Карбоновые кислотыЛектор: к.б.н. Черных И.В.
Кафедра фармацевтической химии
2.
Строение:карбоксильная группа + УВ радикал
Общая формула CnH2nO2
pπ-сопряженная система, что выравнивает связи в группе (C=O длиннее, чем
в кетонах, C-О – короче, чем в спиртах).
Электронная плотность смещена от карбонильного углерода к атому
кислорода, в результате на углероде частичный положительный заряд.
Электронная плотность от кислорода гидроксильной группы смещается к
положительному углероду, в результате водород легко отщепляется.
Классификация:
Одноосновные (монокарбоновые)
Многоосновные (ди-, трикарбоновые)
а) Гетероциклические
б) Алифатические
в) Алициклические
г) Ароматические
3.
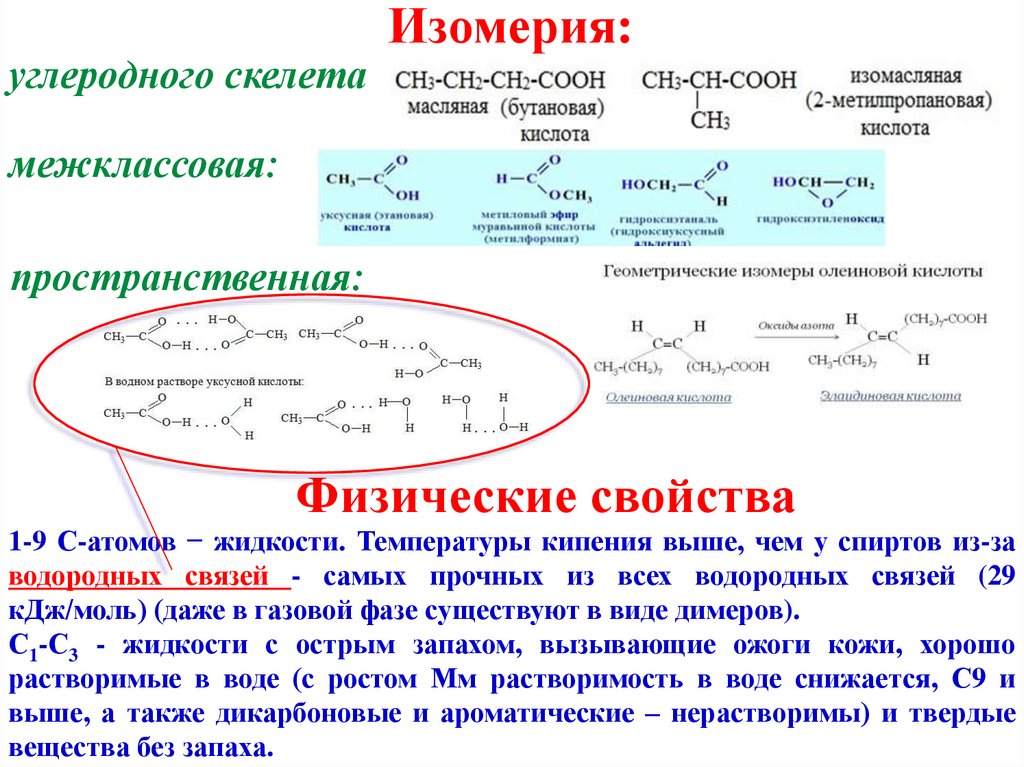
углеродного скелетаИзомерия:
межклассовая:
пространственная:
Физические свойства
1-9 С-атомов − жидкости. Температуры кипения выше, чем у спиртов из-за
водородных связей - самых прочных из всех водородных связей (29
кДж/моль) (даже в газовой фазе существуют в виде димеров).
С1-С3 - жидкости с острым запахом, вызывающие ожоги кожи, хорошо
растворимые в воде (с ростом Мм растворимость в воде снижается, С9 и
выше, а также дикарбоновые и ароматические – нерастворимы) и твердые
вещества без запаха.
4.
Номенклатура:1.муравьиная
2.уксусная
3.Пропионовая (С2Н5СООН)
4.Масляная (С3Н7СООН)
5.Валериановая (С4Н9СООН)
Первые пять представителей (+ бензойная кислота) имеют тривиальные
названия по номенклатуре ИЮПАК.
Капроновая (С5Н11СООН)
Энантовая (С6Н13СООН)
Пальмитиновая (С15Н31СООН)
Маргариновая (С16Н33СООН)
Стеариновая (С17Н35СООН)
В остальных случаях название строится как УВ-радикал + «овая кислота».
Если карбоксильная группа не входит в состав УВ основы, то УВ-радикал+
«карбоновая кислота» (например, циклогексанкарбоновая кислота).
Ацильные радикалы: -овая кислота заменяем на «оил»:
гептаноил: CH3(CH2)5C(O)Соли карбоновых кислот: оил- в ацильном радикале меняем на «ат» или карбоновая кислота меняем на «R-карбоксилат»
5.
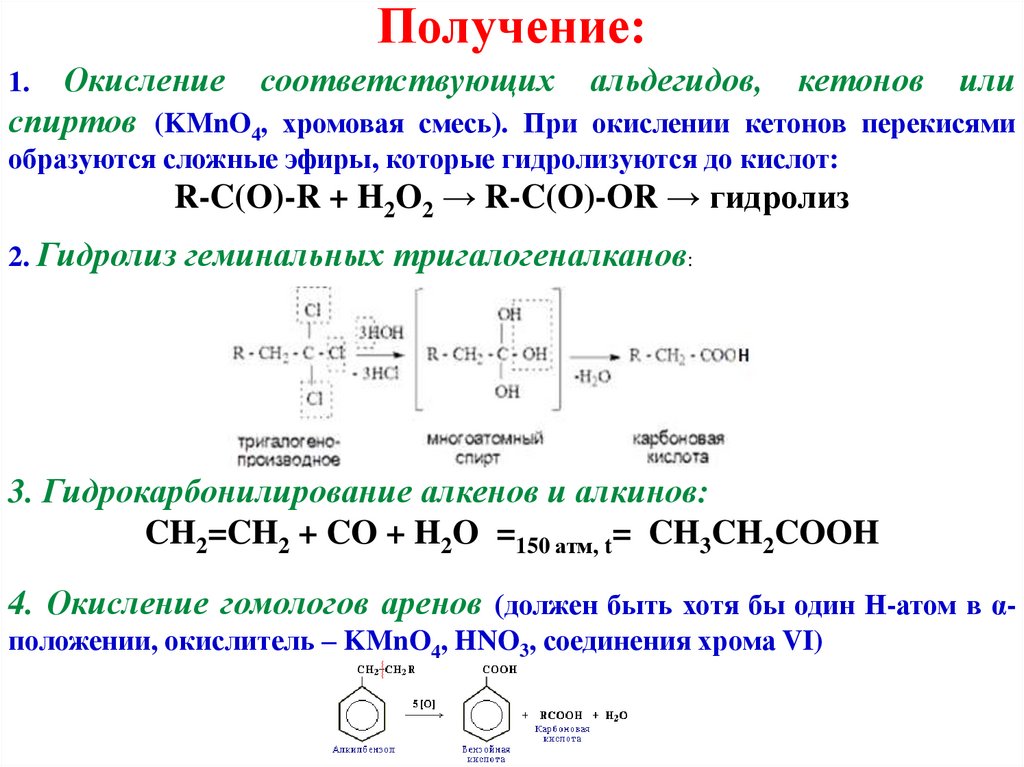
Получение:Окисление соответствующих альдегидов, кетонов или
спиртов (KMnO4, хромовая смесь). При окислении кетонов перекисями
1.
образуются сложные эфиры, которые гидролизуются до кислот:
R-C(O)-R + H2O2 → R-C(O)-OR → гидролиз
2. Гидролиз геминальных тригалогеналканов:
3. Гидрокарбонилирование алкенов и алкинов:
CH2=CH2 + CO + H2O =150 атм, t= CH3CH2COOH
4. Окисление гомологов аренов (должен быть хотя бы один Н-атом в αположении, окислитель – KMnO4, HNO3, соединения хрома VI)
6.
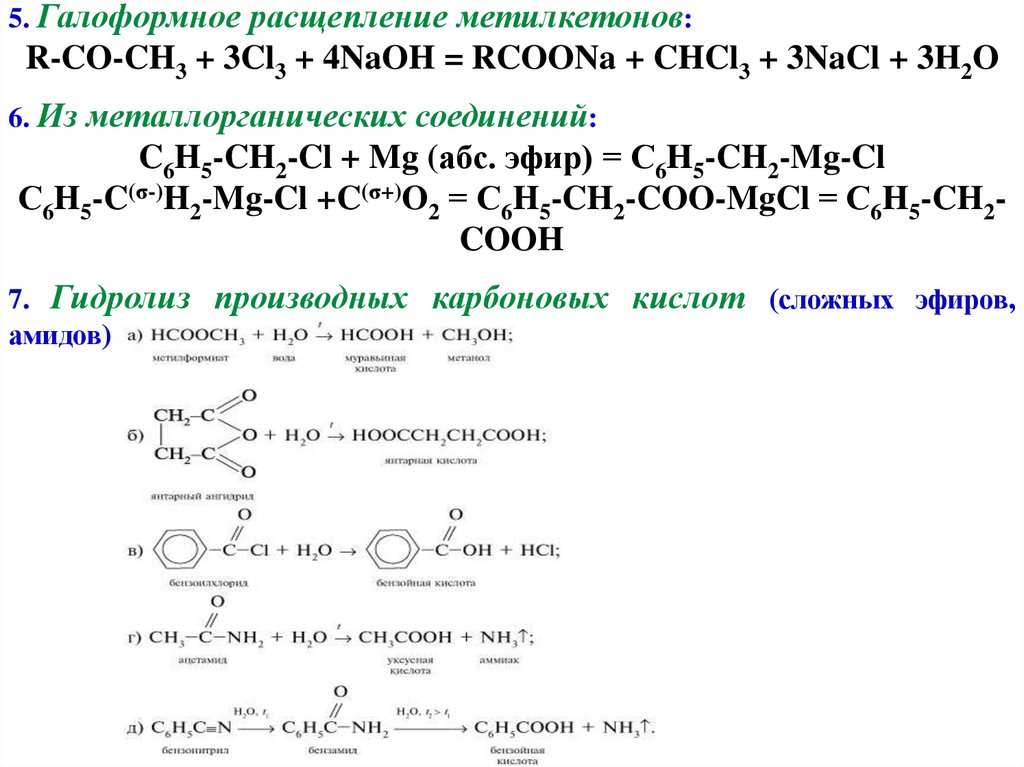
5. Галоформное расщепление метилкетонов:R-CO-CH3 + 3Cl3 + 4NaOH = RCOONa + CHCl3 + 3NaCl + 3H2O
6. Из металлорганических соединений:
C6H5-CH2-Cl + Mg (абс. эфир) = С6H5-CH2-Mg-Cl
С6H5-C(σ-)H2-Mg-Cl +C(σ+)O2 = С6H5-CH2-COO-MgCl = С6H5-CH2COOH
7. Гидролиз производных карбоновых кислот (сложных эфиров,
амидов)
7.
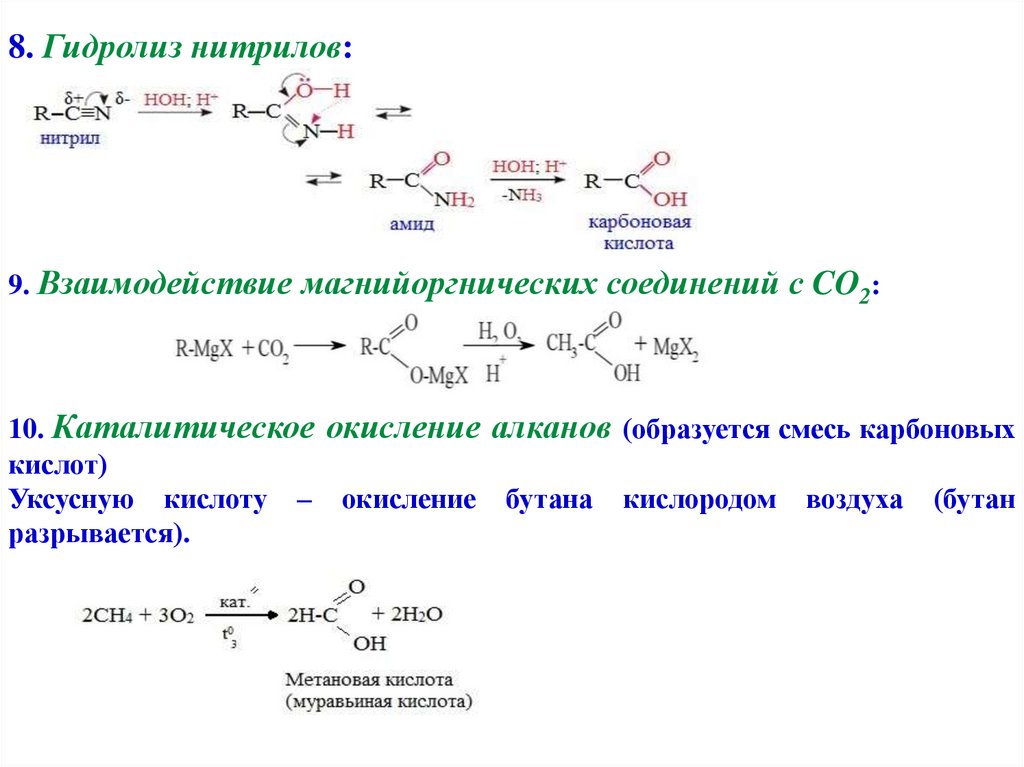
8. Гидролиз нитрилов:9. Взаимодействие магнийоргнических соединений с CO2:
10. Каталитическое окисление алканов (образуется смесь карбоновых
кислот)
Уксусную кислоту – окисление бутана кислородом воздуха (бутан
разрывается).
8.
Химические свойства:1.Кислотные свойства
(ионы стабилизированы за счет сопряжения
– распределения отрицательного заряда между двумя атомами кислорода;
ЭД-заместители ослабляют кислотность и наоборот)
Окрашивают индикаторы, имеют кислый вкус, проводят электрический ток.
Муравьиная кислота –средней силы, остальные – слабые (УВ радикал
отталкивает электронную плотность к кислороду гидроксильной группы).
9.
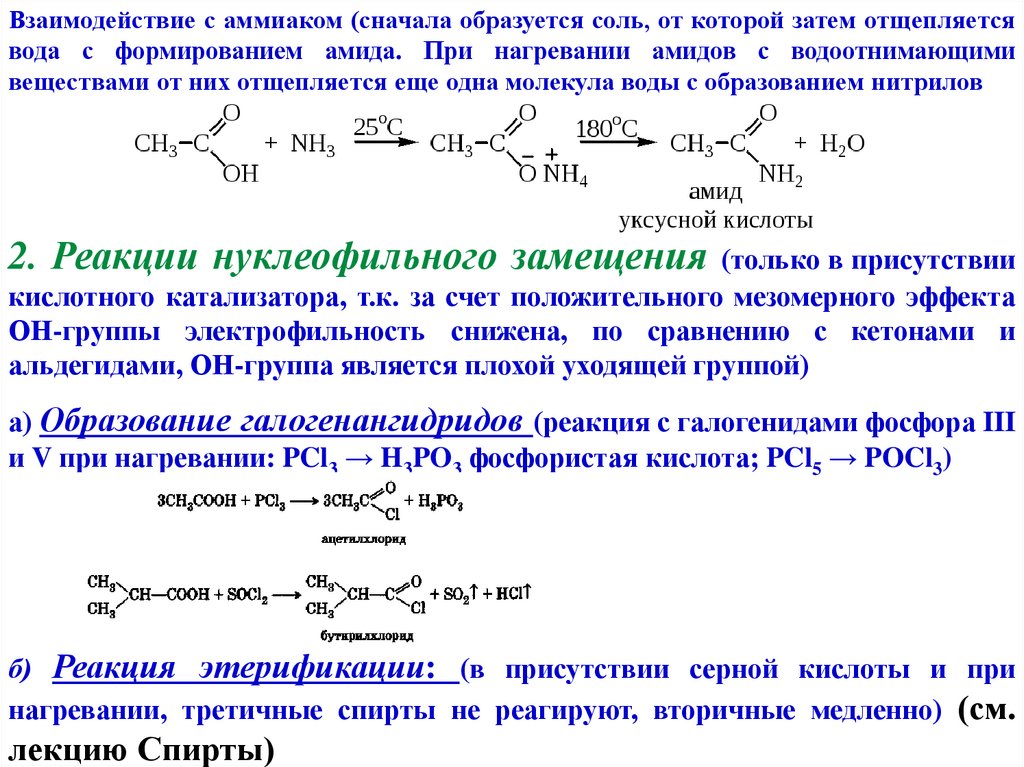
Взаимодействие с аммиаком (сначала образуется соль, от которой затем отщепляетсявода с формированием амида. При нагревании амидов с водоотнимающими
веществами от них отщепляется еще одна молекула воды с образованием нитрилов
2. Реакции нуклеофильного замещения
(только в присутствии
кислотного катализатора, т.к. за счет положительного мезомерного эффекта
ОН-группы электрофильность снижена, по сравнению с кетонами и
альдегидами, ОН-группа является плохой уходящей группой)
а) Образование галогенангидридов (реакция с галогенидами фосфора III
и V при нагревании: PCl3 → H3PO3 фосфористая кислота; PCl5 → POCl3)
б) Реакция этерификации: (в присутствии серной кислоты и при
нагревании, третичные спирты не реагируют, вторичные медленно) (см.
лекцию Спирты)
10.
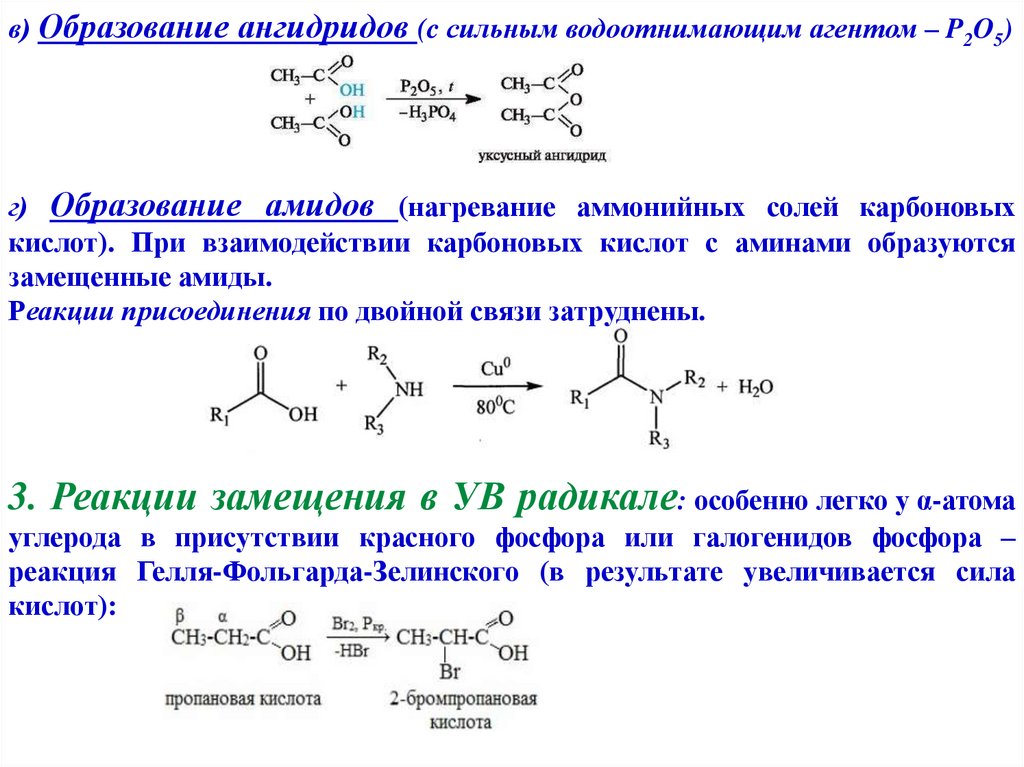
в) Образование ангидридов (c сильным водоотнимающим агентом – P2O5)г) Образование амидов (нагревание аммонийных солей карбоновых
кислот). При взаимодействии карбоновых кислот с аминами образуются
замещенные амиды.
Реакции присоединения по двойной связи затруднены.
3. Реакции замещения в УВ радикале: особенно легко у α-атома
углерода в присутствии красного фосфора или галогенидов фосфора –
реакция Гелля-Фольгарда-Зелинского (в результате увеличивается сила
кислот):
11.
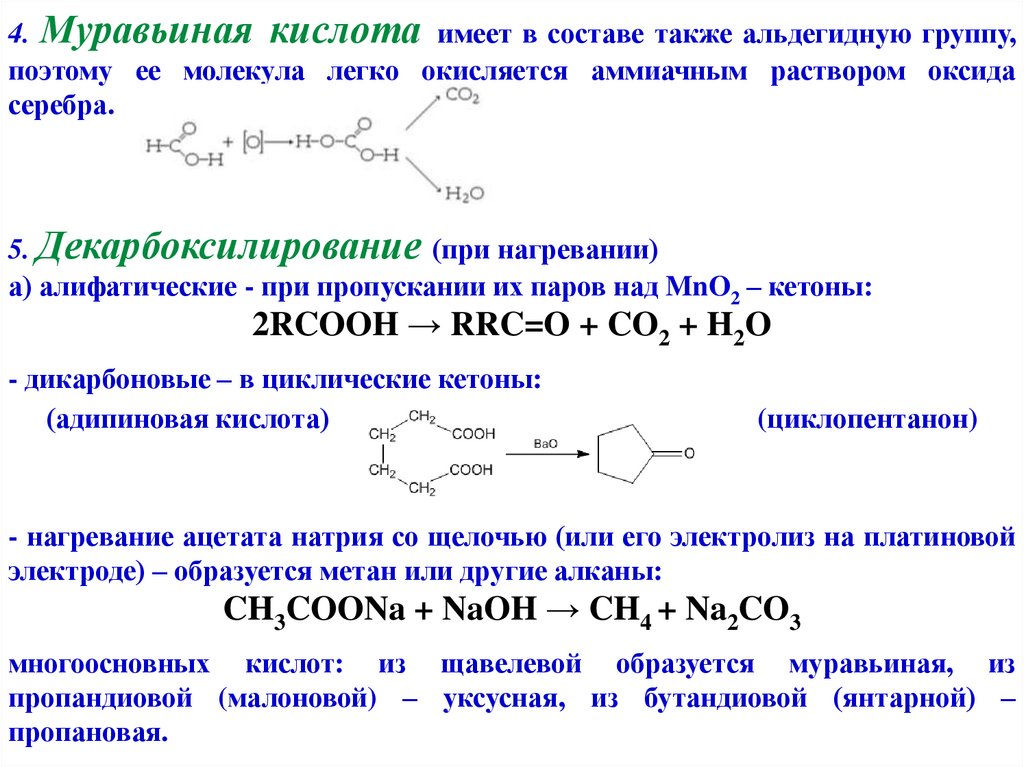
4. Муравьиная кислота имеет в составе также альдегидную группу,поэтому ее молекула легко окисляется аммиачным раствором оксида
серебра.
5. Декарбоксилирование (при нагревании)
а) алифатические - при пропускании их паров над MnO2 – кетоны:
2RCOOH → RRC=O + CO2 + H2O
- дикарбоновые – в циклические кетоны:
(адипиновая кислота)
(циклопентанон)
- нагревание ацетата натрия со щелочью (или его электролиз на платиновой
электроде) – образуется метан или другие алканы:
CH3COONa + NaOH → CH4 + Na2CO3
многоосновных кислот: из щавелевой образуется муравьиная, из
пропандиовой (малоновой) – уксусная, из бутандиовой (янтарной) –
пропановая.
12.
- α,β-ненасыщенные или ароматические (нагревание в хинолине вприсутствии порошкообразной меди):
- пиролиз кальциевых солей:
- нагревание серебряных или ртутных солей солей кислот с бромом
происходит
декарбоксилирование
и
бромирование
(образуются
алкилбромиды).
6. Восстановление
Алюмогидридом лития до спиртов
13.
Ненасыщенные монокарбоновые кислотыАкриловая
Метакриловая
Кротоновая
Олеиновая
винилуксусная (сопряжения нет)
Получение
1. Элиминирование β-гидрокси и β-галогенокислот
14.
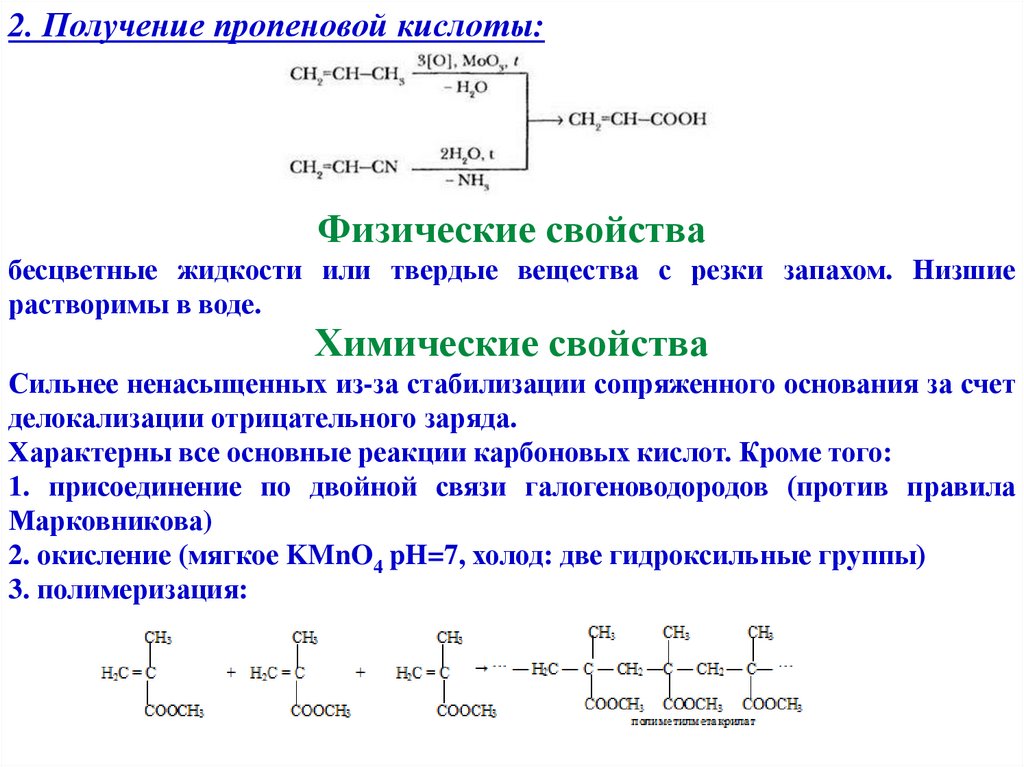
2. Получение пропеновой кислоты:Физические свойства
бесцветные жидкости или твердые вещества с резки запахом. Низшие
растворимы в воде.
Химические свойства
Сильнее ненасыщенных из-за стабилизации сопряженного основания за счет
делокализации отрицательного заряда.
Характерны все основные реакции карбоновых кислот. Кроме того:
1. присоединение по двойной связи галогеноводородов (против правила
Марковникова)
2. окисление (мягкое KMnO4 pH=7, холод: две гидроксильные группы)
3. полимеризация:
15.
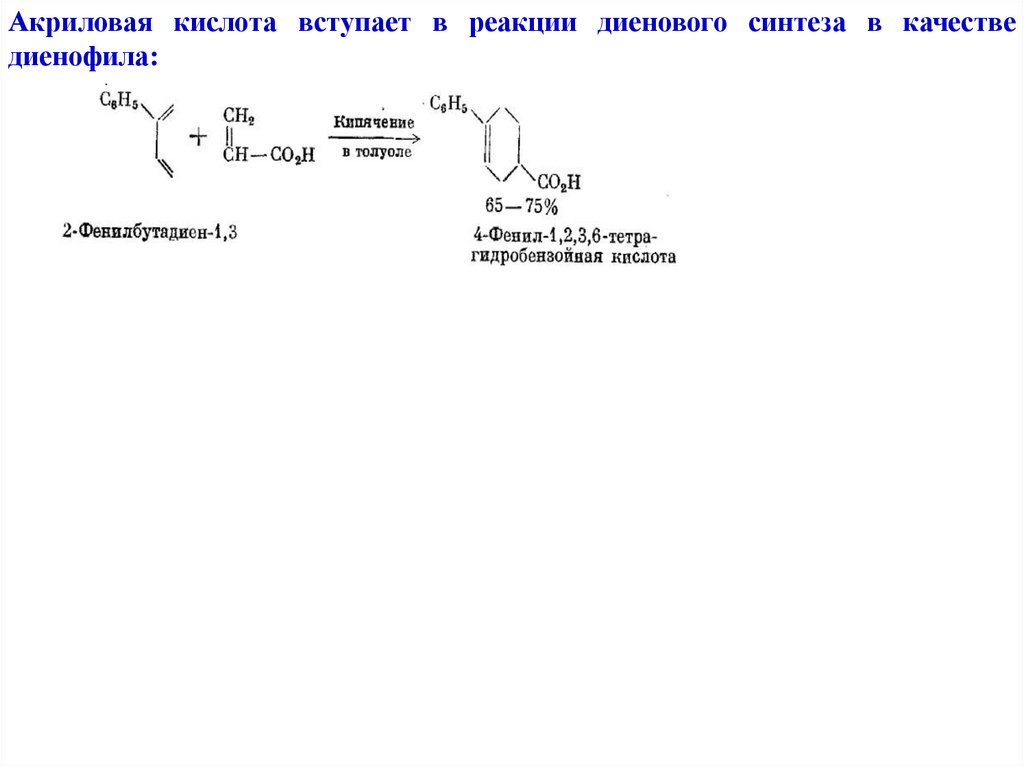
Акриловая кислота вступает в реакции диенового синтеза в качестведиенофила:
16.
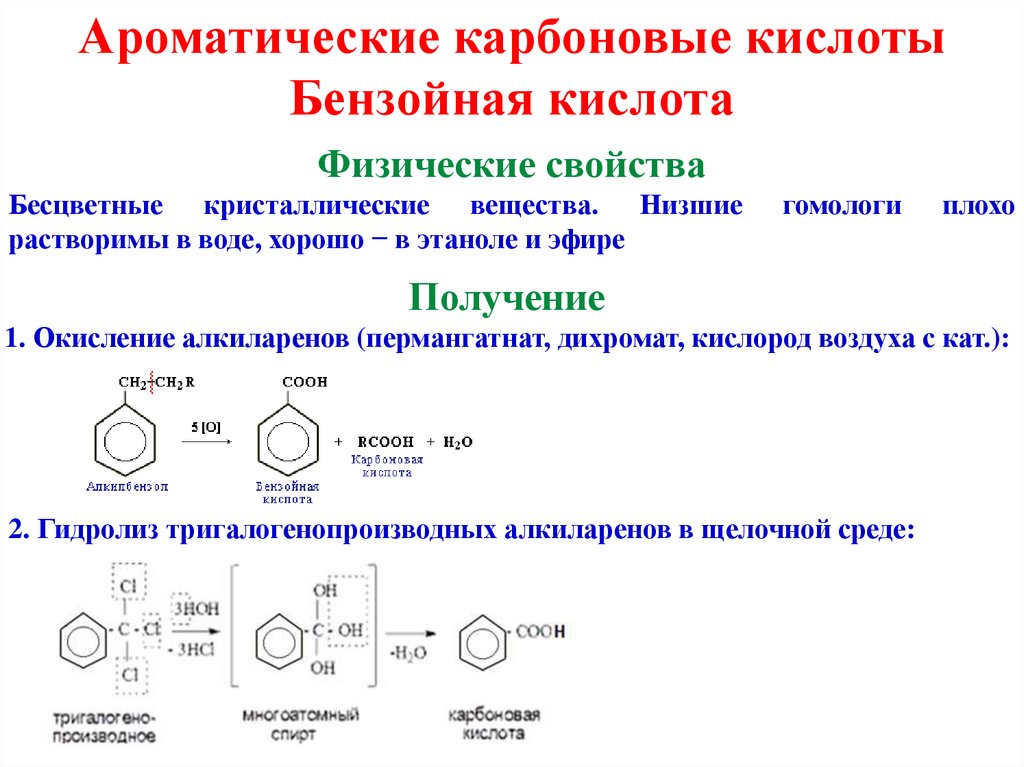
Ароматические карбоновые кислотыБензойная кислота
Физические свойства
Бесцветные кристаллические вещества. Низшие
растворимы в воде, хорошо − в этаноле и эфире
гомологи
плохо
Получение
1. Окисление алкиларенов (пермангатнат, дихромат, кислород воздуха с кат.):
2. Гидролиз тригалогенопроизводных алкиларенов в щелочной среде:
17.
Химические свойстваПо кислотным свойствам сильнее даже ненасыщенных за счет сопряжения.
Характерны все реакции карбоновых кислот.
Но легко декарбоксилируются:
Также все реакции, характерные для бензольного кольца (сульфирование,
нитрование, бромирование и пр.).
18.
Насыщенные дикарбоновые кислотыФизические свойства
Дикарбоновые кислоты – твердые вещества. Низшие члены ряда хорошо
растворимы в воде и лишь незначительно растворяются в органических
растворителях. Растворяясь в воде, образуют межмолекулярные водородные
связи. Представители до С6 – С7 хорошо растворимы в воде, поскольку
полярная карбоксильная группа составляет значительную часть в каждой из
молекул.
Получение
1. Щавелевая
19.
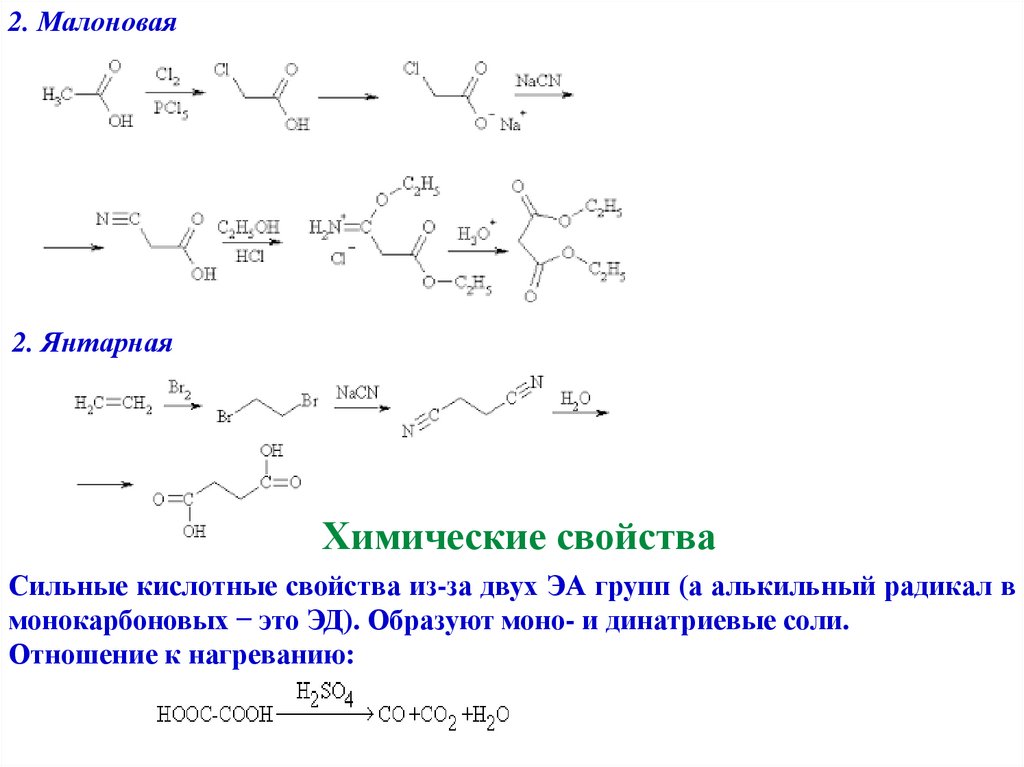
2. Малоновая2. Янтарная
Химические свойства
Сильные кислотные свойства из-за двух ЭА групп (а алькильный радикал в
монокарбоновых − это ЭД). Образуют моно- и динатриевые соли.
Отношение к нагреванию:
20.
21.
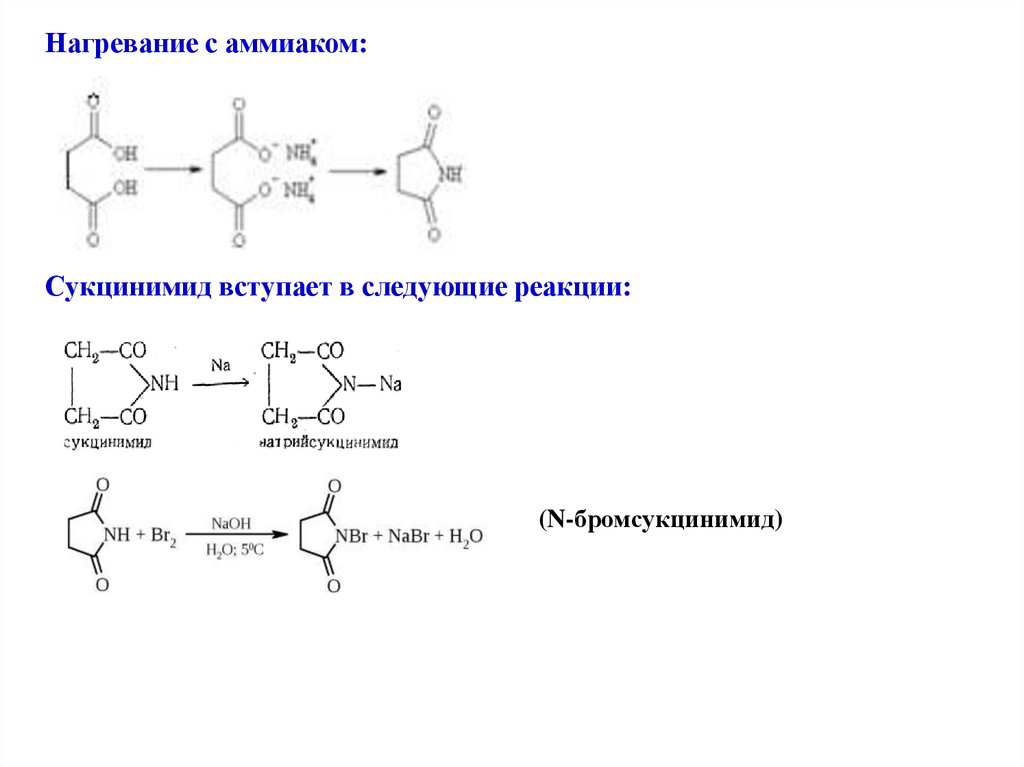
Нагревание с аммиаком:Сукцинимид вступает в следующие реакции:
(N-бромсукцинимид)
22.
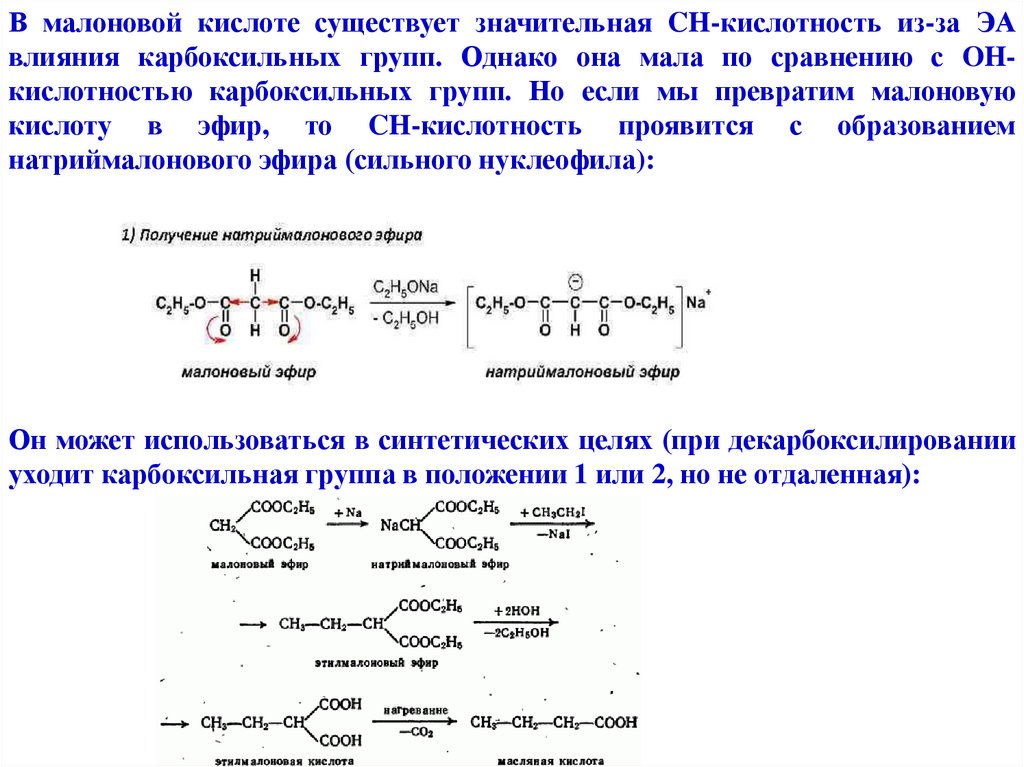
В малоновой кислоте существует значительная CH-кислотность из-за ЭАвлияния карбоксильных групп. Однако она мала по сравнению с OHкислотностью карбоксильных групп. Но если мы превратим малоновую
кислоту в эфир, то CH-кислотность проявится с образованием
натриймалонового эфира (сильного нуклеофила):
Он может использоваться в синтетических целях (при декарбоксилировании
уходит карбоксильная группа в положении 1 или 2, но не отдаленная):
23.
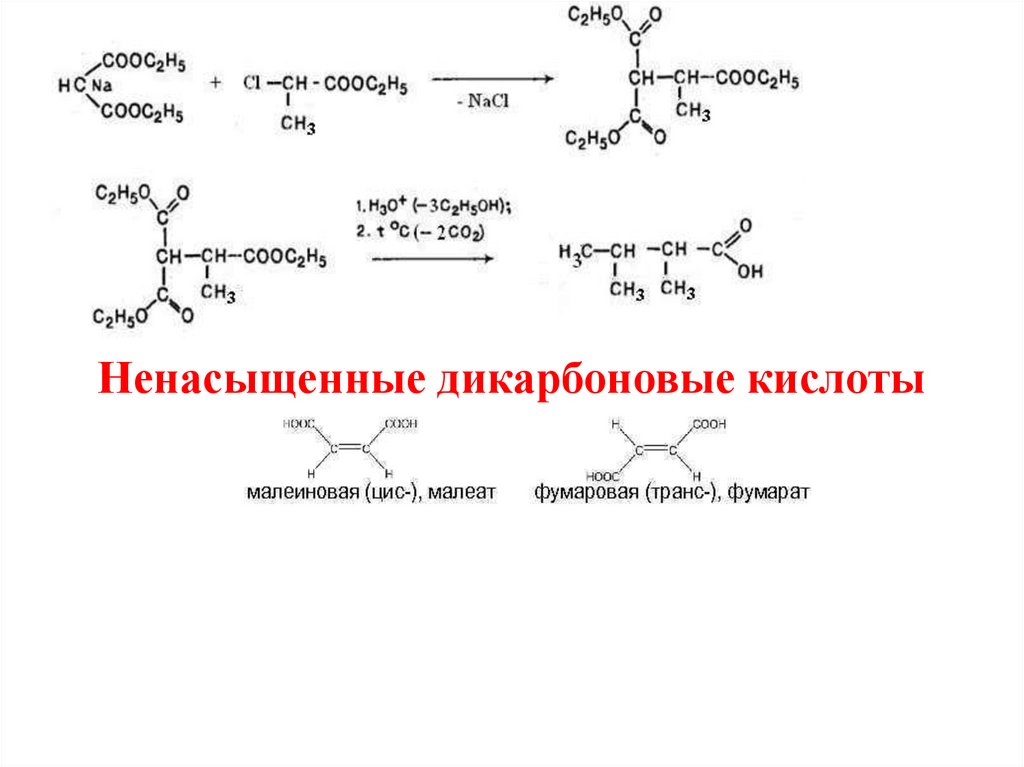
Ненасыщенные дикарбоновые кислоты24.
Физические свойства25.
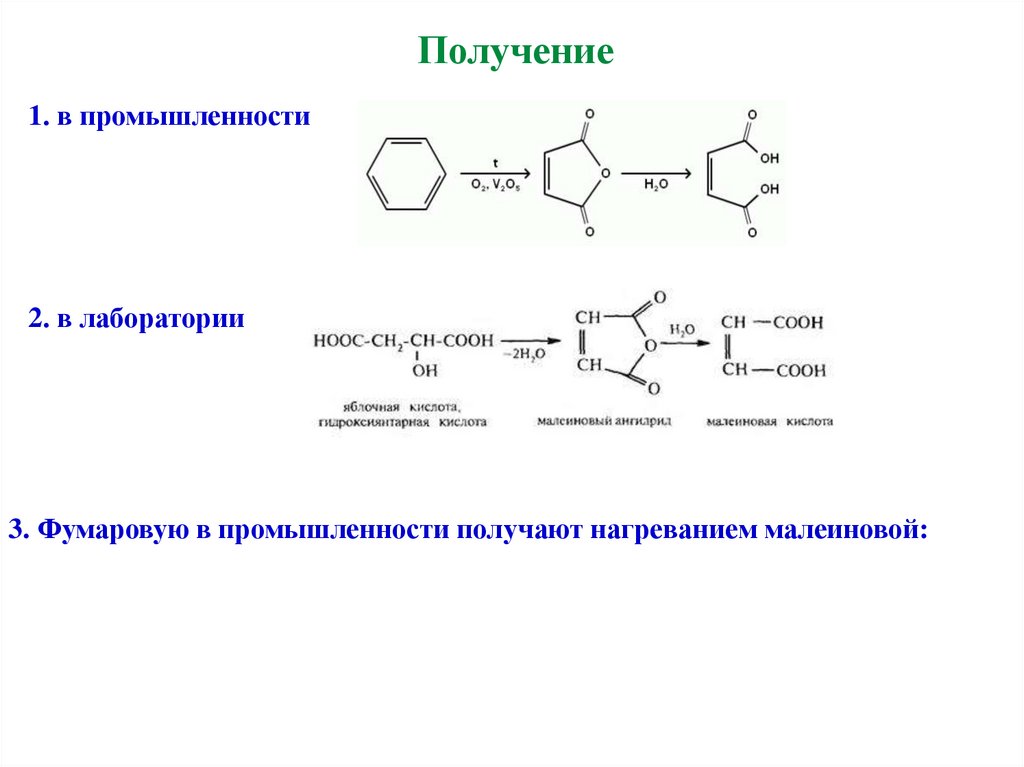
Получение1. в промышленности
2. в лаборатории
3. Фумаровую в промышленности получают нагреванием малеиновой:
26.
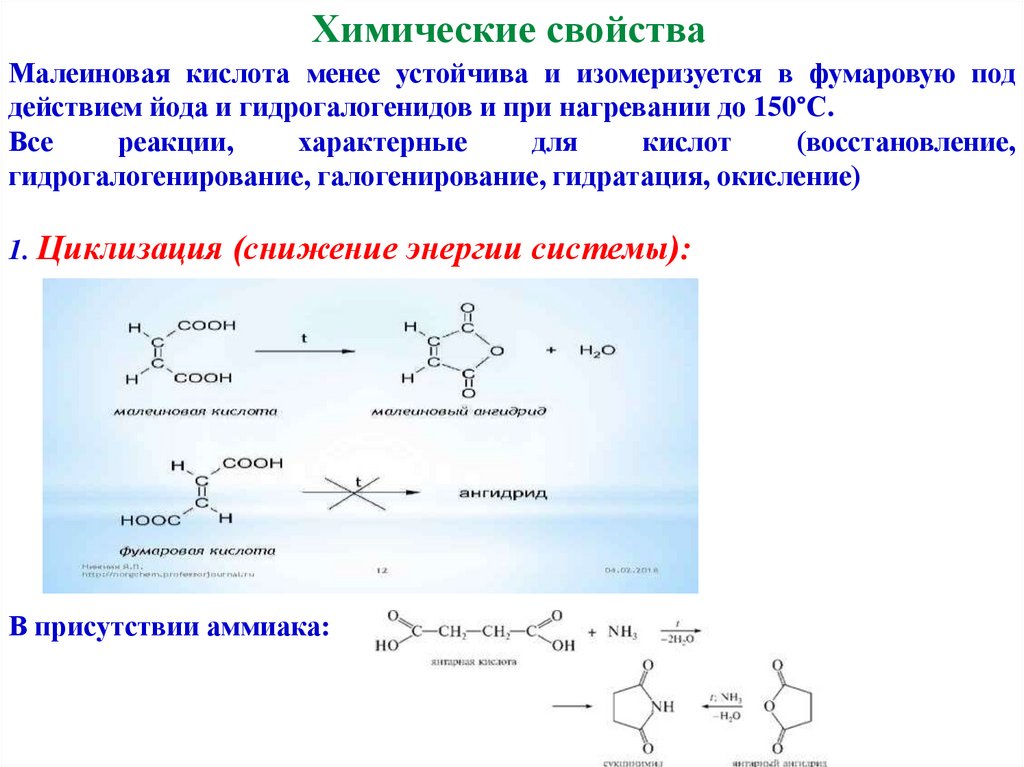
Химические свойстваМалеиновая кислота менее устойчива и изомеризуется в фумаровую под
действием йода и гидрогалогенидов и при нагревании до 150°С.
Все
реакции,
характерные
для
кислот
(восстановление,
гидрогалогенирование, галогенирование, гидратация, окисление)
1. Циклизация (снижение энергии системы):
В присутствии аммиака:
27.
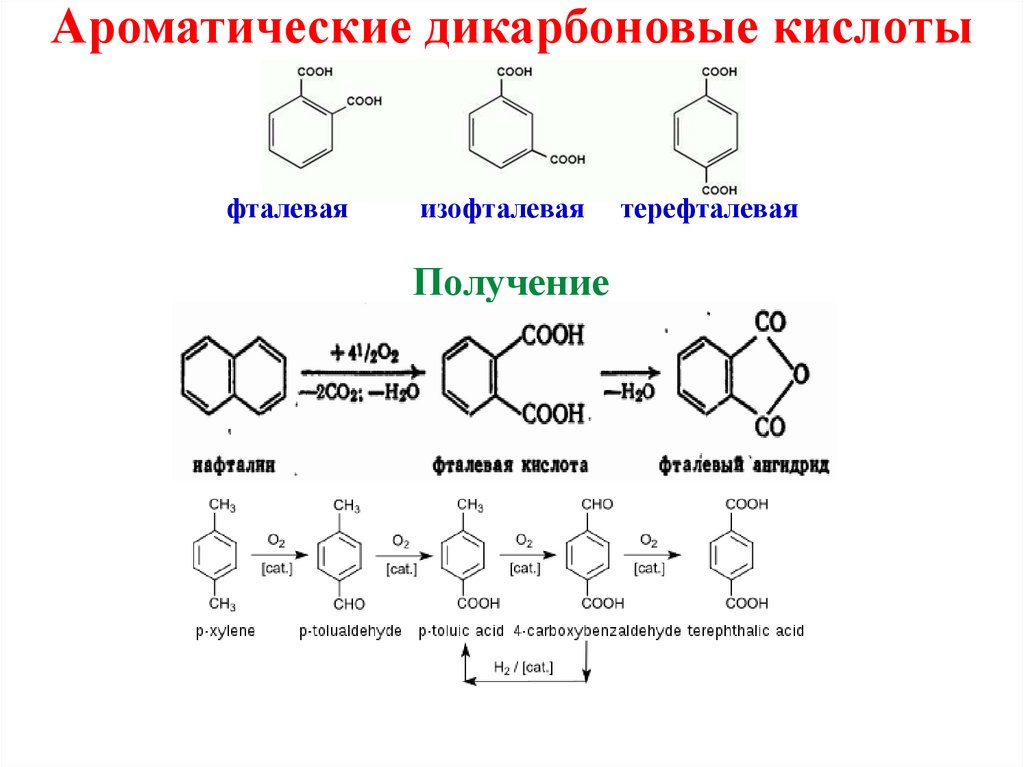
Ароматические дикарбоновые кислотыфталевая
изофталевая
Получение
терефталевая
28.
Химические свойстваСильнее, чем бензойная (pK=4,17), орто-изомер − сам сильный (pK=2,95),
пара − самый слабый (pK=3,51).
1. Образование ангидридов:
В присутствии аммиака:
Синтез аминов по методу Габриэля:












 chemistry
chemistry








