Similar presentations:
Периодическая система химических элементов Д.И. Менделеева
1. Периодическая система химических элементов Д.И. Менделеева
2. МЕНДЕЛЕЕВ Дмитрий Иванович (1834-1907)
выдающийся русский деятель науки и культуры, автор фундаментальныхисследований по химии, химической технологии, физике, метрологии,
воздухоплаванию, метеорологии, сельскому хозяйству, экономике и др.
3. 1 марта 1869г Д.И.Менделеев сформулировал периодический закон:
Свойствапростых тел,
а так же форма и
свойства соединений
находятся
в
периодической
зависимости
от
атомных
весов
элементов
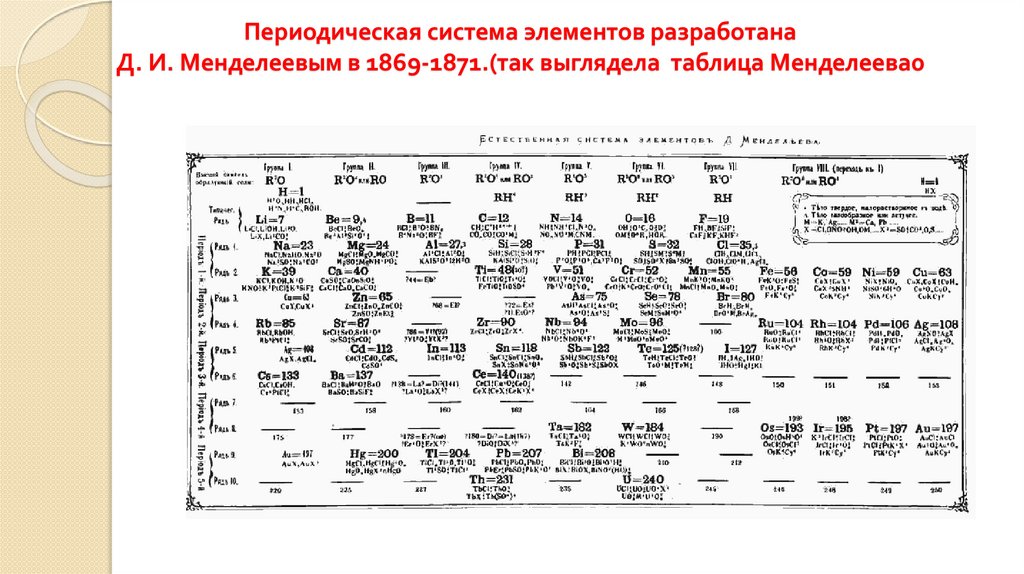
4. Периодическая система элементов разработана Д. И. Менделеевым в 1869-1871.(так выглядела таблица Менделеева0
5.
Есть три основных варианта периодическойтаблицы: короткий (мы его придерживаемся),
полудлинный и длинный. (учебник ст. 178-179)
6.
ТрансформацияКороткопериодная
Длиннопериодная
Естественный
ряда
рядхим.
таблица
химических
элементов
хим.
элементов
элементов
на
периоды
Cверхдлиннопериодная
таблица
хим.
элементов
1I
2II
III
3
IV
4
V
5
VI
6
VII
7
8
1
Н
Нe
Li
Be
B
C
N
Нe
O
F
1
2
3
4
5
6
7
2
8
9
2
Li
Be
B
C
N
O
F
3
4
5
6
7
8
9
10
6
5
7
6
11
12
13
Нe Mg Al
Ne Na
10
2
11
12
Al Si
Ne Na Mg Ne
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
Si
P
S
Cl
Нe
Ar K
Ca Sc
Ti
V
Нe As Se
Cr Mn Fe Co Ni Cu Zn Ga Ge
14
15
16
17
2
18
20
21
22
23
24
Ne
Ca Sc
Ti
V
B Zn
C Ga
N Ge
O As
F Ne
Cr Mn Fe Co Ni Cu
Se Br
22
23
24
B
P
CS
Cl
N
Ar
O
FK
11
12
13
10
14
15
5
16
6
17
7
18
8
19
9
10
20
19
21
25
26
25
27
26
28
27
5
29
28
6
30
29
30
7
31
8
32
31
9
33
2
32
33
10
34
35
34
Kr
36
Si
P
S
Cl
Ar
K
Ca Sc
Ar
Ti
Al
V
Cr
Si Mn
P Fe
S Co
Cl Ar
Ni Cu Zn Ga Ge As Se Br
Al Sr
Si
Kr Rb
P
Y
S Nb
Cl Mo
Ar Tc Ru
Zr
11
12
13
14
15
16
17
18
19
20
22
13
23
14
24
36
13
37
15
39
16
40
K
Ca Sc
Ti
V
Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br
Kr
Ti Rb
V Cr
Co Mo
Ni Cu
Zn Ga
As Cd
Se Br
Kr Sb Te
Sr Mn
Y Fe
Zr Nb
Tc Ru
Rh Ge
Pd Ag
In Sn
19
20
22
23
24
36
22
3 Na Mg Al
4
4
5
9 VIII10
21
25
26
27
28
21
18
29
30
31
32
15
25
33
16
26
34
Rb Zn
Sr Ga
Y Ge
Zr Nb
Tc Ru
Cu
As Mo
Se Br
Kr Rh Pd Ag
Kr Cd In
Sn Sb Te
37
29
50
38
30
39
31
40
32
33
41
42
34
43
35
44
36
45
46
47
36
48
49
51
52
17
27
35
I
53
18
28
29
23
37
30
24
38
31
25
39
32
26
40
33
27
41
34
28
42
35
29
43
30
44
31
45
14
38
32
46
33
47
34
48
17
41
35
49
18
42
36
50
43
51
44
52
Xe
Zr Nb
Tc Ge
Ru Rh
Pd Pm
Ag Sm
Cd Eu
In Gd
Sn Tb
Sb Dy
Te Ho
I Xe
Cs Mo
Ba La
Pr Nd
Er Tm Yb
54
40
44
58
45
59
46
60
Hf
Ta Mo
W Pm
Re
Os
Ir Gd
Pt Au
Tl Pb
Bi Yb
Po
At
Sr La
Y Ge
Zr Nb
Tc Sm
Ru Rh
Pd
Rb
Cs Ba
Pr
Nd
Eu
Tb
Dy
Er Tm
Hf Ta W Re Os
Ag Hg
Cd Ho
In
Sn
Sb
Te Lu
I Rn
Xe
Ir
Pt Au Hg Tl
Pb Bi Po At Rn Fr Ra
55
37
77
78
82
56
38
57
39
40
58
72
41
59
73
74
42
60
43
61
75
44
62
76
45
63
77
46
64
78
79
65
47
80
66
48
81
67
49
82
68
50
83
69
51
84
70
52
85
71
53
86
72
54
41
55
73
42
56
74
43
57
75
76
Fr Cd
Ra Ac
Cs
Ba
La
Rf Db
Bh
Hs
Mt
? Au
? Hg
? Es
? Fm
? Md
? No
? At
? Rn
? Db Sg Bh Hs Mt
In Th
Hf
Sn
Sb
Ta Sg
W
Te
Re
I Os
Xe Am
Ir Cm
Pt
Xe
Tl
Pb
Bi
Po
Ag
Pa
U Np
Pu
Bk
Cf
Lr
Rf
55
47
87
56
48
88
89
57
49
104
72
50
90
105
73
51
91
106
74
52
92
107
75
53
93
108
76
54
94
109
77
95
110
78
96
111
79
54
97
112
80
98
113
81
99
114
82
100
115
83
101
116
84
102
117
85
103
118
86
104
Fr Ra
Rf Db
Hs Mt
? Au
? Hg
? Tl
?
Cs
Ba Ac
La Hf
Ta Sg
W Bh
Re Os
Ir Pt
? Bi
?
Pb
? At
? Rn
?
Po
87
55
114
82
116
84
88
56
89
57
104
72
105
73
106
74
107
75
108
76
109
77
110
78
111
79
112
80
113
81
115
83
117
85
Pr
Eu Gd
Rn
Au
Tl Ge
Pb
Bi Nd
Po
At Sm
Rn
Fr Hg
Ra Ac
Rf Db
Sg Pm
Bh
Hs Mt
? Tb
? Dy
? Ho
? Er
? Tm
? Yb
? Lu
?
79
87
80
88
81
89
58
82
104
59
83
105
60
84
106
61
85
107
62
86
108
63
109
64
110
65
86
111
66
112
Th Pa U Np Pu Am Cm Bk
? Cf
?
7 Fr Ra Ac Rf Db Sg Bh Hs Mt ?
90
91
92
93
94
95
96
97
98
87
88
89
104
105
106
107
108
109
110
111
112
67
113
68
114
69
115
70
116
71
117
Es
? Fm
? Md
? No
? Lr
?
99
113
100
114
101
115
102
116
103
117
105
106
107
108
109
47
61
79
48
62
80
49
63
81
50
64
51
65
83
52
66
84
53
67
85
54
68
86
?
?
?
?
?
?
?
?
?
110
111
112
113
114
115
116
117
118
118
86
?
118
?
118
Ge Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
58
59
60
Th Pa
U
90
92
91
61
62
63
64
65
66
Np Pu Am Cm Bk Cf
93
- s элементы
94
95
96
97
98
67
68
69
70
71
Es Fm Md No Lr
99
100
101
- р элементы
102
103
- d элементы
- f элементы
Повтор
Далее
Пуск
69
87
70
88
7.
Создание периодической системы позволило Д. И.Менделееву предсказать существование двенадцати неизвестных в
то время элементов: скандия (экабору), галлия (экаалюминием),
германия (экасилицию), технеция (экамарганца), гафния (аналога
циркония), полония (экателуру), астата (экайоду), франция
(экацезию), радия (экабарию), актиния (экалантану) протактиния
(экатанталу).
Д. И. Менделеев вычислил атомные веса этих элементов и описал
свойства скандия, галлия и германия.
Пользуясь только положением элементов в системе, Д. И.
Менделеев исправил атомный вес бора, урана, титана, церия и
индия.
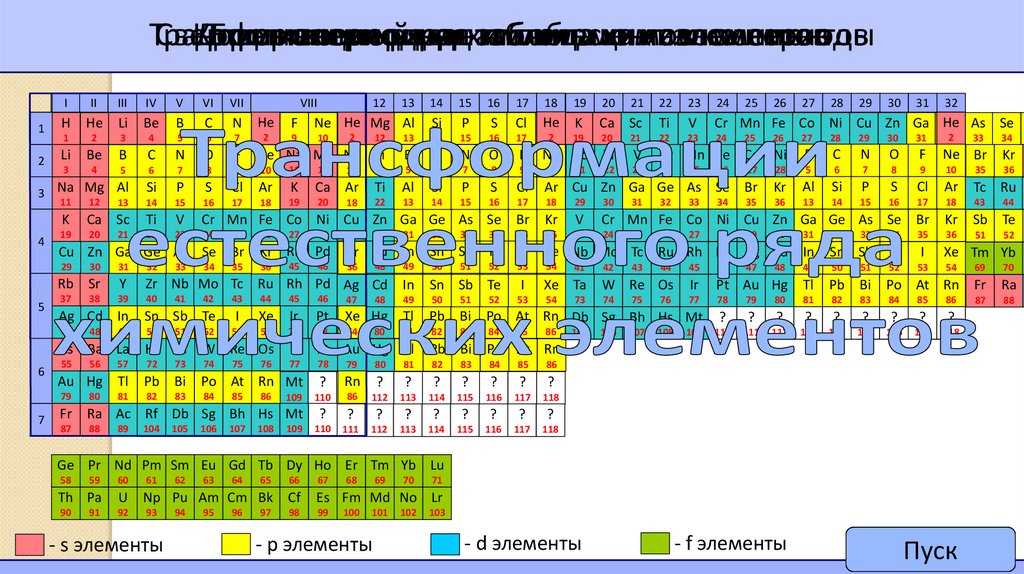
8. Периодическая система – графическое изображение периодического закона
9. Современный вариант периодической системы элементов
10. В периодической системе каждый химический элемент занимает свое место(ячейку).
11.
В современном варианте отдельно вынесеныхимические элементы Лантаноиды и
Актиноиды.
Лантаноиды близнецы лантана, порядковый
номер 57.
Актиноиды близнецы актиния, порядковый
номер 89
12.
Гр у п п ы э л е м е н т о вI
1
1 (H)
2
2
3
3
4
5
6
7
III
IV
V
VI
VII
1
Н
В
5
10,811
Бор
С
6
14,0067
14 Р
30,9738
Углерод
Si
7
N
12,0112
28,086
Кремний
15,9994
15 S
32,064
Азот
Фосфор
8
O
VIII
1,00797
Водород
9
F
18,9984
16 Cl
35,453
Кислород
Сера
Фтор
Хлор
He
2
4,0026
Гелий
Ne 10
20,163
Неон
17 Ar
18
39,948
Аргон
4
34
33
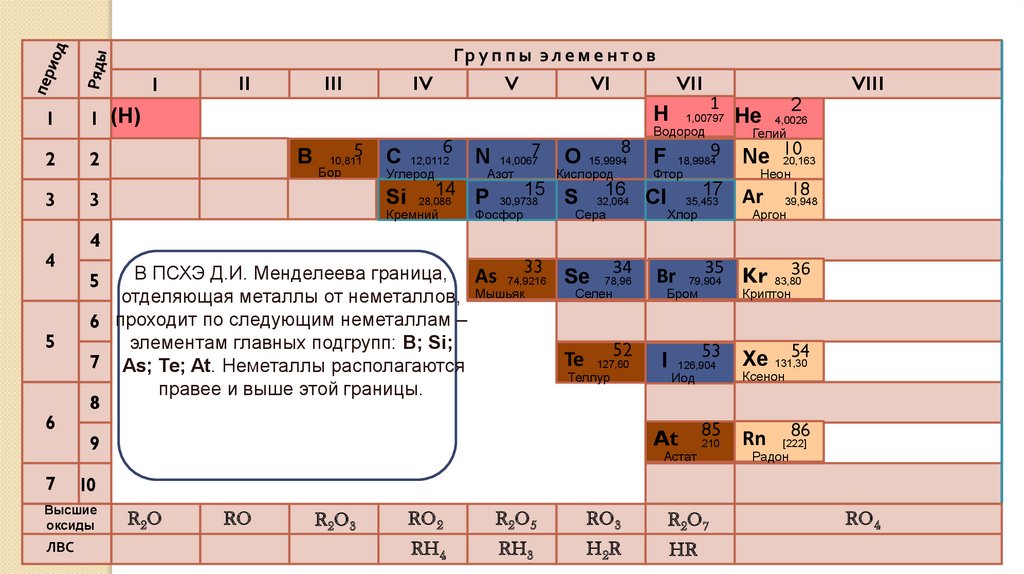
В ПСХЭ Д.И. Менделеева граница, As 74,9216
Se 78,96
Селен
отделяющая металлы от неметаллов, Мышьяк
6 проходит по следующим неметаллам –
элементам главных подгрупп: B; Si;
52
Te 127,60
7 As; Te; At. Неметаллы располагаются
Теллур
правее и выше этой границы.
8
5
35
Br
79,904
Бром
I
53
126,904
Иод
At
9
Астат
85
210
Kr
36
83,80
Криптон
54
Xe 131,30
Ксенон
Rn
86
[222]
Радон
10
Высшие
оксиды
ЛВС
II
R2O
RO
R2O 3
RO2
R2O 5
RO3
R2O 7
RH4
RH3
H 2R
HR
RO4
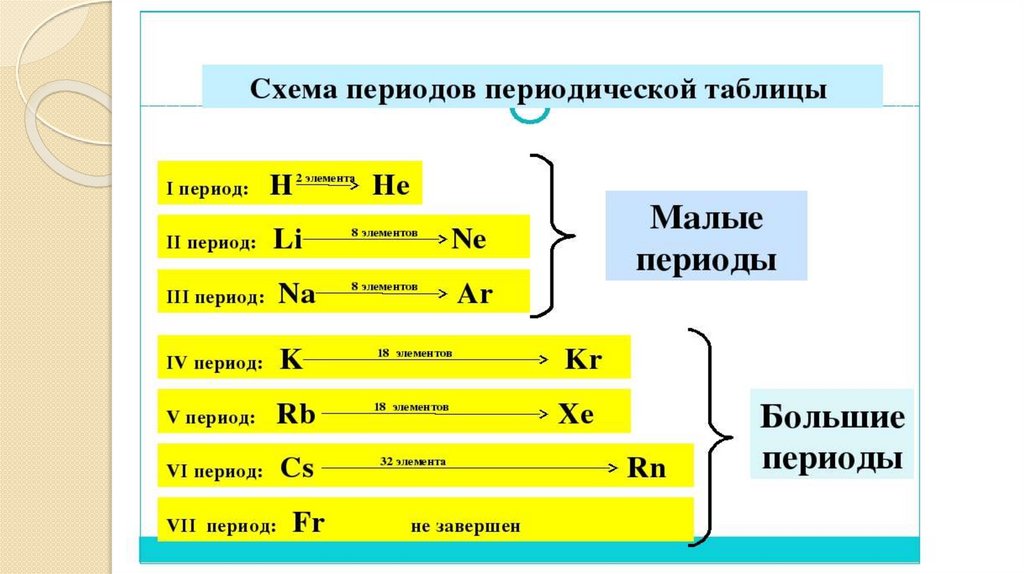
13. Период-горизонтальный ряд химических элементов, в котором слева на право ослабевают металлические и усиливаются неметаллические
свойства. Открываемпериодическую систему в учебнике и
работаем с ней. Определяем число
элементов в каждом периоде.
14.
15. ряды
Периодымалые
-содержат от 2 до 8
элементов
большие
-содержат более 8
элементов
I, II, III, периоды
VI, V VI, VII,
периоды
ряды
четные
нечетные
16. Изменение свойств элементов в периоде слева на право
1. Усиливаются неметаллические свойства иослабевают металлические
2. Уменьшается радиус атома
3. Увеличивается заряд ядра
17. Задание 1.У какого из элементов более выражены металлические свойства
А) литийВ) фтор
С) радий
Д) бор
Е) франций
18. Задание 2. Между радиусами атомов поставить знаки: больше или меньше
А) радиус атома натрияВ) радиус атома фтора
С) радиус атома серы
Д) радиус атома кальция
Е) радиус атома бария
радиус атома магния
радиус атома брома
радиус атома фосфора
радиус атома хрома
радиус атома осмия
19.
Группа-вертикальный ряд химическихэлементов, в котором сверху вниз
усиливаются металлические свойства
20.
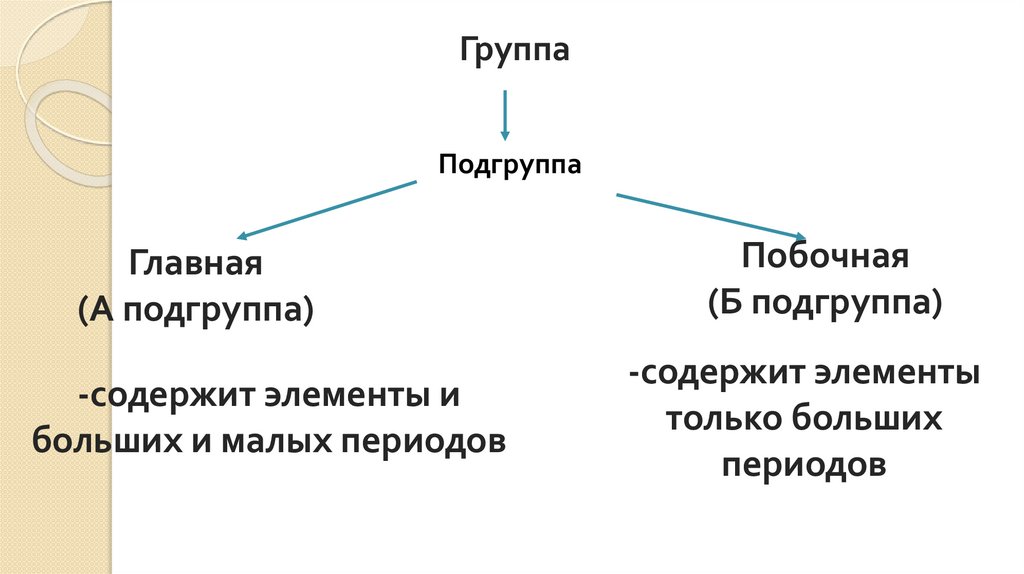
ГруппаПодгруппа
Главная
(А подгруппа)
-содержит элементы и
больших и малых периодов
Побочная
(Б подгруппа)
-содержит элементы
только больших
периодов
21. Группу обозначают римской цифрой
НапримерI А- первая группа, главная подгруппа
IIБ(или В)-вторая группа, побочная подгруппа .
22. Исторические названия некоторых подгрупп
IA- подгруппа щелочных металловII A - подгруппа щелочно-земельных металлов
VI A -подгруппа халькогенов
VII A - подгруппа галогенов
VIII A – подгруппа благородных газов или
инертных элементов
23. Изменение свойств элементов в группе сверху, вниз
1. Усиливаются металлические свойства элементов2. Увеличивается радиус атома
3. Увеличивается заряд ядра
24. Задание 3.У какого из элементов более выражены металлические свойства
А) литийВ) фтор
С) радий
Д) бор
Е) франций
25. Задание 4. Между радиусами атомов поставить знаки: больше или меньше
А) радиус атома литияВ) радиус атома таллия
С) радиус атома фосфора
Д) радиус атома хлора
Е) радиус атома радона
радиус атома цезия
радиус атома алюминия
радиус атома сурьмы
радиус атома вольфрама
радиус атома криптона
26.
27.
28. Задание 5.
Запишите положение в Периодической системе Д. И.Менделеева для следующих элементов: водород,
хром, кремний, кальций, менделевий.























 chemistry
chemistry








