Similar presentations:
Строение атома
1.
• Эксперименты, подтверждающие сложноестроение атома.
• Модели атома.
• Теория атома водорода по Бору.
• Атом водорода в квантовой механике.
• Спин электрона.
• Принцип Паули.
• Периодическая система элементов.
• Рентгеновское излучение.
• Лазеры.
2.
Эксперименты, подтверждающиесложное строение атома.
1. Иоганн Бальмер, 1885 г.
Наблюдал с помощью трубки Гейсслера
в видимой части спектра излучения
атома водорода 11 линий, длины волн
которых связаны определенной
закономерностью:
2
n
n B 2
,
n 4
B const ,
n 3,4,5...
3.
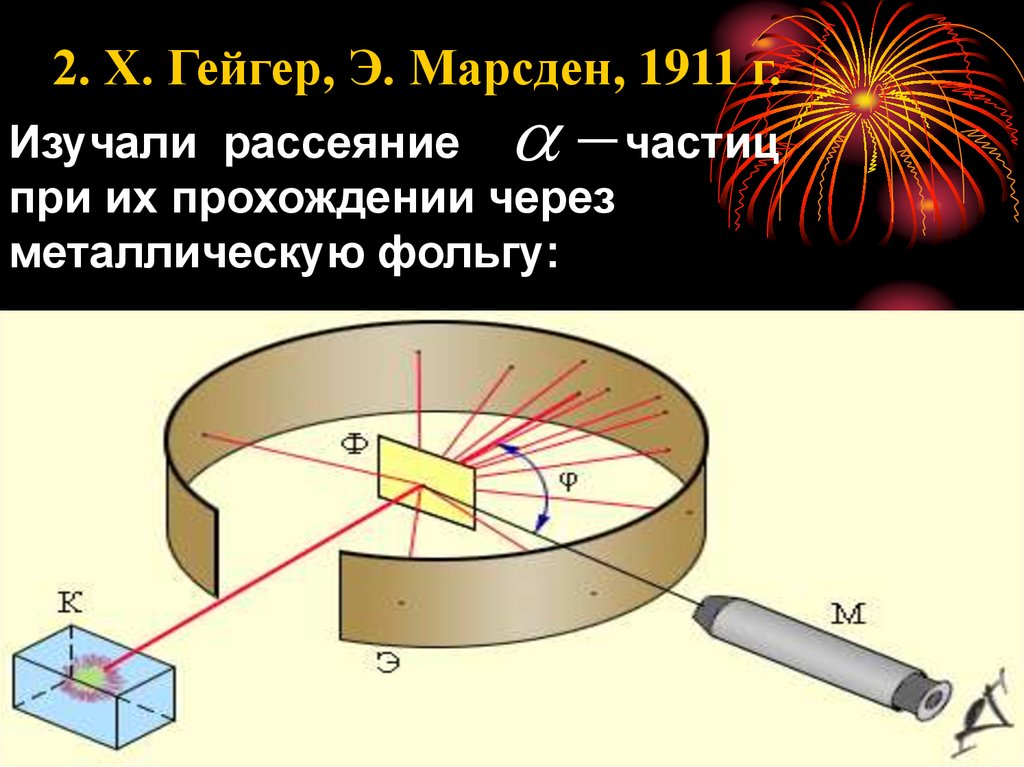
2. Х. Гейгер, Э. Марсден, 1911 г.Изучали рассеяние
частиц
при их прохождении через
металлическую фольгу:
4.
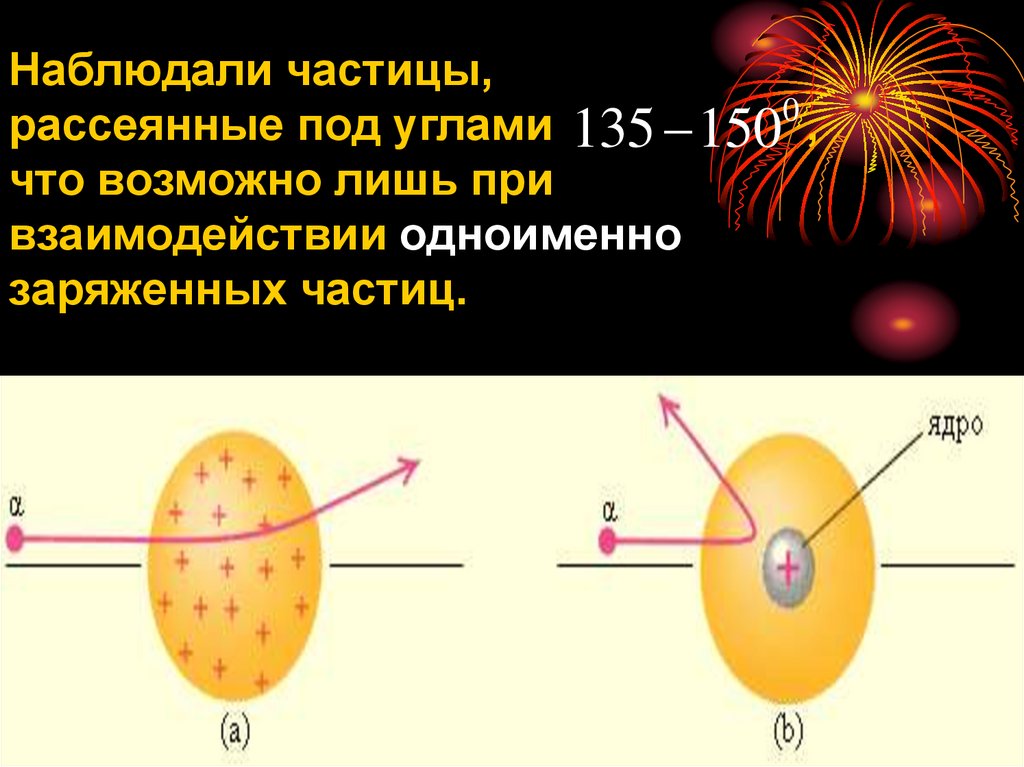
Наблюдали частицы,рассеянные под углами 135 1500 ,
что возможно лишь при
взаимодействии одноименно
заряженных частиц.
5.
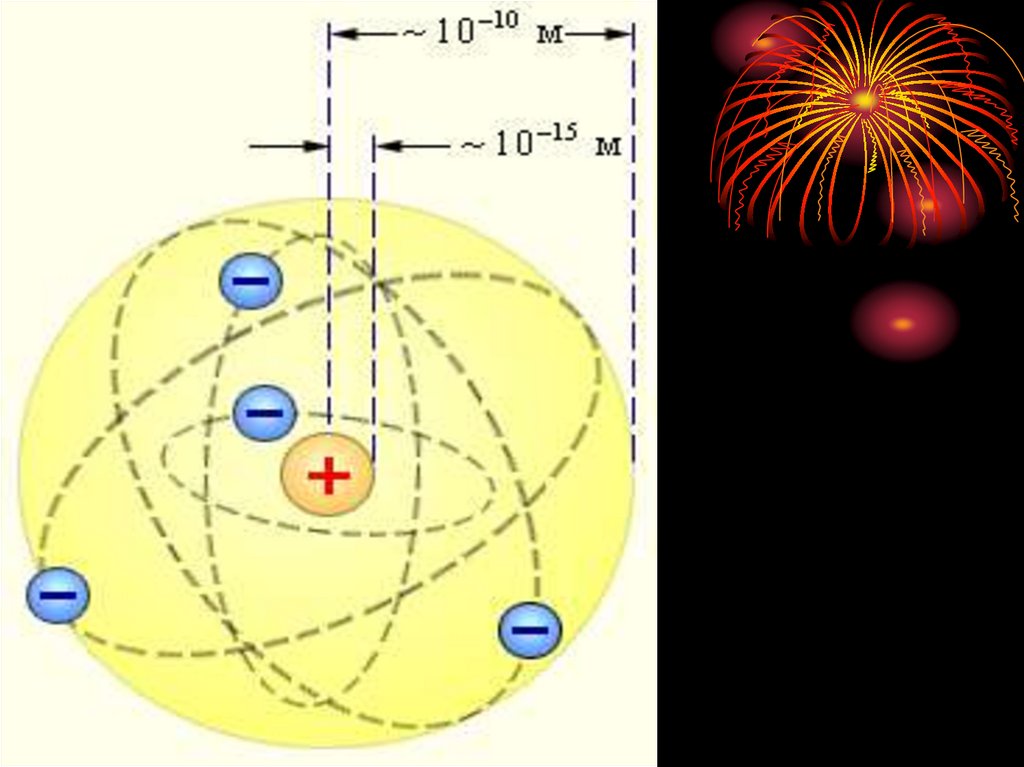
Дж.Дж.Томсон
(1903 г.) :
• атом - положительный шар
радиусом ~ 10 10 м ,
внутри него у положения
равновесия колеблются
электроны.
6.
Эрнест Резерфорд
(1911 г.):
•вокруг положительного ядра
с зарядом Zе и размером
~ 10 15 10 14 м
по замкнутым орбитам с
ускорением движутся электроны,
они излучают энергию;
атом – неустойчивая система.
7.
8.
9.
Нильс Бор, 1913 г.• Первый постулат : существуют
стационарные состояния атома, в
которых он не излучает энергию.
• В этом состоянии электрон имеет
квантованные значения момента
импульса
m r n
n 1,2,3...
m,
- масса и скорость
электрона,
- радиус
его орбиты.
r
10.
• Второй постулат (правило частот):• при переходе атома из одного
стационарного состояния в другое
излучается или поглощается фотон
с энергией
h Wn Wm ,
Wn ,Wm
энергия стационарных
состояний.
Wn Wm излучение фотона,
Wm Wn поглощение фотона.
11.
Частота излучаемых(поглощаемых) спектральных
линий
Wm Wn W
;
h
h
длина волны спектральных линий
hc
.
W
12.
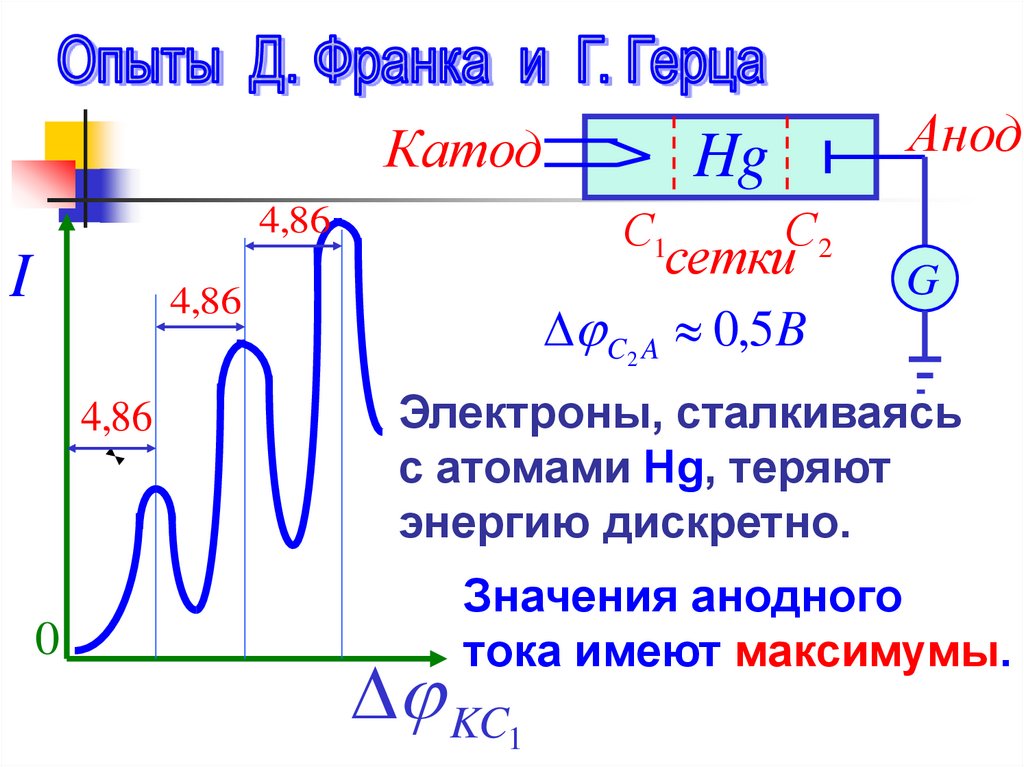
Дискретность значенийэнергии атомов экспериментально доказана
при изучении методом
задерживающего потенциала
столкновения электронов
с атомами газов в опытах
Д. Франка и Г.Герца (1913г.)
13.
КатодI
0
С2
сетки
C2 A 0,5B
4,86
4,86
Hg
С1
4,86
Анод
G
Электроны, сталкиваясь
с атомами Hg, теряют
энергию дискретно.
Значения анодного
тока имеют максимумы.
KC1
14.
Минимальная энергия, которуюможет поглотить атом Hg в
основном состоянии, равна 4,86 эВ.
Возвращаясь из возбужденного
в основное состояние, атом излучает
фотон с длиной волны
254нм.
15.
Задача. Используя теорию Бора, рассчитать энергию атома водорода встационарных состояниях.
e
Первый постулат Бора:
r
(1) m r n , n 1,2,3..
Кулоновская сила сообщает
электрону нормальное ускорение:
e
m
(2) k 2
r
r
2
2
16.
Решая систему (1-2), получим:радиус n ой орбиты электрона
2
2
2
(3) rn 2 n a0 n , где
ke m
11
а0 5,29 10 м радиус первой
орбиты;
и скорость электрона на n ой
2
орбите
ke 1
n
.
n
17.
Полная энергия атома W W W ,к
p
кинетическая энергия электрона
m
Wк
,
2
2
потенциальная энергия взаимодейст2
вия ядра и электрона
Учитывая,что k
e
W p k
.
2
2 r
e
m
2r
2
2
e
W k .
2r
, получим
18.
Используя (3), запишем энергиюатома водорода для n ого
стационарного состояния
2 4
k em 1
1
Wn
2 13,55 2 ( эВ).
2
2
n
n
Энергия атома квантуется, т.е.
принимает дискретные значения .
Теория справедлива и для водородо
2
подобных систем ( He , Li ).
19.
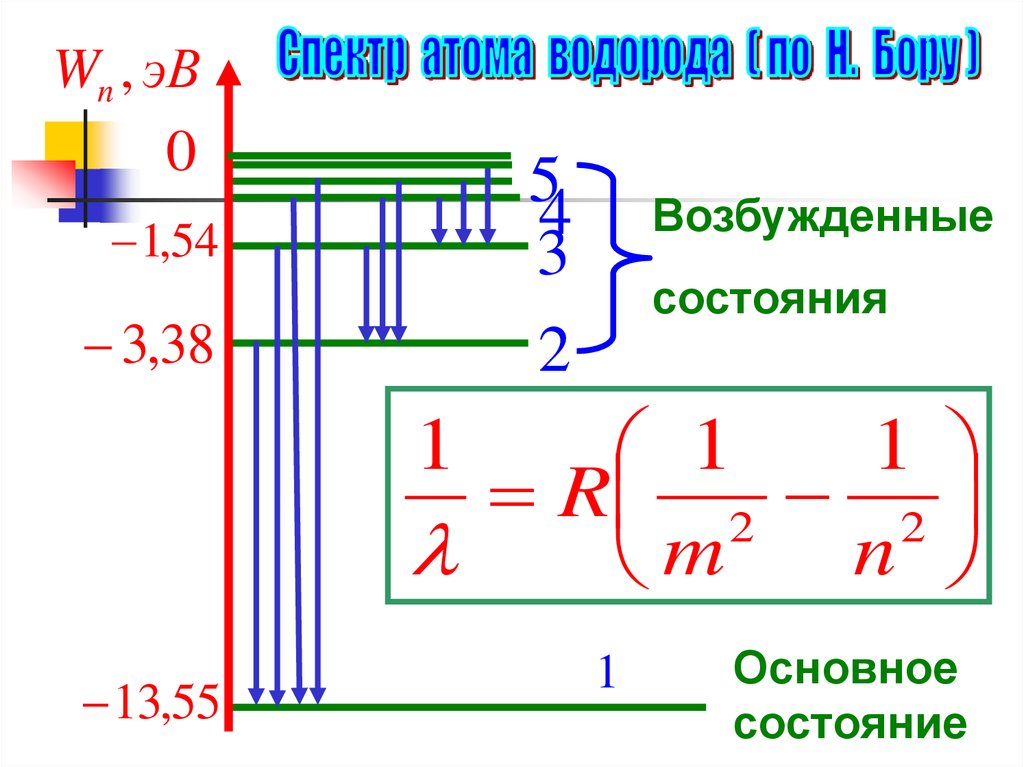
20.
Wn , эВ0
5
4
3
2
1,54
3,38
Возбужденные
состояния
1
1
R 2 2
n
m
1
13,55
1
Основное
состояние
21.
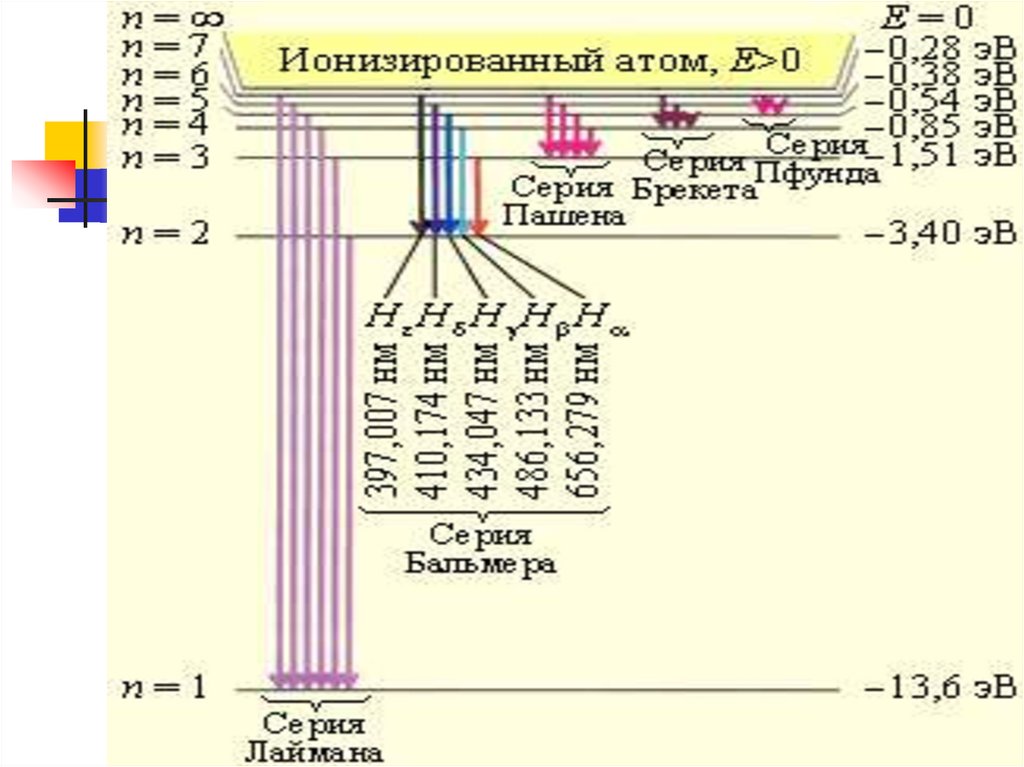
R – постоянная Ридберга;1
R 1,097 10 м ;
7
15 1
Rc 3,29 10 c ;
Линии объединяют в серии.
Границы серии определяют
при
n m 1
и
n .
22.
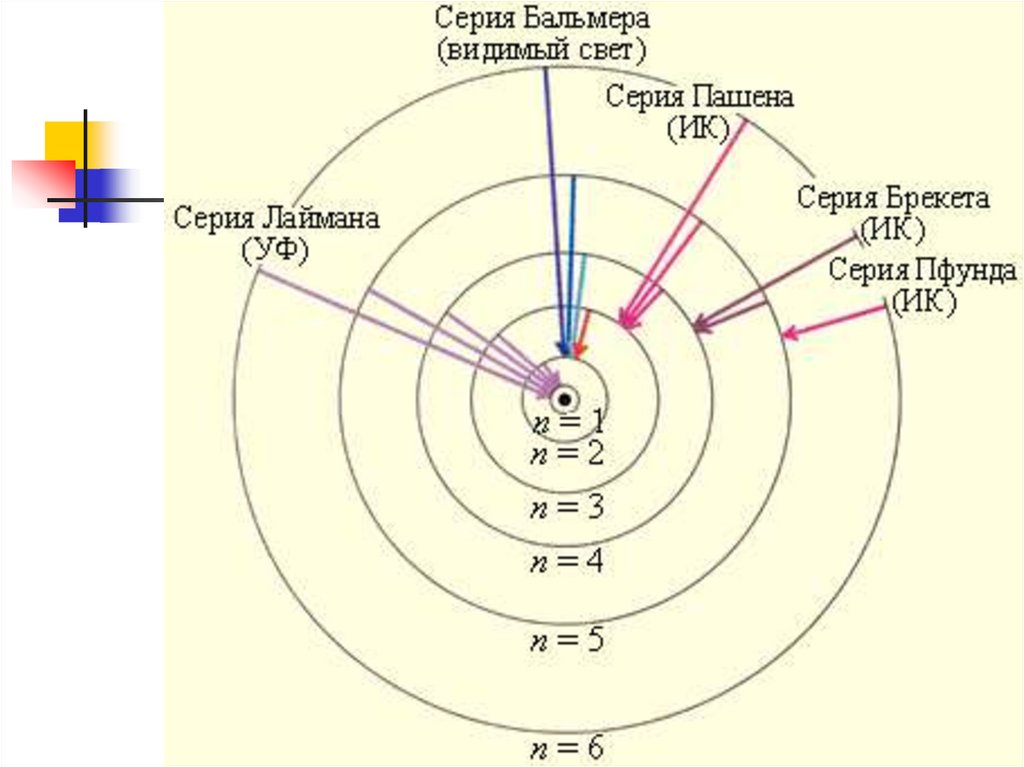
Серии спектральных1 линий:
1
R 2 2 - Лаймана ( УФ )
1 n
n
2
,
3
,
4
,...
1
1 1
R 2 2 - Бальмера (видимая)
2 n
n 3,4,5,...
1
1 1
R 2 2 - Пашена
3 n
1
1 1
R 2 2 - Брэкета
4 n
1
1 1 - Пфунда
R 2 2
5 n
1
( ИК )
23.
24.
2m1
2 W U 0
стационарное уравнение Шредингера.
Потенциальная энергия взаимодействия
электрона с ядром
2
ke
U r
.
r
2 1 :
2
2m
ke
2 W
r
2
0. 3
25.
При решении уравнения (3) дляэлектрона в центральноcимметричном поле используют cферическую СК: r , , .
Результаты решения уравнения
Шредингера для атома водорода
в указанных координатах:
1) момент импульса электрона в
атоме квантуется
L ( 1) , 0,1,2,...(n 1)
орбитальное квантовое число;
26.
2) вектор моментаимпульса
электрона
L имеет такие
ориентации в пространстве, при
которых проекция его на направление внешнего магнитного поля,
принимает квантованные
значения, кратные :
L z m ,
m 0, 1, 2,...,
магнитное квантовое число;
27.
3)энергия электрона в атоме водородаквантуется
2
4
k me
1
Wn
,
2
2
2
nr 1
nr
радиальное квантовое
число.
Обозначив n nr 1 ,
получим совпадение с выводами
теории Бора.
28.
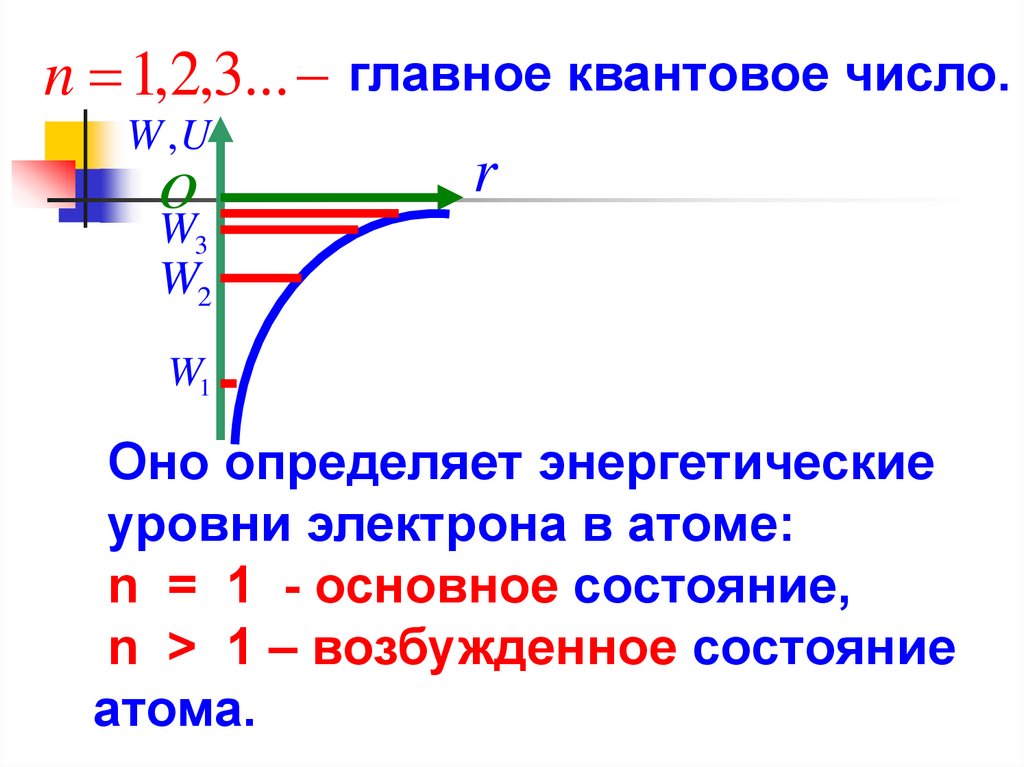
n 1,2,3... главное квантовое число.W ,U
o
W
r
3
W2
W1
Оно определяет энергетические
уровни электрона в атоме:
n = 1 - основное состояние,
n > 1 – возбужденное состояние
атома.
29.
30.
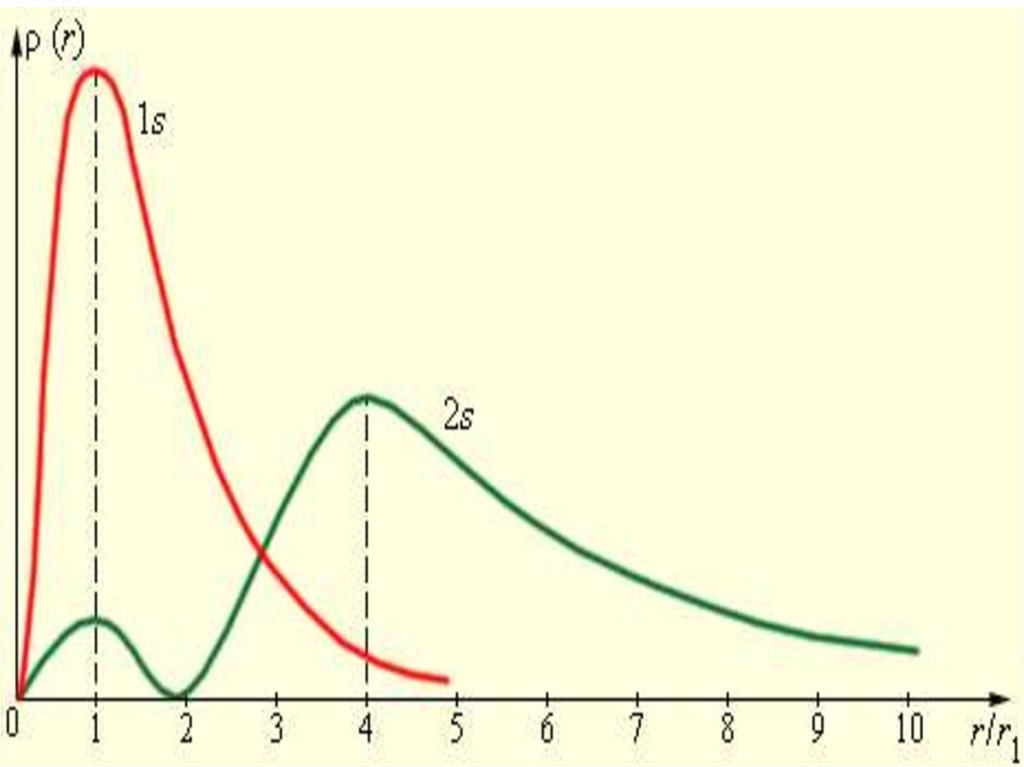
Электрон “размазан” по объему атома.Плотность электронного облака
определяет вероятность
нахождения электрона в
разных точках :
n, определяют размер и форму
облака,
m - его ориентацию.
31.
1S m=02p m=0
2S m=0
2p m=1
32.
Состояния электрона в атоме:0 s - cостояние;
1
p – состояние;
2 d - состояние;
3 f - состояние.
1 s – состояние электрона в атоме
сферически симметрично, определяется только расстоянием электрона от
ядра
r / a0 где
100 r Ce
,
1
C
находят из условия
3
a0
нормировки.
33.
Исследуя на экстремум2
dw
dr
r
2
exp 4 r ,
3
a
a0
1
получим,что вероятность обнаружить
электрон на расстоянии a0 от ядра
– максимальна.
34.
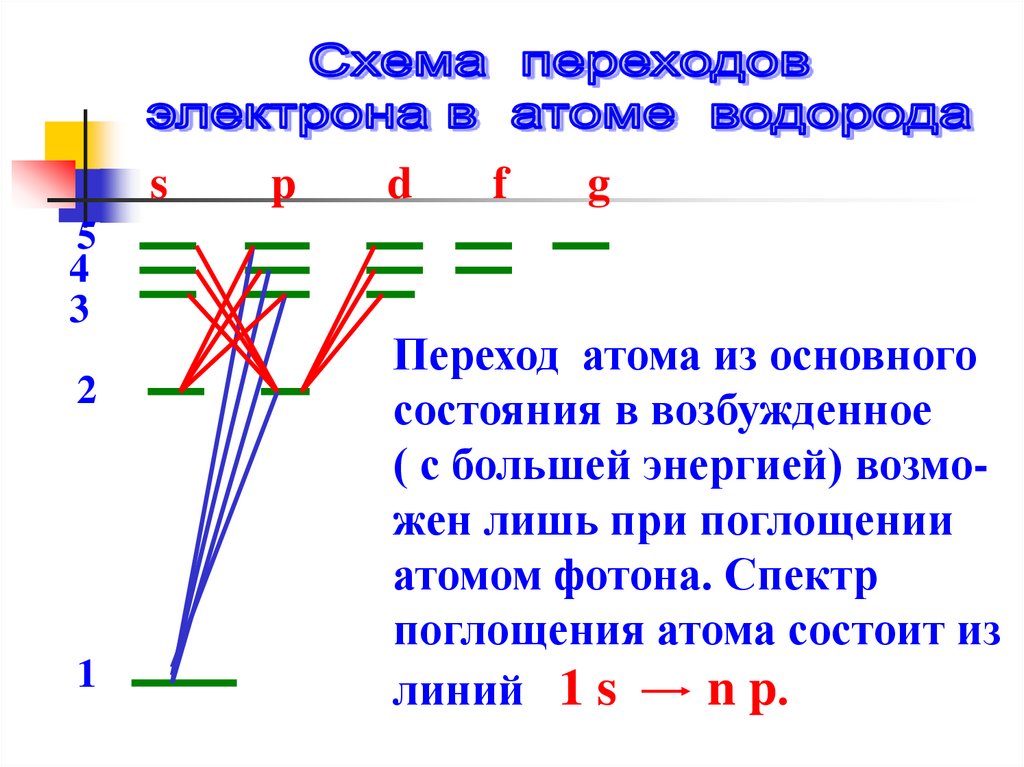
Ограничивает число возможныхпереходов электронов в атоме,
определяющих излучение или
поглощение фотона.
Для электрона в поле ядра разрешены переходы :
1) при изменении орбитального
квантового числа 1;
2)при изменении магнитного
квантового числа m 0, 1.
35.
С учетом правила отбораполучим переходы для:
серии Лаймана
np 1s (n 2,3,...);
серии Бальмера
np 2s, ns 2 p,
nd 2 p (n 3,4,...).
36.
s5
4
3
2
1
p
d
f
g
Переход атома из основного
состояния в возбужденное
( с большей энергией) возможен лишь при поглощении
атомом фотона. Спектр
поглощения атома состоит из
линий 1 s
n p.
37.
О. Штерн, В. Герлах (1922г.) подтвердили пространственное квантование L в магнитном поле.e
e
p
L
(
1
)
m
ФП
2m
2m
S
N
pm Б 1 ,
Д
24 Дж
Ag
Б 9,274 10
Тл
магнетон Бора.
Если в 1s состоянии 0, L 0,
то почему pm Б ?
38.
С. Гаудсмит и Дж. Уленбек (1925г.)предположили наличие у электрона,
кроме орбитального L , собственного
момента импульса Ls спина.
39.
- квантовая величина,не имеет классического
аналога, это внутреннее
свойство частицы.
Наличие спина обосновано
релятивистским волновым
уравнением.
Спину Ls электрона соответствует
собственный магнитный момент
pm s .
40.
Из выводов квантовой механикиследует: c п и н к в а н т у е т с я
по закону
Ls s s 1 , s 1 / 2
спиновое квантовое
Lsz ms , ms 1 / 2
магнитное спиновое
квантовое число.
41.
В. Паули (1925г.): в любом атомене может быть двух электронов
с одинаковым набором
четырех квантовых чисел
n, , m , ms .
Число электронов с данным
набором квантовых чисел
Z n, , m , ms 0 или 1
42.
Квантовые числа, определяющиесостояние электрона в атоме:
главное
(n 1,2,3...),
n
орбитальное
магнитное
спиновое
m
ms
0,1,2,..., n 1 ,
m 0, 1, 2,... ,
(ms 1 / 2).
43.
Д.И. Менделеев ( 1869 г.)Периодичность свойств химических
элементов связана с периодичностью
расположения электронов в атоме.
44.
Положения теории периодическойсистемы:
1) порядковый номер элемента равен
числу электронов в атоме;
2) состояние электронов в атоме
определяют квантовые числа
n, , m , ms ;
3) заполнение электронами
энергетических состояний происходит
в соответствии с принципом Паули.
45.
Электронный слой образуют электроныс одинаковым значением главного
квантового числа n :
К – слой n 1 , L – слой n 2 ,
M - слой n 3 …
Максимальное число электронов в слоях:
2, 8,18,32, 50.
В слое электроны распределяются
по оболочкам в зависимости от
орбитального квантового числа .
46.
Электронное состояниеобозначают символами
Состояния с одинаковыми
эквивалентны.
Число эквивалентных
состояний z : n z .
n .
n
47.
22
6
1s 2s 2 p 3s
Какой элемент?
n 1, 0 2 ;
n 2, 0 2 ;
n 2, 1 6 ;
n 3, 0 1
Na
48.
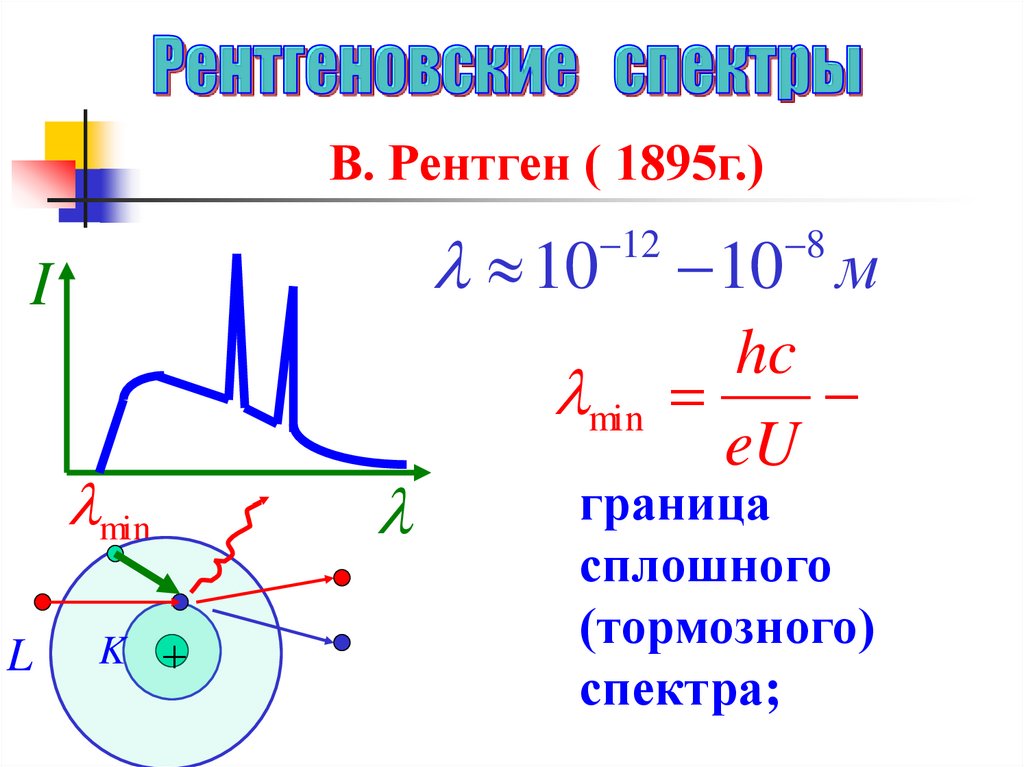
В. Рентген ( 1895г.)10
I
12
min
min
L
K
8
10 м
hc
eU
граница
сплошного
(тормозного)
спектра;
49.
1K
1 1
R Z 1 2 2
1 2
2
К длина волны K
линии характеристического
спектра.
1
1
R Z 2 2 закон Мозли,
m n
1
2
постоянная экранирования.
50.
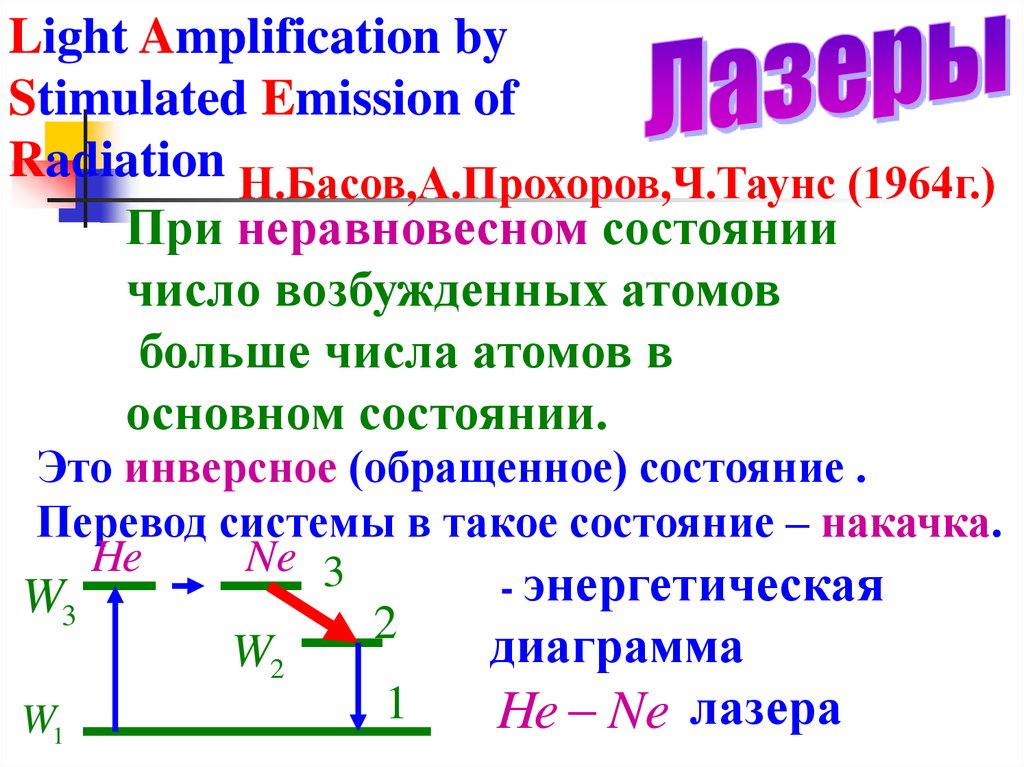
Light Amplification byStimulated Emission of
Radiation Н.Басов,А.Прохоров,Ч.Таунс (1964г.)
При неравновесном состоянии
число возбужденных атомов
больше числа атомов в
основном состоянии.
Это инверсное (обращенное) состояние .
Перевод системы в такое состояние – накачка.
Ne 3
He
- энергетическая
W3
2
диаграмма
W2
1
He Ne лазера
W
1
51.
Лазер содержит:активную среду,
систему накачки,
оптический резонатор.
Электроны при разряде возбуждают
атомы He , которые сталкиваются
с атомами Ne и возбуждают их.
Переход
3 2 дает излучение с
632,8нм.



































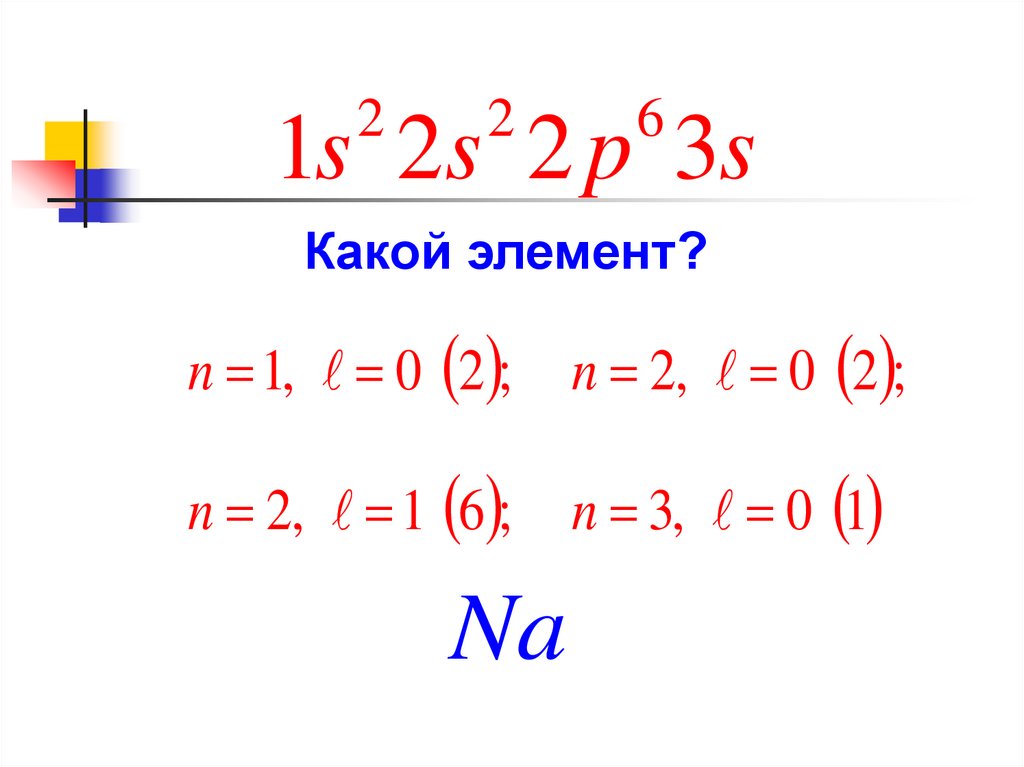



 physics
physics








