Similar presentations:
Спирти
1.
2. План
1. Загальна характеристика спиртів.2. Гомологічний ряд.
3. Будова молекули.
4. Ізомерія та класифікація.
5. Номенклатура.
6. Хімічні та фізичні властивості
7. Отримання спиртів.
8. Застосування.
3. Спирти -
Спирти Речовини, що мають одну абодекілька гідроксильних груп
приєднаних до вуглеводневого
радикалу.
R
OH
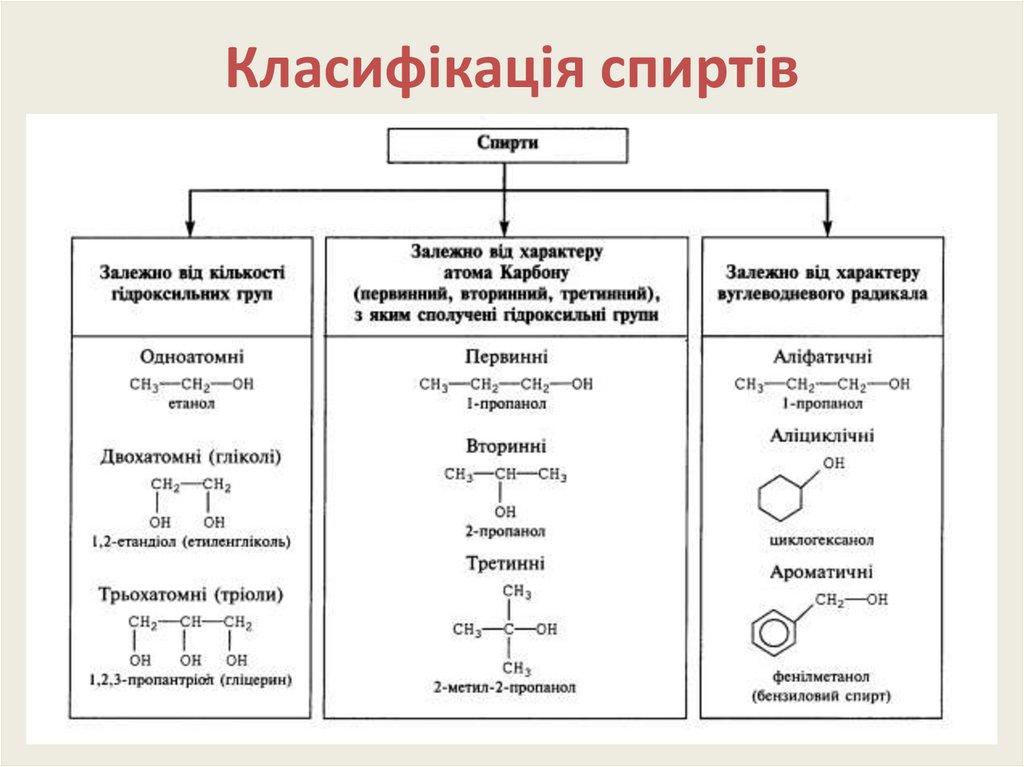
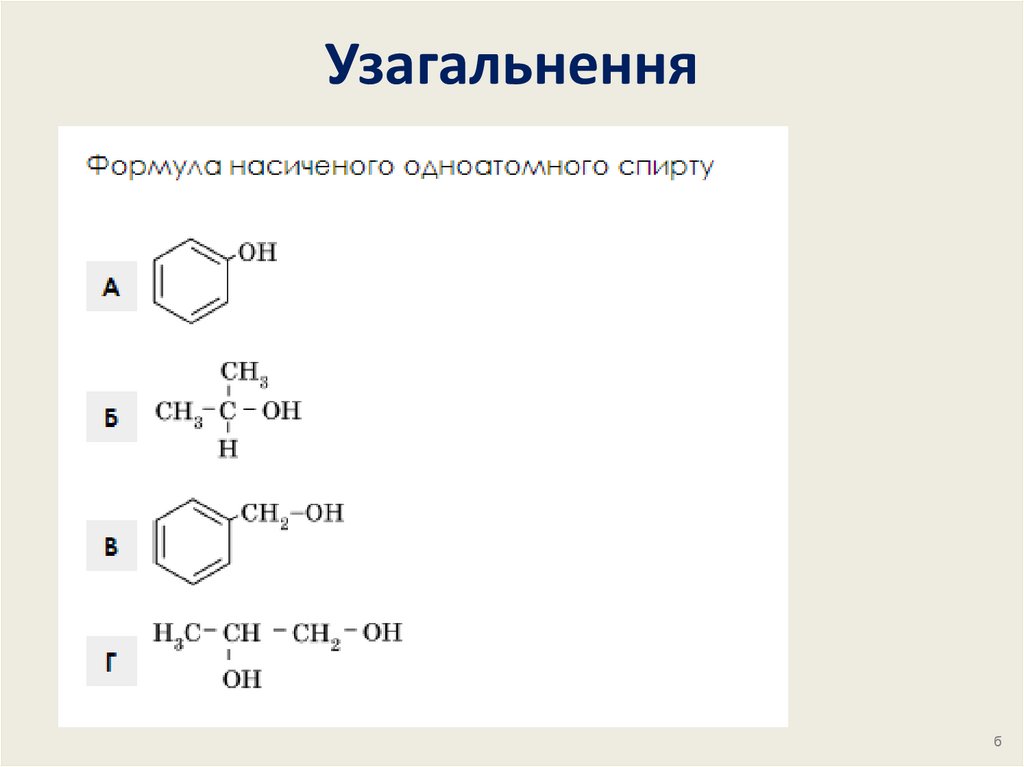
4. Класифікація спиртів
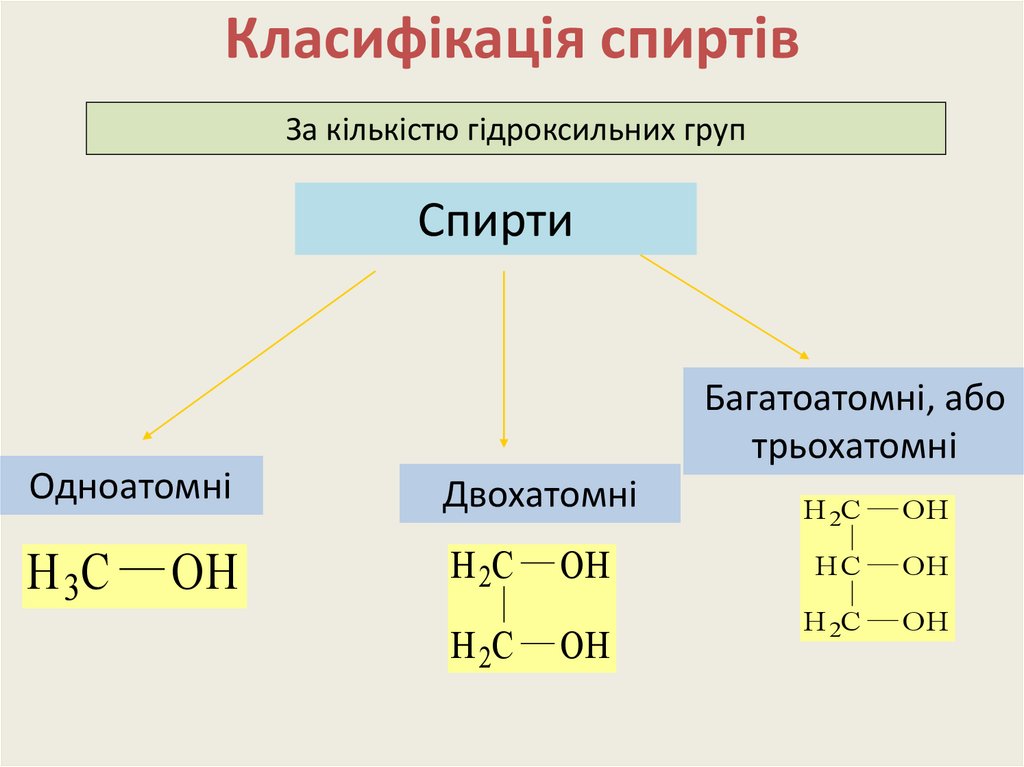
5. Класифікація спиртів
За кількістю гідроксильних групСпирти
Багатоатомні, або
трьохатомні
Одноатомні
Двохатомні
H 3C
H 2C
OH
H 2C
OH
OH
H 2C
OH
HC
OH
H 2C
OH
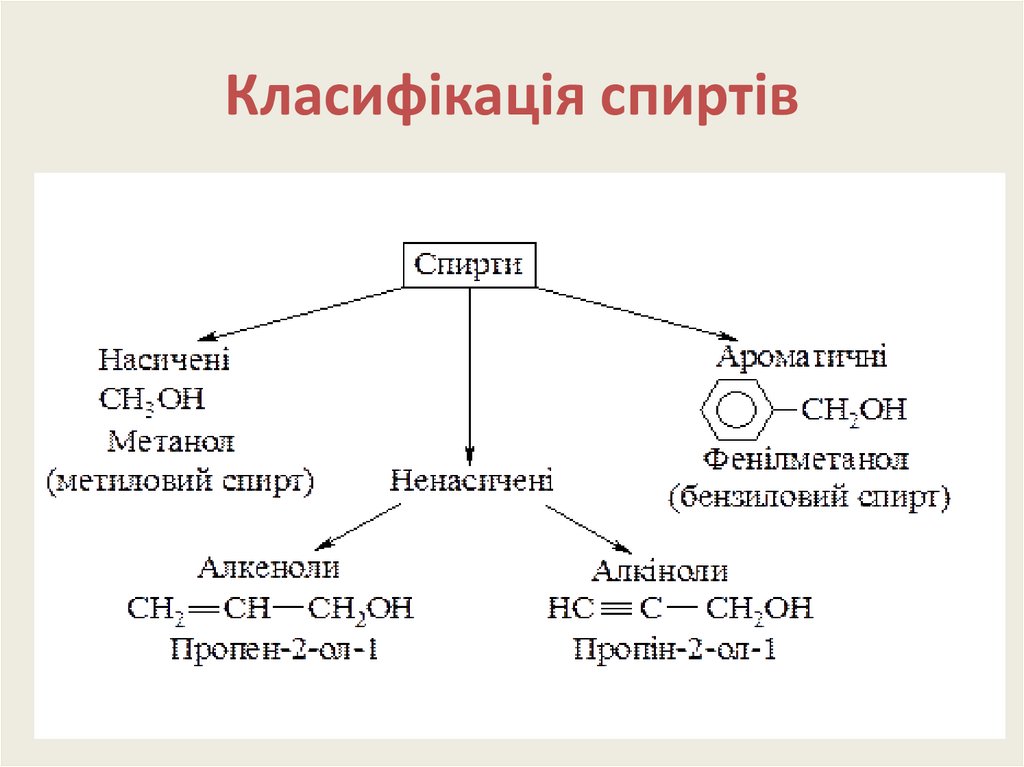
6. Класифікація спиртів
7. Будова молекули
d+d-
CH 3 O
d+
H 3C
d+
H
d-
CH 2 O
d+
H
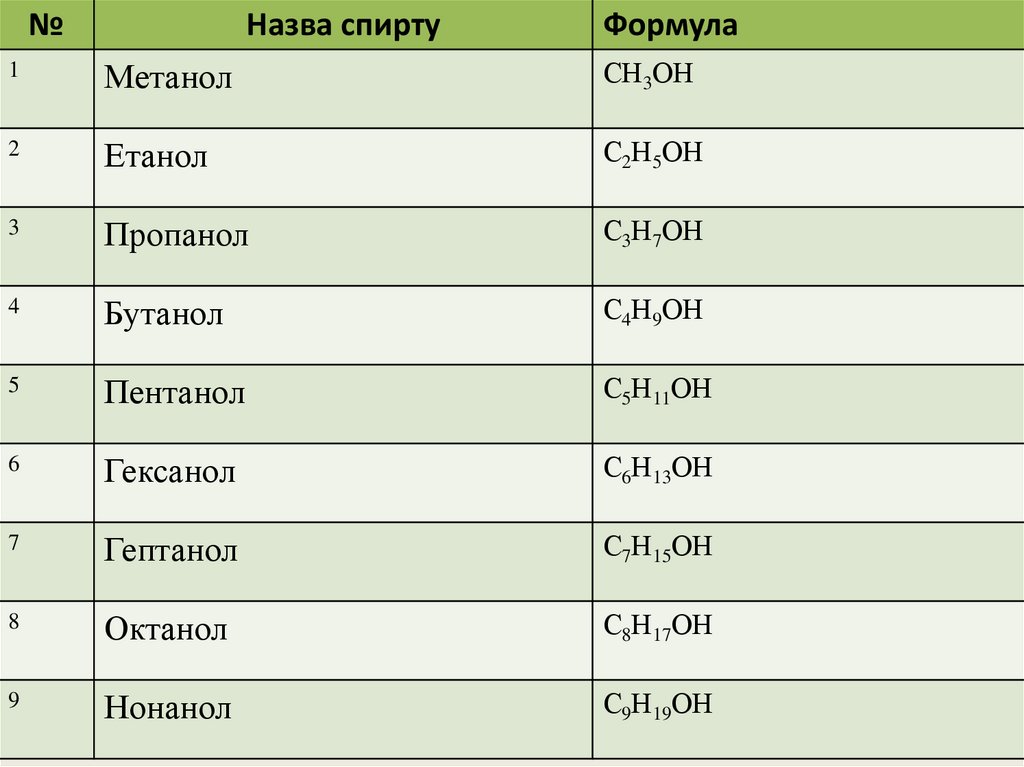
8.
№Назва спирту
Формула
1
Метанол
СН3ОН
2
Етанол
С2Н5ОН
3
Пропанол
С3Н7ОН
4
Бутанол
С4Н9ОН
5
Пентанол
С5Н11ОН
6
Гексанол
С6Н13ОН
7
Гептанол
С7Н15ОН
8
Октанол
С8Н17ОН
9
Нонанол
С9Н19ОН
9. ІЗОМЕРІЯ СПИРТІВ
10. НАЗВА СПИРТІВ
• НАЗВА АЛКАНУ І СУФІКС ОЛ• МЕТАН + ОЛ = МЕТАНОЛ
• ЕТАН + ОЛ = ЕТАНОЛ
11. Номенклатура (IUPAC)
Визначають найдовший вуглецевий ланцюг.Знаходять з якого боку найближче знаходиться група -ОН.
Нумерують ланцюг з того боку де ближче розміщена -ОН група. Якщо -ОН група
рівновіддалена від кінців ланцюга, тоді з того боку де ближче розміщено радикал..
Називають вуглеводневі радикали. Перед назвою кожного радикалу ставлять
цифру яка вказує біля якого атома вуглецю знаходиться радикал, цифру та назву
радикалу відділяють дефісом.
Якщо вуглеводень має декілька однакових радикалів то записують в порядку
зростання всі номери атомів (в порядку зростання, через кому) вуглецю до яких
приєднані ці радикали. Перед назвою радикалу додають суфікс (ди-, три-, тетра, пента
і т.д.), що вказує скільки цих радикалів містить вуглеводень. Якщо два однакових
радикали знаходяться біля одного атома вуглецю то номер ставиться двічі.
Називають вуглеводень основного вуглецевого ланцюгу. Ставлять тире, вказують
число біля якого атому вуглецю знаходиться -ОН група.
Якщо радикал розгалужений то радикал нумерують від місця приєднання (цифрами зі
штрихами) і називають за тими правилами, що і алкан. Суфікс змінюють на -іл (ил), а
назву радикала беруть у дужки.
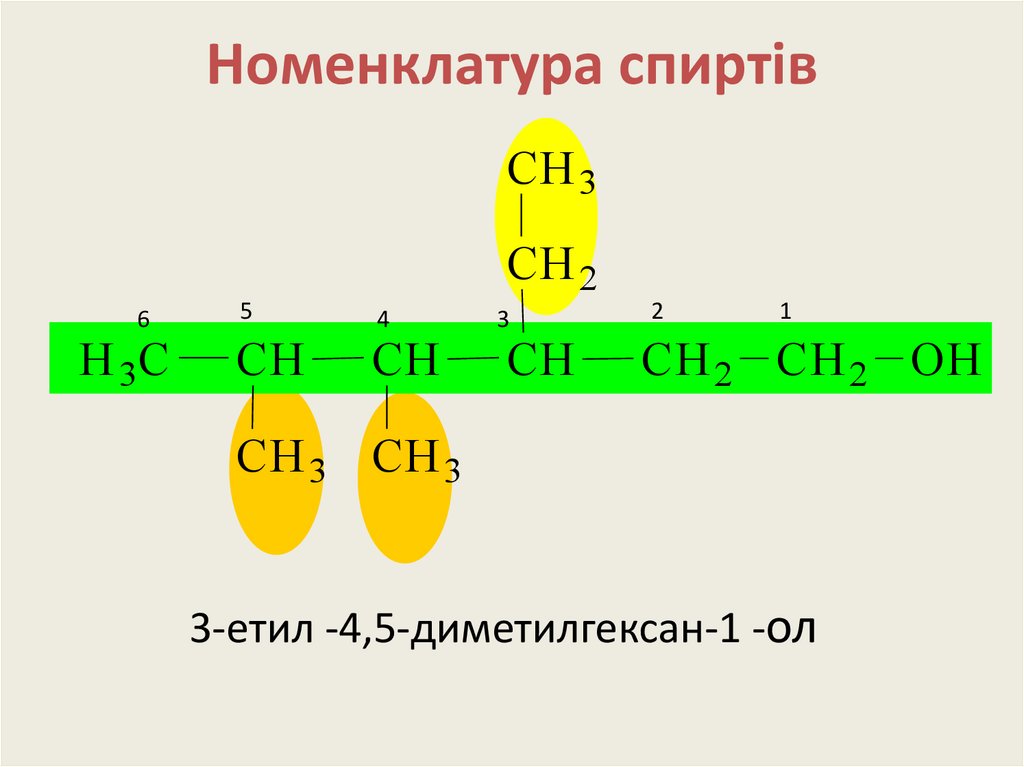
12. Номенклатура спиртів
CH 3CH 2
6
H 3C
5
CH
4
CH
3
CH
2
1
CH 2 CH 2 OH
CH 3 CH 3
3-етил -4,5-диметилгексан-1 -ол
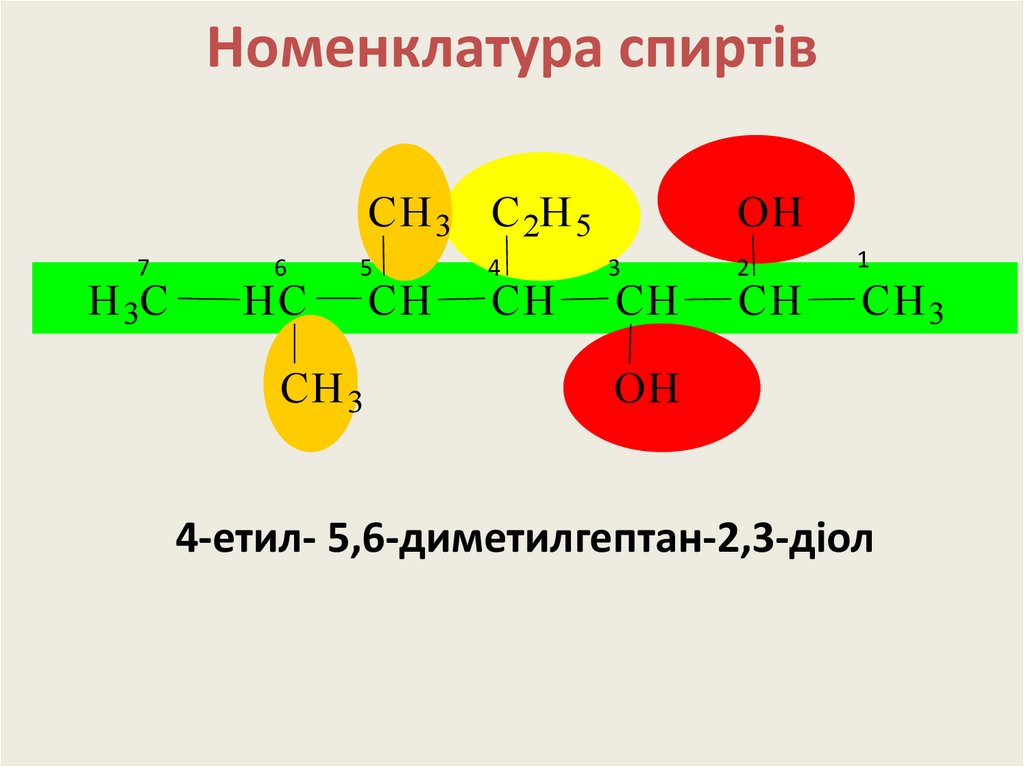
13. Номенклатура спиртів
CH 3 C 2H 57
H 3C
6
HC
5
CH 3
CH
4
CH
OH
3
CH
2
CH
1
CH 3
OH
4-етил- 5,6-диметилгептан-2,3-діол
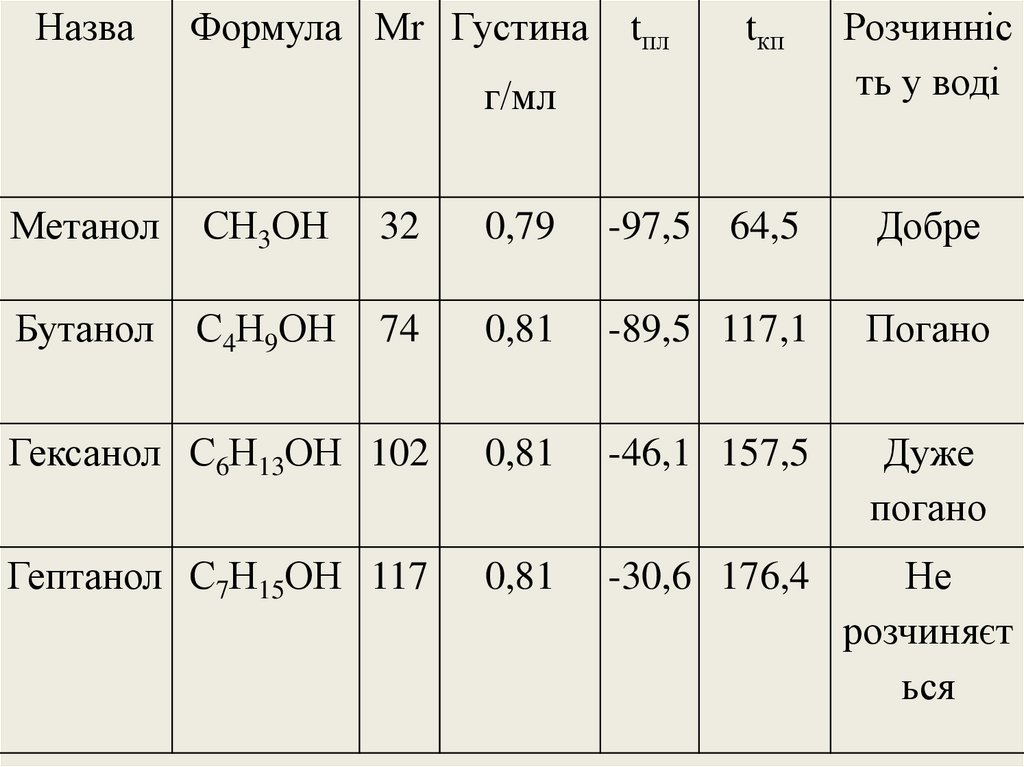
14. Фізичні властивості спиртів
15.
НазваФормула Мr Густина
tпл
tкп
г/мл
Розчинніс
ть у воді
Метанол
СН3ОН
32
0,79
-97,5 64,5
Добре
Бутанол
С4Н9ОН
74
0,81
-89,5 117,1
Погано
Гексанол С6Н13ОН 102
0,81
-46,1 157,5
Дуже
погано
Гептанол С7Н15ОН 117
0,81
-30,6 176,4
Не
розчиняєт
ься
16.
17. Хімічні властивості
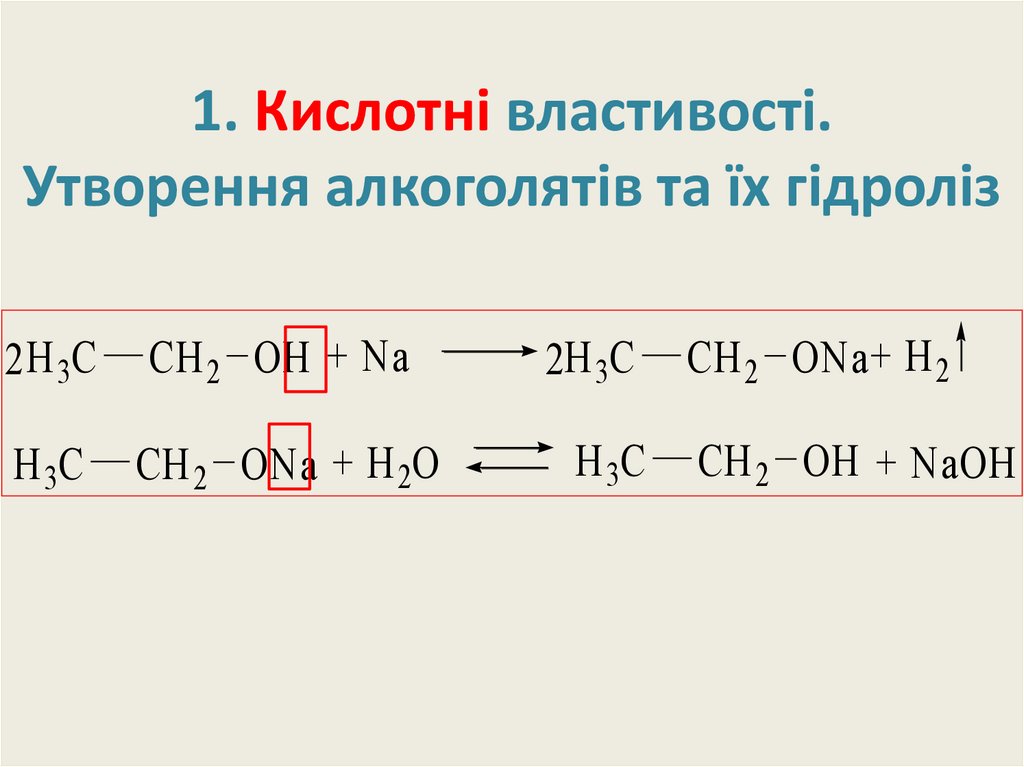
18. 1. Кислотні властивості. Утворення алкоголятів та їх гідроліз
2 H 3CCH 2 OH + Na
H 3C
CH 2 ONa + H 2O
2H 3C
H 3C
CH 2 ONa + H 2
CH 2 OH + NaOH
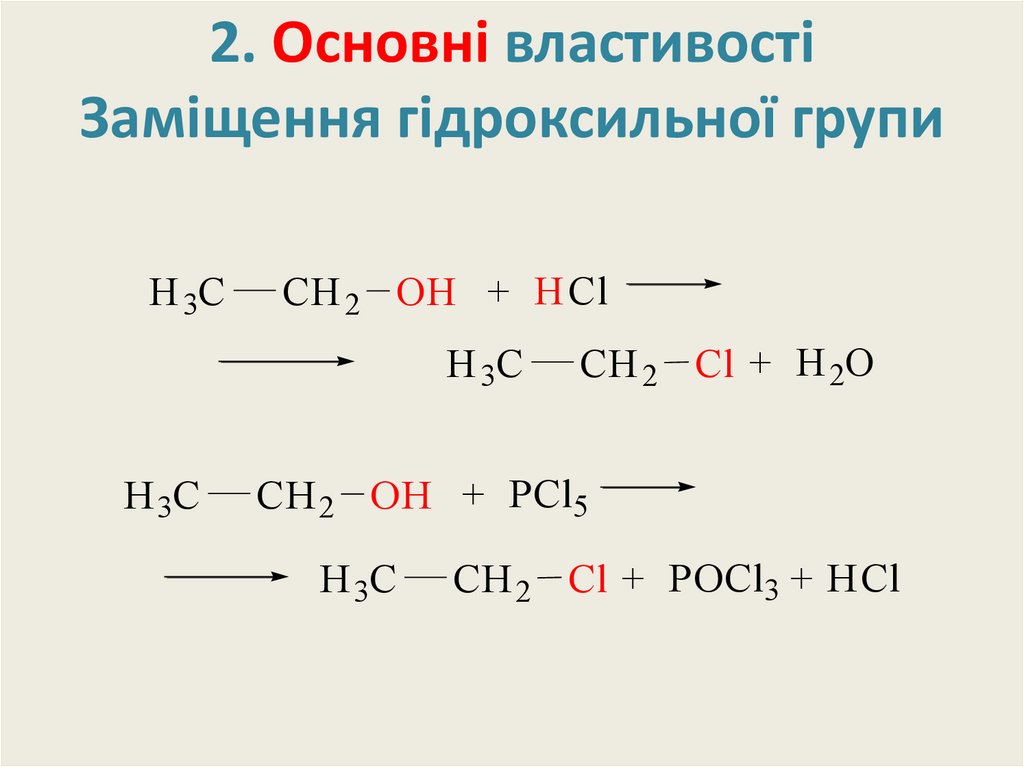
19. 2. Основні властивості Заміщення гідроксильної групи
H 3CCH 2 OH + HCl
H 3C
H 3C
CH 2 Cl + H 2O
CH 2 OH + PCl5
H 3C
CH 2 Cl + POCl3 + HCl
20. 3. Міжмолекулярна дегідратація Утворення простих ефірів (етери)
H 3CCH 2 O H
H 3C
+
HO
CH 2 O
CH 2 CH 3
H 2SO 4, t
CH 2 CH 3 + H 2O
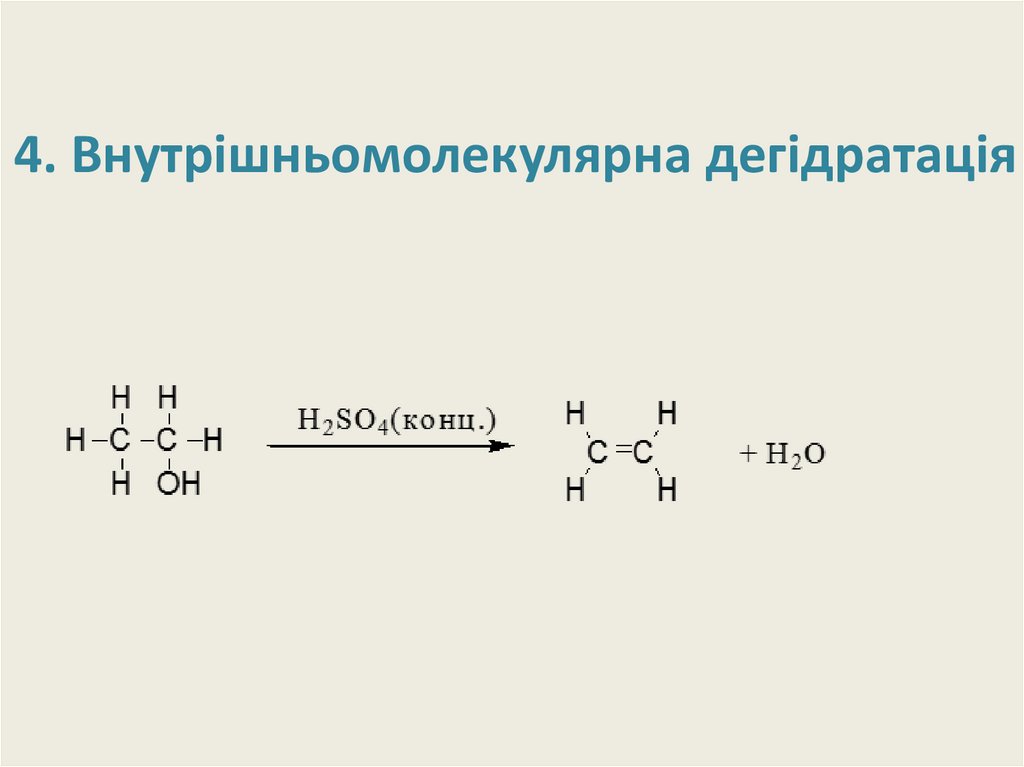
21. 4. Внутрішньомолекулярна дегідратація
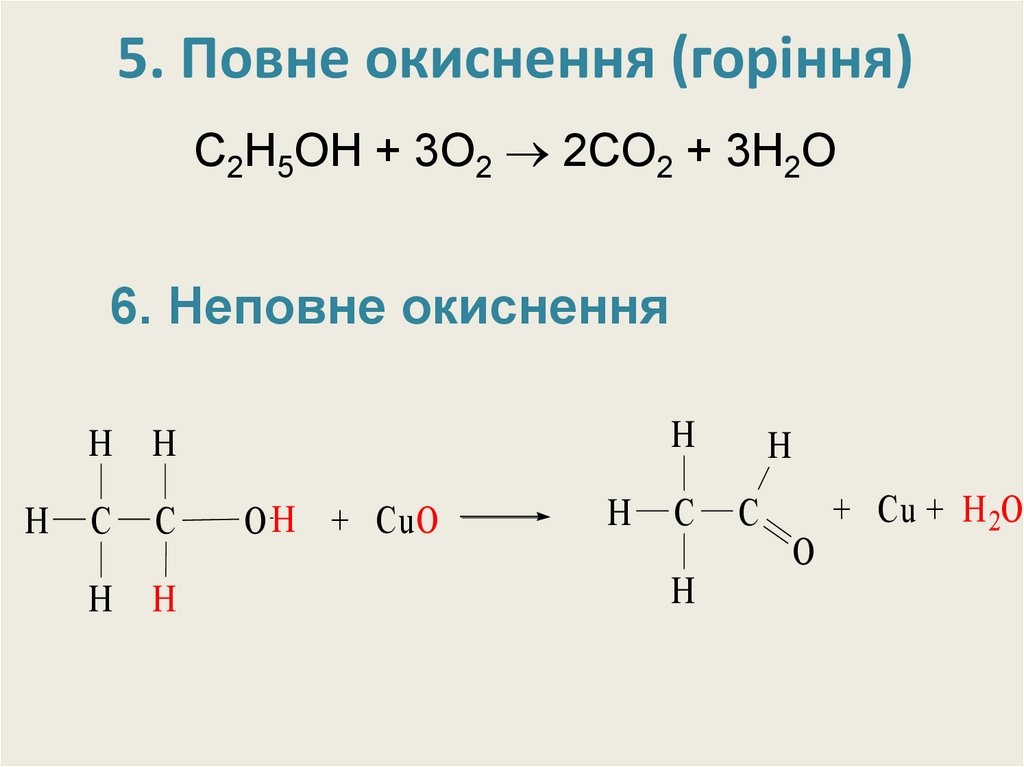
22. 5. Повне окиснення (горіння)
С2H5OH + 3O2 2CO2 + 3H2O6. Неповне окиснення
H
H
H
C
C
H
H
H
O H + CuO
H
C
H
H
C
O
+ Cu + H 2O
23.
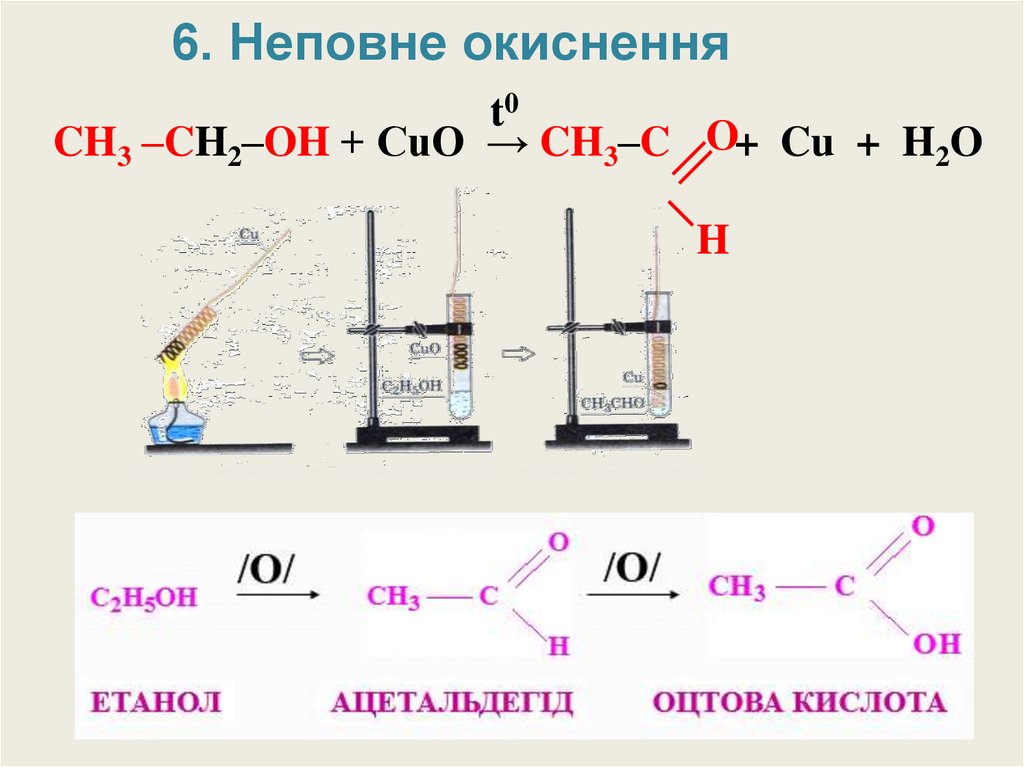
6. Неповне окисненняt0
CH3 –CH2–OH + CuO → CH3–C O+ Cu + H2O
H
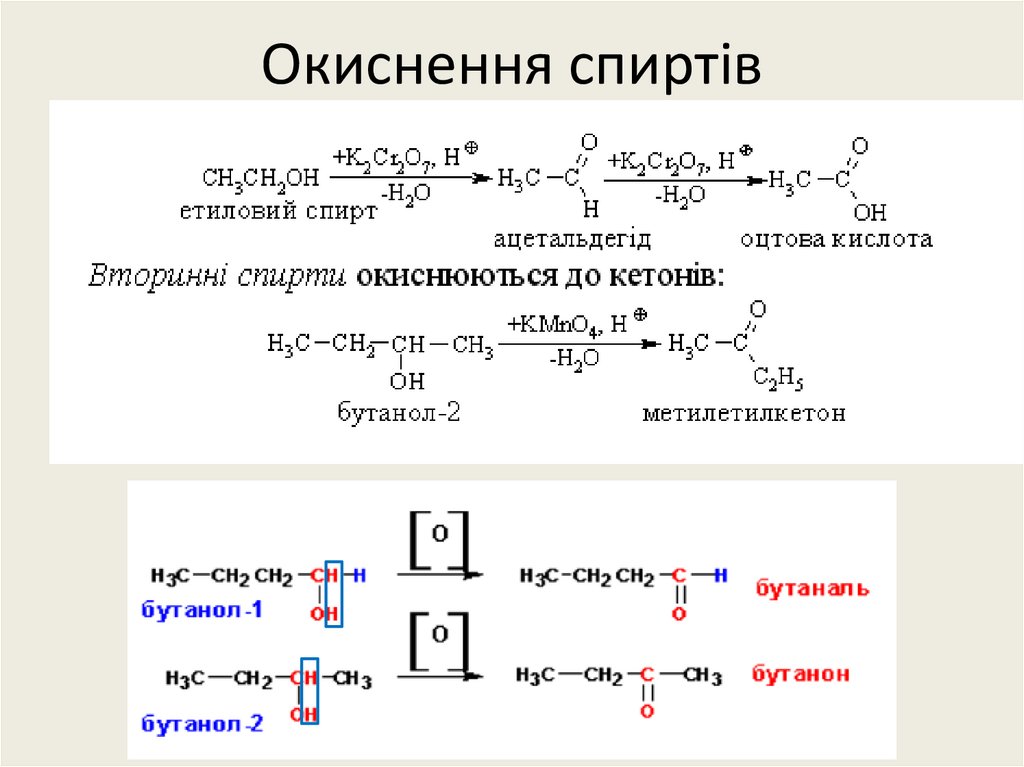
24. Окиснення спиртів
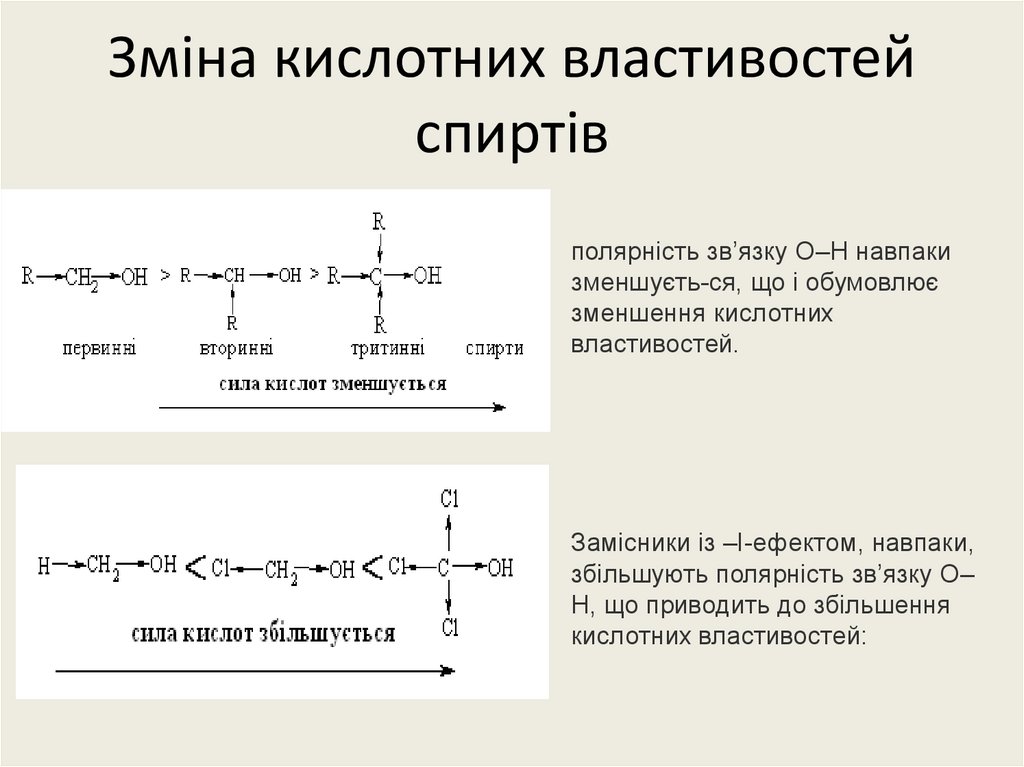
25. Зміна кислотних властивостей спиртів
полярність зв’язку О–Н навпакизменшуєть-ся, що і обумовлює
зменшення кислотних
властивостей.
Замісники із –І-ефектом, навпаки,
збільшують полярність зв’язку О–
Н, що приводить до збільшення
кислотних властивостей:
26.
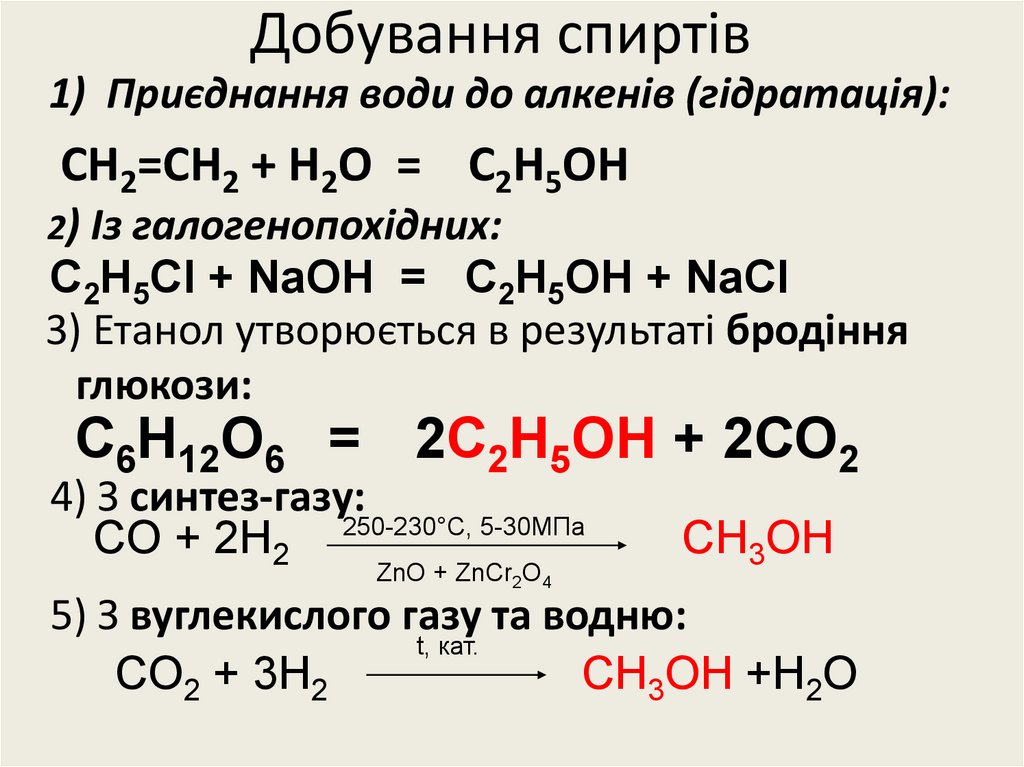
27. Добування спиртів
1) Приєднання води до алкенів (гідратація):СН2=СН2 + Н2О = С2Н5ОН
2) Із галогенопохідних:
С2Н5СI + NaOH = C2H5OH + NaCI
3) Етанол утворюється в результаті бродіння
глюкози:
С6Н12О6 = 2С2Н5ОН + 2СО2
4) З синтез-газу:
CO + 2H2 250-230°C, 5-30МПа
ZnO + ZnCr2O4
CH3OH
5) З вуглекислого газу та водню:
t, кат.
CO2 + 3H2
CH3OH +H2O
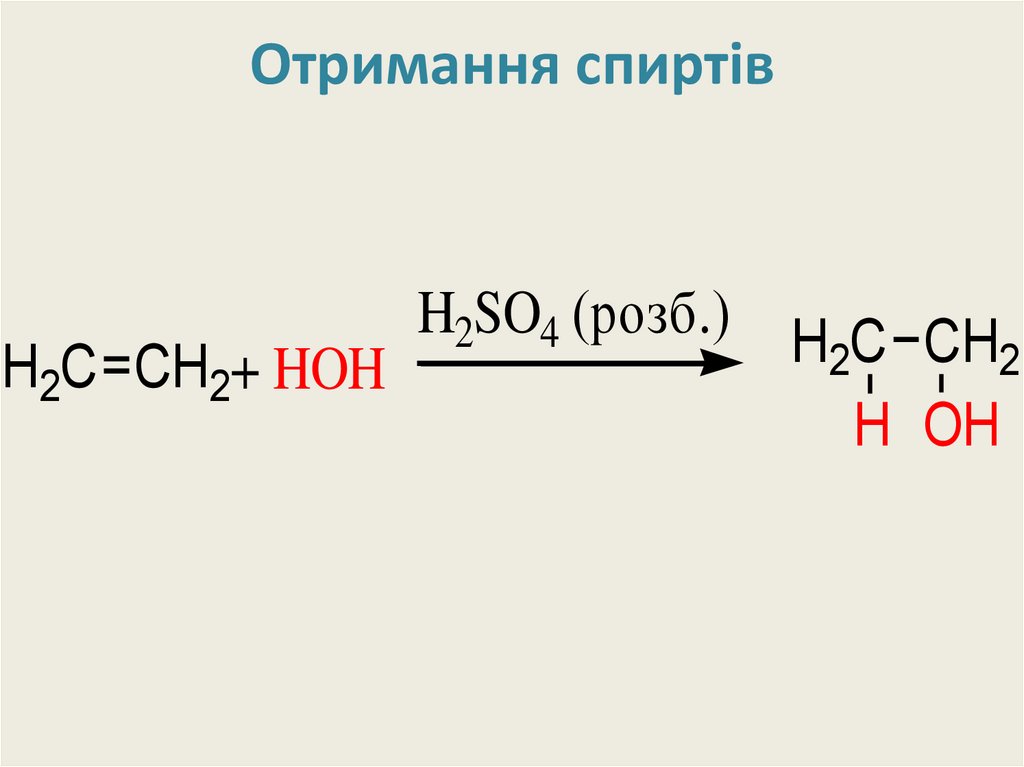
28. Отримання спиртів
H2C CH2+ HOHH2SO4 (розб.)
H2C CH2
H OH

























 chemistry
chemistry








