Similar presentations:
Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6
1. Лекція №6
Оксигеновмісні сполуки. Одноатомні табагатоатомні спирти. Феноли
2.
До оксигеновмісних сполук відносять ті, що містять атоми Карбонну вмолекулі. До цієї групи відносять одноатомні та багатоатомні спирти,
карбонільні сполуки (альдегіди та кетони) та карбонові кислоти.
Гідроксисполуками (спиртами) називають речовини, що містять у
своєму складі гідроксильну групу ОН–.
Спирти поділяють за такими ознаками:
1. За кількістю ОН– груп у молекулі: одно-, двох-, три- і багатоатомні
спирти. Наприклад:
H3C OH
CH2OH CH2OH
CH2OH CHOH CH2OH
Класифікація, номенклатура, ізомерія
3.
2. За будовою вуглеводневого залишку, сполученого з –ОН групою:насичені, ненасичені, циклічні, ароматичні, гетероциклічні спирти.
3. Одноатомні спирти поділяють за типом атома Карбону, з яким
сполучена −ОН група: первинні, вторинні, третинні:
OH
H3C CH2 OH
H3C CH CH3
Первинний
Вторинний
OH
H3C C CH3
CH3
Третинний
Класифікація, номенклатура, ізомерія
4.
Номенклатура гідроксисполук1. Тривіальна номенклатура (винний спирт, деревний спирт)
2. За замісниковою номенклатурою − спирти називають відповідно
назві вуглеводневого залишку, з яким сполучена гідроксильна група,
наприклад:
CH3OH
Деревний спирт
H3C CH2OH
H3C CH2 CH2OH
H3C CH CH3
C2H5OH
Винний спирт
Етиловий спирт
Пропіловій спирт
Ізопропіловий спирт
OH
Класифікація, номенклатура, ізомерія
5.
За систематичною (IUPAC) номенклатурою назва спирту утворюєтьсявід назви відповідного алкану додаванням до неї закінчення -ол з
позначенням номера атома Карбону, біля якого вона розміщена,
причому останній обов’язково повинен бути у складі основного
ланцюга, а нумерація карбонового ланцюга починається з того кінця,
до якого ближче розміщена функціональна група −ОН. Наприклад:
4
3
2
1
3-Метил-бутан-2-ол
Класифікація, номенклатура, ізомерія
6.
Номенклатура гідроксисполукДво-, три- і т.д. основні спирти за систематичною номенклатурою IUPAC
називають відповідно до існуючих правил, додаючи до назви алкану
закінчення -діол,-тріол і т.д. Наприклад:
Етандіол
Пропантриол
Класифікація, номенклатура, ізомерія
7.
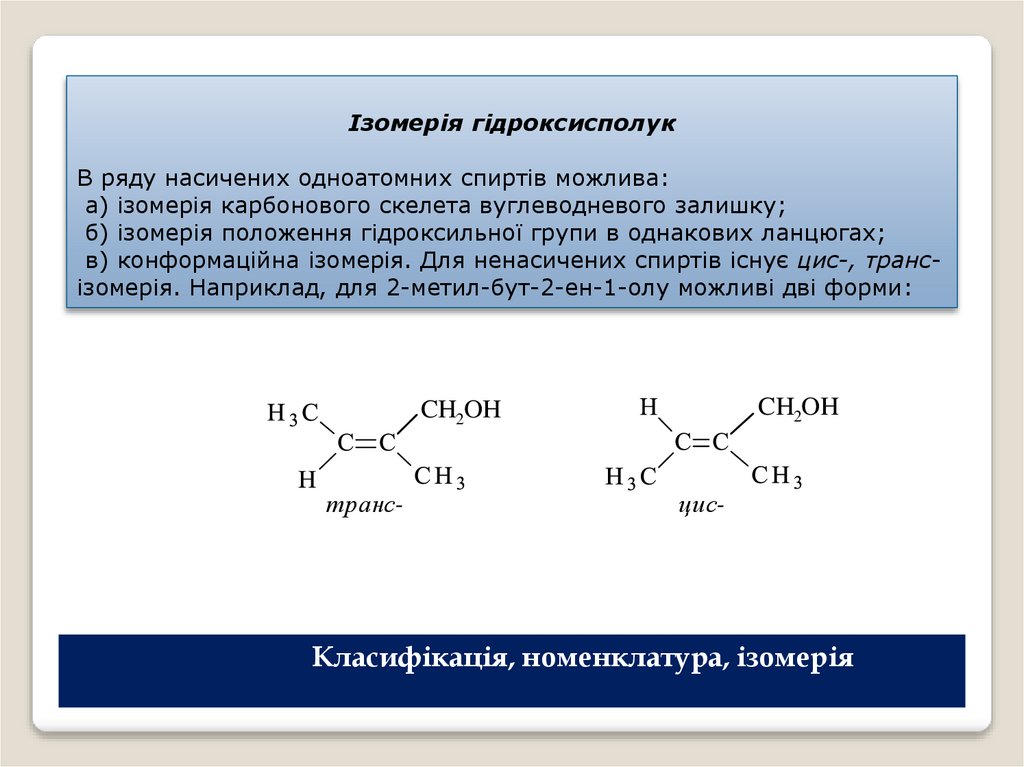
Ізомерія гідроксисполукВ ряду насичених одноатомних спиртів можлива:
а) ізомерія карбонового скелета вуглеводневого залишку;
б) ізомерія положення гідроксильної групи в однакових ланцюгах;
в) конформаційна ізомерія. Для ненасичених спиртів існує цис-, трансізомерія. Наприклад, для 2-метил-бут-2-ен-1-олу можливі дві форми:
CH2OH
CH2OH
транс-
цис-
Класифікація, номенклатура, ізомерія
8.
1. Окиснення алканів (метод має практичне застосування для промисловогодобування вищих насичених спиртів):
H3C (CH2)
n
CH3
[O]
H3C (CH2) CH2 OH ,
m
де m<n
2. Лужний гідроліз моногалогенопохідних вуглеводнів (заміщення Hal на −ОН
групу під дією водного розчину лугу):
R Hal
NaOH
(водний р-н)
R OH + Na Hal
2. 3. Гідратація алкенів (див. реакції алкенів):
R CH CH2 + HOH
R CH CH3
OH
Методи одержання одноатомних спиртів
9.
4. Добування з оксосполук.а) відновлення оксосполук та естерів:
R
C
O H2 , Ni
H
R C R'
H2 , Ni
O
R CH R'
OH
Вторинний спирт
O
H2 , Ni
R C
O
R CH2 OH
Первинний спирт
R'
R CH2 OH +
R' OH
Третинні спирти відновленням добути неможливо
Методи одержання одноатомних спиртів
10.
5. Синтези за допомогою металоорганічних сполук (застосування реактивівГріньяра). Ці сполуки легко приєднуються до полярних кратних зв’язків таким
чином, що алкіл приєднується до атома Карбону, а інша частина – до атома
Оксигену:
C
O + R MgHal
C
OMgHaI
R
При подальшому розщепленні утворених сполук водою добувають спирти різної
будови. Так, з мурашиного альдегіду (реакція Тищенка) отримують первинні
спирти:
OMgHal
O
+ R MgHal
H C
H
H CH
R
H2O
-Mg(OH)Hal
R CH2OH
Методи одержання одноатомних спиртів
11.
З інших альдегідів утворюються вторинні спирти (реакція Вагнера):OMgHal
O
R'
+ R MgHal
C
R'
CH
R
H
H2O
-Mg(OH)Hal
OH
R'
CH
R
З кетонів завжди утворюються третинні спирти (реакція Зайцева):
O
R' C R" + R MgHal
OMgHal
R' C R"
R
H2O
-Mg(OH)Hal
OH
R' C R"
R
Методи одержання одноатомних спиртів
12.
6. Гідроліз естерів − застосовується для промислового добуваннявисокомолекулярних спиртів із восків:
R C
+
O
O R'
+ H2O
(H )
R C
O
OH
+
R' OH
7. Оксосинтез – при карбонілюванні алкенів утворюються альдегіди, які потім
відновлюють до спиртів:
R CH CH2+ CO + H2
R CH2 CH2 C
O H , (Pt)
2
H
R CH2 CH2 CH2OH
8. Бродіння вуглеводів (ферментативне) широко застосовують для добування
етилового спирту:
C6H12O6
Глюкоза
Фермент
2 С2H5OH + 2 CO2
Методи одержання одноатомних спиртів
13.
У ряду одноатомних спиртів, на відміну від насичених і ненасиченихвуглеводнів, немає газоподібних речовин, хоча перші члени ряду мало
відрізняються від них за молекулярною масою. На властивості спиртів
дуже сильно впливає здатність їх молекул утворювати міжмолекулярні
водневі зв’язки:
..
O
R
..
..........
H
O H
R
За рахунок водневого зв'язку відбувається асоціація молекул спиртів.
Внаслідок цього ущільнюється упаковка молекул і нижчі спирти (С1−С10)
мають вищі температури кипіння, ніж ізомерні їм етери
H3C CH2OH
Рідина
H3C O CH3
Газ
Фізичні властивості спиртів
14.
За рахунок утворення водневих зв’язків між молекулами спирту і води(для нижчих гомологів) відбувається необмежена взаємна розчинність
спиртів у воді:
O H .......... O H
H
R
Молекули спиртів складаються ніби з двох частин – розчинної у воді
(гідрофільної), яка містить гідроксильну групу, та нерозчинної (гідрофобної), яка
складається з вуглеводневого радикала. Тому для вищих гомологів розчинність у
воді зменшується.
Насичені спирти незабарвлені. Запах нижчих спиртів – характерний різкий
«алкогольний», При цьому метанол та етанол за запахом дуже схожі й відрізнити
їх дуже складно. Для середніх гомологів характерний сильний неприємний
«сивушний» запах; третинні спирти мають характерний запах плісняви; вищі
спирти (тверді) – позбавлені запаху.
Температура кипіння спиртів залежить від їх будови: у первинних спиртів вона
вища, ніж у вторинних, які у свою чергу, характеризуються більшою
температурою кипіння порівняно з третинними.
Фізичні властивості спиртів
15.
Спирти вступають у реакції за двома основних напрямками:1. З розривом зв’язку О−Н.
2. З розривом зв’язку С−О.
Реакції з розривом зв’язку О−Н характеризують кислотні властивості
спиртів. В гідроксильній групі електронна густина зміщена до більш
електронегативного атома Оксигену. Поляризація зв’язку О−Н полегшує
відщеплення атома Гідрогену у вигляді протона, тобто призводить до
виявлення спиртами кислотних властивостей. Цей атом Гідрогену здатний
замінюватись на атом металу (М) при взаємодії з активними металами:
R OH + Na
R ONa + 1/2 H2
Утворені алкоголяти можна розглядати, як солі сильних основ і слабких
кислот (якими є спирти). Тому у водних розчинах вони легко гідролізують,
зумовлюючи лужну реакцію середовища:
R ONa + H2O
R OH + NaOH
Хімічні властивості одноатомних спиртів
16.
До другої групи реакцій спиртів (реакції заміщення спиртовогогідроксилу – реакції з розривом С−О зв’язку) відносяться такі, як заміщення
гідроксильної групи на атоми галогенів. Реакція відбувається при дії на спирти
як газоподібних галогеноводнів або їх водних розчинів, так і галогенангідридів
неорганічних кислот PCl5, PBr3, SOCl2 тощо.
R OH + PCl5
R Cl + POCl3 + HCl
У ряді випадків спирти можуть реагувати як з розривом С−О зв’язку, так і
з розривом С−Н зв'язку:
Реакція етерифікації – утворення етерів (простих ефірів) внаслідок
міжмолекулярної дегідратації спиртів, яка відбувається при нагріванні за
наявності каталізатора (сульфатної кислоти, хлороводню тощо):
kat
- Н2О
Хімічні властивості одноатомних спиртів
17.
При внутрішньомолекулярній дегідратації під дією водввіднімаючихзасобів (сульфатної, фосфатної кислот) із спиртів отримують алкени (у
відповідності до правила Зайцева атом Гідрогену відщеплюється від менш
гідрогенізованого атома Карбону):
tº
H3C CH CH2 CH3
(H2SO4)
OH
H3C CH CH CH3 + Н2О
Естерифікація – утворення естерів (складних ефірів) при взаємодії
спиртів з органічними кислотами:
R C
O
OH
+
HO R'
tº
( H+)
R C
O
O
Естер
R'
+ Н2О
Хімічні властивості одноатомних спиртів
18.
3. Окиснення спиртів – залежно від будови спирту та застосованогоокисника (KMnO4, K2Сr2O7, CrO3 або О2 у присутності міді) спирти
окиснюються до альдегідів, кетонів або карбонових кислот.
Первинні спирти утворюють альдегіди, які далі окиснюються до
відповідних кислот:
R CH2OH
[O]
R C
O
[O]
R C
O
OH
H
Із вторинних спиртів утворюються кетони:
R CH R'
OH
[O]
R C R'
O
Третинні спирти окиснюються важко з розривом карбонового ланцюга.
Хімічні властивості одноатомних спиртів
19.
Метанол СН3ОН – метиловий спирт, деревинний спирт. Метанолвперше був виявлений Р. Бойлем у
1661 р. в продуктах сухої
перегонки деревини. За два століття Ж.Б. Дюма та Е. Пеліго одержали
його у чистому стані. Тоді ж було встановлено хімічну формулу
метанолу. У 1857 р. М. Бертло одержав метанол гідролізом
метилхлориду. Метанол – дуже токсична речовина, використовується
лише для технічних потреб в якості розчинника лаків і палітур, як
сировина для видобування формальдегіду, органічних барвників та ін.
Етанол С2Н5ОН – етиловий спирт, винний спирт (рослинний хмільний
напій, що його містить), був відомий людству з глибокої давнини.
Вперше спирт з вина отримали в 6-7 ст. арабські хіміки, у Європі
етиловий спирт був отриманий із продуктів бродіння в 11-12 ст. в
Італії, його називали «аква віта» (вода життя). У 1660 р. англійський
хімік Р. Бойль вперше отримав чистий етиловий спирт, а також
дослідив деякі фізичні і хімічні властивості. У 1842 р. Я. Шіль відкрив,
що спирти утворюють гомологічний ряд. У 1850 році англійський хімік
О. Вільямсон, досліджуючи реакцію алкоголятів з етилйодидом,
експериментально підтвердив формулу С2Н5ОН.
Окремі представники, фізіологічна дія та застосування.
20.
На сьогодні найпоширеніший метод добування етанолу для харчової тафармацевтичної промисловості – бродіння цукристих речовин.
За обсягом виробництва етанол посідає одне з перших місць серед
продукції хімічної промисловості. Застосовується майже в усіх галузях
народного господарства: для добування синтетичного каучуку, як
проміжні продукти для основного органічного синтезу, виготовлення
лаків і оліф, барвників, як розчинник, для виготовлення спиртних
напоїв, фармацевтичних препаратів тощо.
Спирти також використовують як паливо. З цією метою в промислових
об'ємах використовуються три спирти: метанол, етанол і бутанол, що
пов'язано, насамперед, з їх комерційною доступністю. При цьому
можливе використання спиртів у вигляді пального в чистому вигляді, а
також у вигляді різних сумішей з бензином або дизельним паливом, а
також як добавок (до 10%) з метою підвищення октанового числа і
зниження
токсичності
відпрацьованих
газів.
Найпоширенішим
паливним спиртом є етанол. Також окремим напрямом є використання
метанолу у виробництві біодизеля.
Окремі представники, фізіологічна дія та застосування.
21.
22.
Багатоатомними спиртами називають похідні вуглеводнів, умолекулах яких два і більше атомів Гідрогену заміщені на гідроксильні
групи.
Спирти з двома гідроксильними групами називають двохатомними, з
трьома —триатомними. Перший представник цього ряду – етан-1,2-діол
(тривіальна назва — етиленгліколь).
Двохатомні спирти називають також діолами або гліколями (від гр.
glykys – солодкий), через солодкий смак найпростіших представників
цих спиртів; триатомні – тріолами або гліцеролами, за назвою першого
представника.
Етан-1.2-діол (етиленгліколь)
Пропантриол
Гліцерол (гліцерин)
23.
За замісниковою номенклатурою ІЮПАК назви двох татриатомних спиртів утворюють від назви відповідного
вуглеводню, додаючи суфікс -діол чи - триол, позначаючи
цифрами положення гідроксильних груп.
Стійкими є гліколі, в молекулах яких групи ОН розміщені біля
різних атомів Карбону. Якщо ж дві групи ОН розташовані біля
одного атома С, такі двохатомні спирти нестійкі, легко
розкладаються, відщеплюючи за рахунок груп ОН воду і
перетворюються на альдегіди або кетони. Стійкими є тріоли в
молекулах яких групи ОН розміщені біля різних атомів С. Якщо
три групи ОН знаходяться біля одного атома С, такі спирти
легко розкладаються відщеплюючи воду, за рахунок груп ОН і
перетворюються на карбонові кислоти.
24.
Для добування багатоатомних спиртів можуть бути застосовані ті саміметоди, що і для одноатомних спиртів, але вихідними сполуками є
біфункціональні похідні. Найбільший інтерес мають спеціальні методи
добування цих сполук:
1. Гідроксилювання алкенів (реакцією Вагнера):
3 H2C CH2 + 2 KMnO4 + 4 H2O
3 CH2 CH2 + 2 MnO2 + 2 KOH
OH OH
2. Гідроліз оксиранів (промисловий метод):
H2C
CH2
O
HOH
+
(H )
CH2 CH2
OH OH
25.
3. Добування гліцерину з пропілену (промисловий метод):Cl2 , 500º C
HOCl
H2C CH CH2
H3C CH CH2
CH2 CH CH2
- НСl
Cl
Cl OH Cl
Пропілен
Алілхлорид
Дихлоргідрин
2 NaOH (водн.)
CH2 CH CH2
- 2 NaCl
OH OH OH
Гліцерин
4. Гідроліз жирів (естерів вищих карбонових кислот і гліцерину):
O
CH2 O C C17H35
CH2 OH
O
O
НОН
CH OH + 3 C17H35 C
CH O C C17H35
OH
O
CH2 OH
CH2 O C C17H35
26.
Багатоатомні спирти - безбарвні, сиропоподібні, в’язкі рідинисолодкуваті на смак, добре розчинні у воді, погано – в органічних
розчинниках; мають високі температури кипіння. Змішуються у всіх
співвідношеннях з водою та етиловим спиртом. Порівняно з
одноатомними спиртами, багатоатомні спирти виявляють сильніші
кислотні властивості. Це зумовлено електроноакцепторним впливом
гідроксильних груп.
Багатоатомні спирти можуть виявляти всі властивості одноатомних
спиртів, причому в реакції може брати участь одна або кілька
гідроксильних груп (реакції відбуваються постадійно).
27.
Багатоатомні спирти можуть виявляти всі властивості одноатомнихспиртів, причому в реакції може брати участь одна або кілька
гідроксильних груп (реакції відбуваються постадійно).
HONO2
H2SO4
HONO2
- Н2О
H2SO4
-Н2О
Гліцерол
HONO2
H2SO4
- Н2О
Гліцеролтринітрат
28.
Найбільший інтерес становлять специфічні реакції багатоатомнихспиртів, зумовлені наявністю в молекулі кількох –ОН груп, їх взаємним
впливом та взаємодією.
1. Багатоатомні спирти з α-розміщеними гідроксильними групами здатні
реагувати з гідроксидами важких металів з утворенням комплексних
сполук. Реакція з купрум (ІІ) гідроксидом є якісною реакцією
багатоатомних спиртів з α-розміщеними гідроксильними групами.
H2C
H2C
HO
OH HO
+ Cu +
OH
OH HO
CH2
H2C
O
H
O
CH2
Cu
O CH2
O
H
Гліколя т купруму
CH2 - H2O H2C
29.
2. Дегідратація етиленгліколю за Фаворським приводить до утворенняциклічного етеру − діоксану:
H2C
H2C
OH
HO
+
OH
HO
CH2
CH2
H2SO4
- 2 H2O
H2C
H2C
O
CH2
CH2
O
1,4 - Діоксан
3. Дегідратація гліцерину в присутності водовіднімних засобів (KHSO4,
MgSO4, H3BO3) або сульфатної кислоти приводить до утворення
акролеїну:
O
CH2 CH CH2
- 2 Н2О
OH OH OH
H2C CH C
Акролеїн
H
30.
Етандіол (етиленгліколь) – безбарвна густа і дуже токсична рідина беззапаху, що застосовується як пластифікатор у виробництві синтетичних
волокон (лавсан); для добування діоксану – важливого лабораторного
розчинника. Етиленгліколь широко застосовують як складову
антифризів (від гр. anti – префікс, що позначає протидію, та англ. freeze
– замерзати). Найпоширенішими є антифризи на основі водного
розчину етиленгліколю; вони мають низьку температуру замерзання і їх
застосовують для охолодження двигунів внутрішнього згорання, в
теплообмінниках та інших установках, які працюють при температурі
нижче 00С. В техніці, в основному, використовують антифризи, які
містять 52,6 % та 66,0 % етиленгліколю; вони замерзають при
температурі –400 С та –650С відповідно.
Діетиленгліколь, триетиленгліколь та інші поліетиленгліколі
застосовуються в харчовій, фармацевтичній промисловості та у
виробництві косметичних засобів як зволожувачі та емульгатори.
31.
Гліцерол – густа сиропоподібна рідина, солодка на смак. Впершегліцерол виділив шведський аптекар К. Шеєле у 1779р. гідролізом
оливкової олії. Але лише у 1854 р. Ш. Вюрц встановив, що гліцерол –
триатомний спирт, а структурну формулу гліцеролу запропонував у 1859
р. О.М. Бутлеров. Гліцерол входить до складу природних жирів та олій.
Він широко використовується в парфумерії, харчовій промисловості,
для отримання вибухівки (тринітрату гліцерину), в шкірообробній та
паперовій промисловості; для синтезу алкідних та епоксидних смол
тощо.
32.
Нітрогліцерол (гліцеролтринітрат). Безбарвна масляниста рідина,добре розчинна в ацетоні, діетиловому етері, бензені, погано – у воді.
Вперше тринітрат гліцеролу синтезував італійський хімік А. Сомбреро у
1846 р. Однак здатність нітрогліцеролу вибухати при незначному ударі
перешкоджала його широкому використанню. У 1864 р. А. Нобель
запатентував спосіб добування нітрогліцеролу, а у 1866 р. винайшов
динаміт. Він помітив, як випадково пролитий тринітрогліцерол поглинув
кізельгур (гірська порода), при цьому кізельгур залишався сухим і його
можна було формувати в брикети. У цій суміші нітрогліцерол зберігав
свої вибухові властивості. Її Нобель назвав “динаміт” (від гр. dynamis –
сила). Динаміт, крім військової справи, застосовують у будівництві, при
прокладанні тунелів, гірничій справі. Нітрогліцерол використовують
також в медицині як лікарський препарат, що знімає гострі серцеві
напади, сприяє розширенню кровоносних судин серця, знімає біль
(спазми).
33.
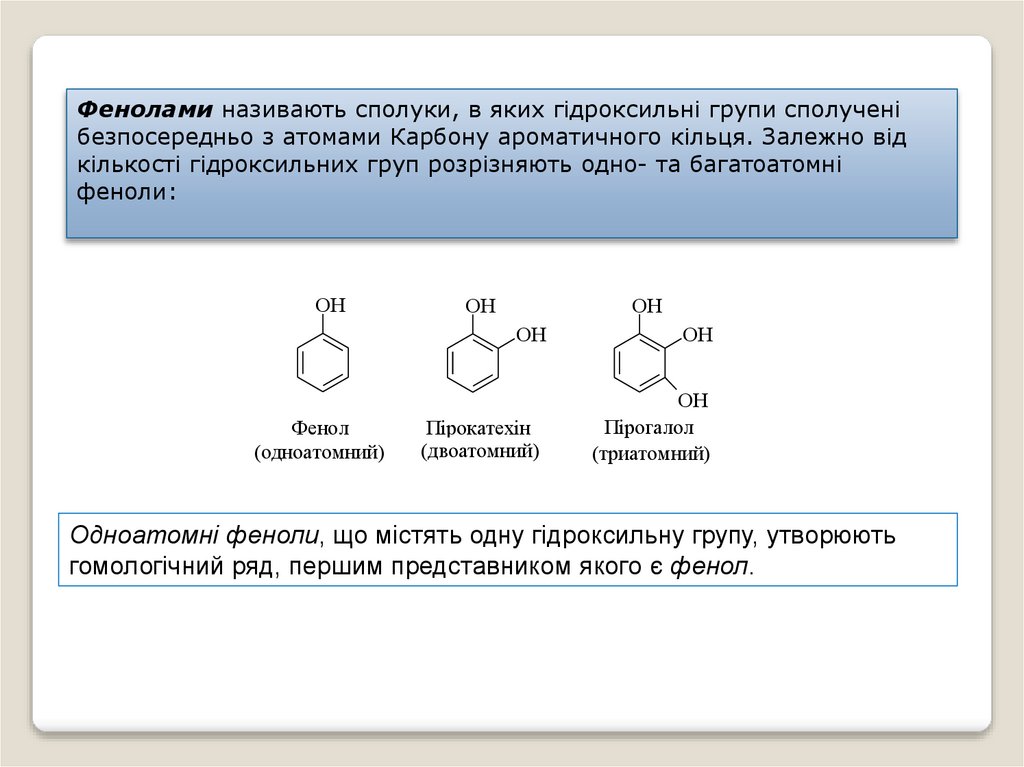
Фенолами називають сполуки, в яких гідроксильні групи сполученібезпосередньо з атомами Карбону ароматичного кільця. Залежно від
кількості гідроксильних груп розрізняють одно- та багатоатомні
феноли:
OH
Фенол
(одноатомний)
OH
OH
OH
OH
Пірокатехін
(двоатомний)
OH
Пірогалол
(триатомний)
Одноатомні феноли, що містять одну гідроксильну групу, утворюють
гомологічний ряд, першим представником якого є фенол.
34.
Ще й тепер не втратив актуальності метод добування фенолу зкам’яновугільної смоли. Враховуючи велике значення фенолу і
продуктів, які добувають на його основі, розроблено ряд синтетичних
методів його добування. Найважливіші з них:
1. Гідроліз арилгалогенідів твердими їдкими лугами або перегрітою
парою над каталізатором − один із сучасних промислових методів
добування фенолів:
R
R
Hal
HOH , 500º C
- H-HaI
OH
35.
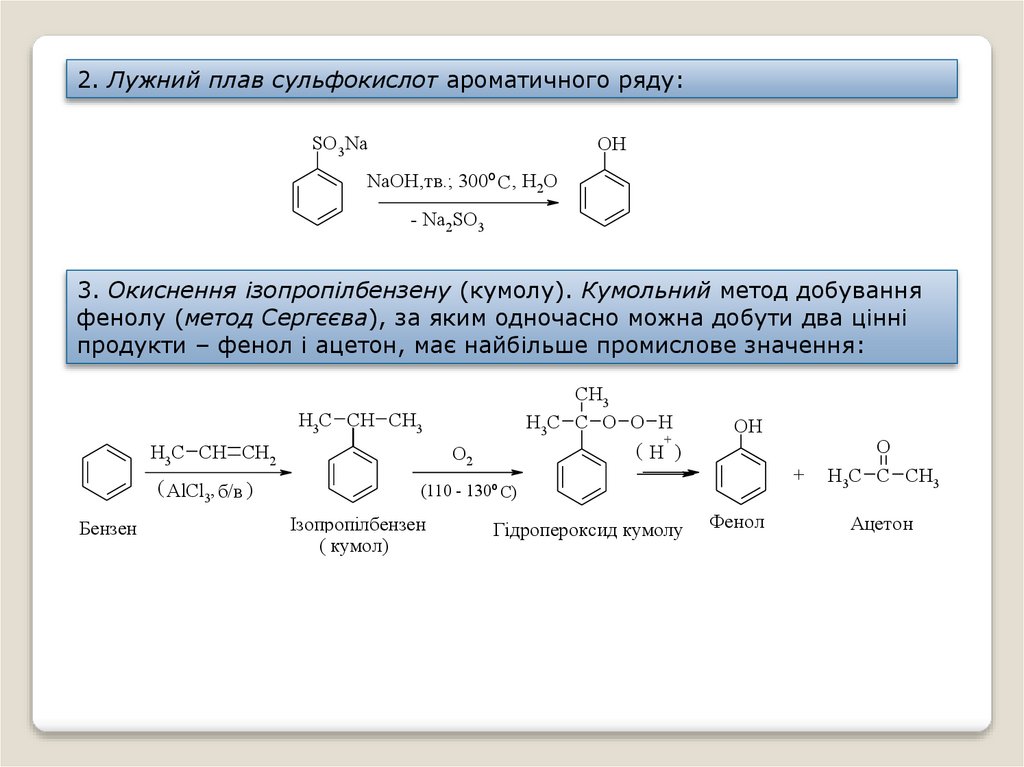
2. Лужний плав сульфокислот ароматичного ряду:SO3Na
OH
NaOH,тв.; 300º C , H2O
- Na2SO3
3. Окиснення ізопропілбензену (кумолу). Кумольний метод добування
фенолу (метод Сергєєва), за яким одночасно можна добути два цінні
продукти – фенол і ацетон, має найбільше промислове значення:
CH3
H3C C O O H
+
(H )
H3C CH CH3
Бензен
H3C CH CH2
О2
( AlCl3, б/в )
(110 - 130º C)
Ізопропілбензен
( кумол)
Гідропероксид кумолу
OH
+
Фенол
O
H3C C CH3
Ацетон
36.
Фенол – біла кристалічна речовина з характерним запахом, маєдезинфікуючі та антисептичні властивості. Фенол – отруйна речовина, при
попаданні на шкіру утворює опіки.
Фенол – класичний приклад для ілюстрації взаємного впливу атомів та
груп атомів в молекулі.
1. Вплив фенілу на гідроксил полягає в тому, що феніл, як сильний
акцептор електронів, відтягує електронну густину від атома Оксигену
гідроксильної групи. Внаслідок спряження електронна густина на атомі
Оксигену в молекулі фенолу зменшується, послаблюється зв’язок О−Н. Тому
Гідроген досить легко протонізується (відщеплюється у вигляді протону):
O H
Саме легкість відщеплення протону характеризує міру кислих
властивостей сполуки, а тому фенол називають ще карболовою кислотою
(використовується як бактерицидний дезинфікуючий засіб).
37.
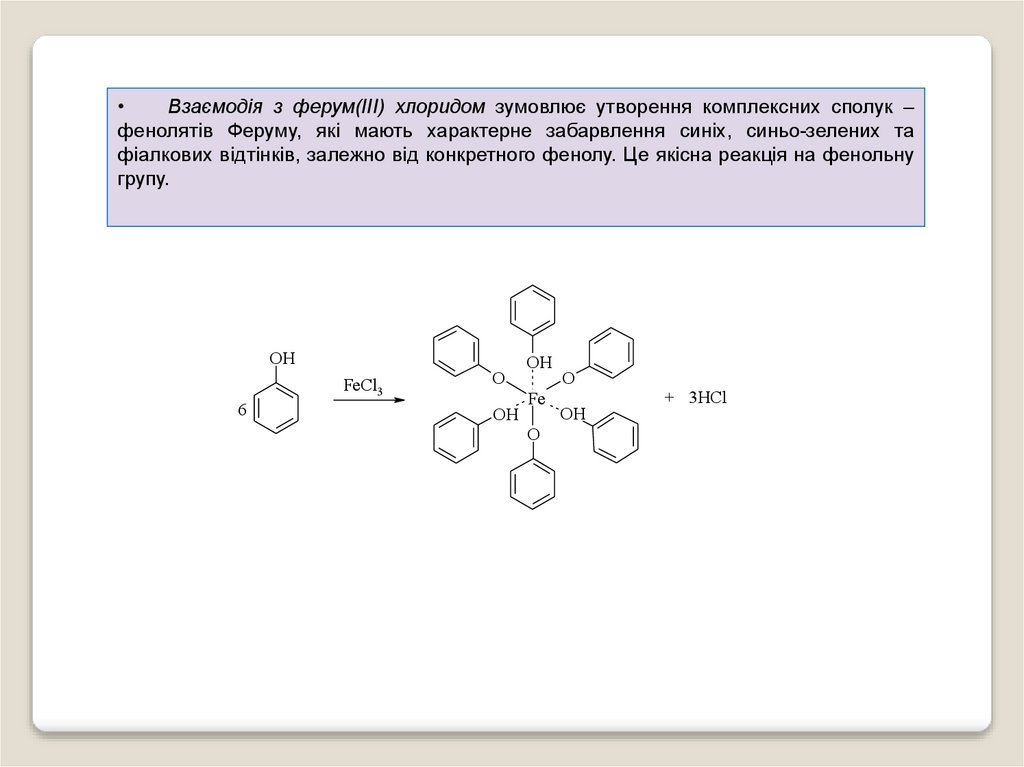
Взаємодія з ферум(ІІІ) хлоридом зумовлює утворення комплексних сполук –
фенолятів Феруму, які мають характерне забарвлення синіх, синьо-зелених та
фіалкових відтінків, залежно від конкретного фенолу. Це якісна реакція на фенольну
групу.
OH
FeCl3
6
O
OH
OH
Fe
O
O
OH
+ 3HCl
38.
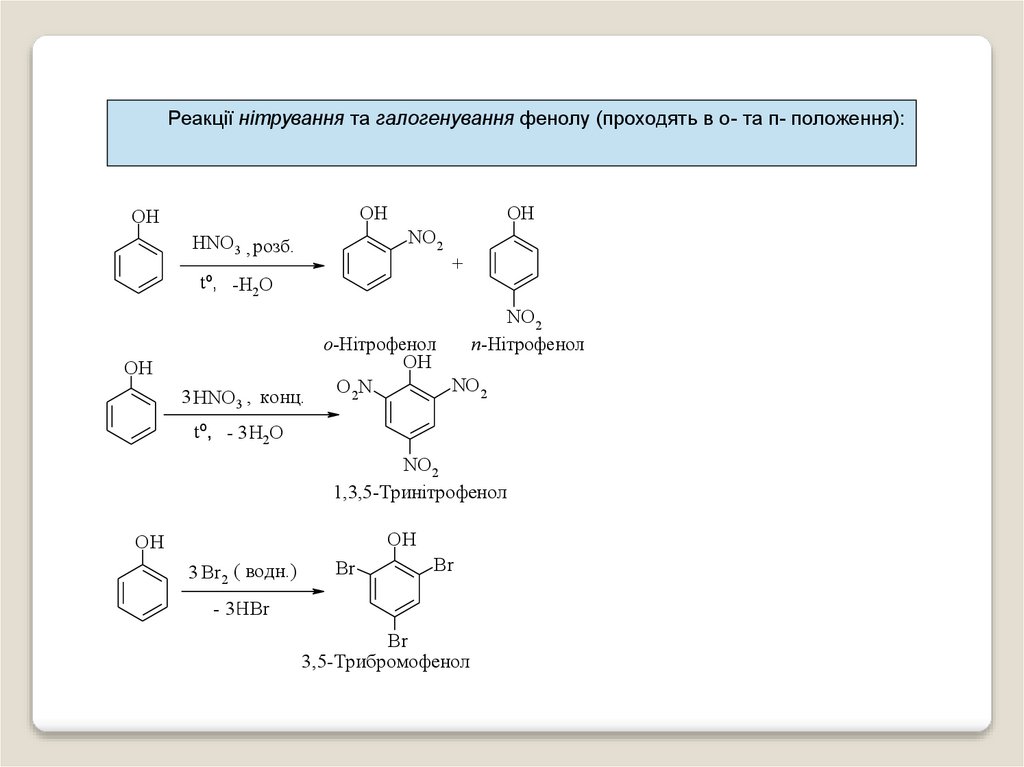
Реакції нітрування та галогенування фенолу (проходять в о- та п- положення):OH
OH
OH
NO2
HNO3 , розб.
+
tº, -Н2О
NO2
n-Нітрофенол
OH
3 HNO3 , конц.
о-Нітрофенол
OH
NO2
O 2N
tº, - 3 Н2О
NO2
1,3,5-Тринітрофенол
OH
OH
3 Br2, ( водн.)
Br
Br
- 3НBr
Br
3,5-Трибромофенол
39.
Феноли легко вступають в реакції конденсації за електрофільниммеханізмом з різними сполуками. Так, фенол з формальдегідом у присутності
кислого каталізатора утворює полімери лінійної будови – новолачні смоли:
OH
n HC
OH
OH
OH
CH2
CH2
O + (n+1)
(n-1)
Новолак
За наявності надлишку формальдегіду і лужних каталізаторів
утворюються резольні смоли (реактопласти, або термоактивні полімери) з
розгалуженою лінійною будовою:
OH
OH
OH
CH2
CH2
CH2OH
Резол
n
40.
Фенол (гідроксибензен, карболова кислота) – безбарвна кристалічнаречовина з характерним різким запахом, добре розчинна в більшості
органічних розчинників, але обмежено розчинна у воді. Водний розчин
застосовується як антисептик. Фенол – отруйна речовина, потрапляючи
на шкіру, викликає опіки. Він використовується для добування
барвників, пластмас, лікарських препаратів, ароматизуючих речовин
тощо.
Крезоли добувають поряд з фенолом з кам’яновугільної смоли.
Застосовують для добування штучних смол, а також в якості
антисептиків.
Спирти є досить поширеними сполуками у природі і виконують в живих
організмах різноманітні функції. Ще більш поширеними сполуками є
похідні спиртів, серед яких перш за все слід відзначити етери та
естери. Нижчі спирти та їх естери часто обумовлюють запах рослин і
входять до складу так званих ефірних олій. Вищі спирти та їх естери
входять до складу жирів, бджолиного воску, тощо.



































 chemistry
chemistry








